 | |
| Имена | |
|---|---|
| Название IUPAC 2,2,2-трифторэтанпероксоновая кислота | |
Другие названия
| |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| PubChem CID | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C2HF3O3 |
| Молярная масса | 130,022 г · Моль |
| Внешний вид | бесцветная жидкость |
| Температура кипения | 162 ° C (324 ° F; 435 K) |
| Растворимость | растворим в ацетонитриле, дихлорметан, диэтиловый эфир, сульфолан |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [ 77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Трифторпероксиуксусная кислота (трифторпероксиуксусная кислота, TFPAA ) представляет собой фторорганическое соединение, аналог пероксикислоты трифторуксусная кислота с конденсированной структурной формулой CF. 3COOOH. Это сильный окислитель для реакций органического окисления, например, в окислениях Байера-Виллигера кетонов. Это наиболее реакционная из органических пероксикислот, что позволяет ему успешно окислять относительно инертные алкены до эпоксидов, где другие пероксикислоты неэффективны. Он также может окислять халькогены в некоторых функциональных группах, например, путем превращения простых селеноэфиров в селонов. Это потенциально взрывоопасный материал и коммерчески недоступен, но при необходимости его можно быстро приготовить. Его использование в качестве лабораторного реагента было впервые предложено и разработано Уильямом Д. Эммонсом.
At стандартной температуры и давления окружающей среды, трифторперуксусная кислота представляет собой бесцветную жидкость с точкой кипения 162 ° C. Он растворим в ацетонитриле, дихлорметане, диэтиловом эфире и сульфолане и легко реагирует с водой. Как и все пероксикислоты, он потенциально взрывоопасен и требует осторожного обращения. Его нет в продаже, но его можно изготовить в лаборатории и хранить до нескольких недель при -20 ° C. Некоторые препаративные методы приводят к получению смесей, содержащих остаточный перекись водорода и трифторуксусную кислоту, и нагревание такой смеси чрезвычайно опасно; перекись водорода может быть разложена с использованием диоксида марганца для безопасности перед нагреванием.
Трифторперуксусная кислота может быть легко получена с помощью Organic Syntheses процесс обработки трифторуксусного ангидрида концентрированным (90%) водным раствором пероксида водорода:
Поскольку ангидрид образует трифторуксусную кислоту при контакте с водой, избыток ангидрида также служит для удаления растворителя из пероксидного реагента:
Более разбавленный раствор перекиси водорода (30%) может быть использован для образования трифторперуксусной кислоты для некоторых реакций из трифторуксусной кислоты.
Чтобы избежать опасность обращения с чистыми или высококонцентрированными растворами перекиси водорода, перекись водорода - мочевина может использоваться для получения перкислоты. В этом методе не используется вода, поэтому он дает полностью безводную надкислоту, что является преимуществом, когда присутствие воды приводит к побочным реакциям во время некоторых реакций окисления.
В случаях, когда для синтеза необходим буферный агент pH и Присутствие воды допустимо, был разработан другой подход. Взаимодействие трифторуксусного ангидрида с перкарбонатом, 2Na. 2CO. 3· 3H. 2O. 2дает трифторпераксусную кислоту и карбонат натрия, что позволяет избежать необходимость в дополнительном буфере.
Трифторперацетик кислота также может быть произведена in situ, что позволяет ей быстро реагировать с целевым субстратом, а не предварительно синтезировать партию реагента для последующего использования.
 (Bis ( трифторацетокси) иодо) бензол, C. 6H. 5I (OOCCF. 3). 2
(Bis ( трифторацетокси) иодо) бензол, C. 6H. 5I (OOCCF. 3). 2Трифторперуксусная кислота является пр Обычно используется как окислитель. В сентябре 1953 г. в журнале Американского химического общества была опубликована работа Уильяма Д. Эммонса, в которой сообщалось, что этот реагент, полученный in situ, был способен окислять анилин на нитробензол. В течение следующих двух лет Эммонс сообщил о методе приготовления этого реагента и опубликовал в этом журнале еще шесть рукописей, посвященных его применению; Эммонса отчасти помнят как пионера и разработчика трифторпераксусной кислоты в качестве лабораторного реагента, который с тех пор стал использоваться в качестве реагента для многих различных типов синтетических реакций.
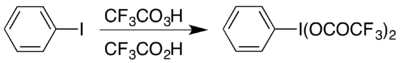
Одним из примеров является образование гипервалентного йода соединения (бис (трифторацетокси) иод) бензола, (CF. 3COO). 2IC. 6H. 5, которое используется для проведения перегруппировки Хофмана в кислых условиях. Гипервалентное соединение доступно двумя способами, и выбор обычно зависит от того, какие материалы доступны: его можно получить из его ацетатного аналога реакцией обмена или взаимодействием иодбензола с комбинацией трифторопераксусной кислоты и трифторуксусной кислоты:
 Обобщенное окисление Байера-Виллигера линейных и циклических кетонов
Обобщенное окисление Байера-Виллигера линейных и циклических кетонов Трифторопераксусная кислота - один из самых сильных реагентов, используемых для Байера –Окисление Виллигера, как следствие его высокой кислотности по сравнению с аналогичными перкислотами и пероксидами. Эта реакция превращает кетоны в либо сложные эфиры с прямой цепью, либо лактоны, и названа в честь Адольфа фон Байера и Виктора Виллигера., который первым сообщил об этом в 1899 году. Считается, что реакция протекает через промежуточное соединение Криджи и демонстрирует хорошую региоселективность и хемоселективность по положению атома кислорода. вставка вместе с сохранением стереохимии в соседнем положении, как можно увидеть в следующем примере. динатрийфосфат (Na. 2HPO. 4) добавляется в качестве pH-буфера для предотвращения того, чтобы высококислотный побочный продукт трифторуксусной кислоты вызывал гидролиз или переэтерификацию сложноэфирного продукта.

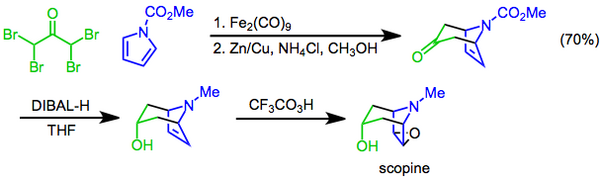
Реакция Прилежаева включает превращение алкена в эпоксид с использованием перкислоты в качестве окислителя и впервые описана в 1909. Реакция была использована в качестве конечной стадии синтеза скопина, тропанового алкалоида. В этом подходе [4 + 3] циклоприсоединение, опосредованное дижелезом нонакарбонил, используется для построения бициклического скелета, гидроксильная функциональная группа затем вводится с помощью диастереоселективное восстановление кетона диизобутилалюминийгидридом, и приготовление завершено эпоксидированием трифторперуксусной кислоты Прилежаева.
Высокая реакционная способность трифторперуксусной кислоты по сравнению с другими пероксикислотами позволяет успешно окислять относительно бедные электронами алкены, такие как 1-гексен и α, β-ненасыщенные сложные эфиры, такие как метилметакрилат, субстраты, которые обычно устойчивы к эпоксидированию пероксикислот. Включение дополнительной забуференной трифторуксусной кислоты в смесь дает вицинальную гидрокси-трифторацетатную структуру вместо эпоксида, который можно превратить в диол обработкой кислым метанолом, например, в следующем преобразовании 1-додецена в 1,2-додекандиол.

В случае соединения аллилового спирта с ближайшим карбонилом функциональная группа, эпоксид может подвергаться реакции расширения кольца с образованием диоксолана. Приведенный ниже процесс использовали как часть полного синтеза натурального продукта :

. Получение изомерного соединения включало аналогичное образование диоксолана. В этом случае использование трифторопераксусной кислоты, полученной из перекиси водорода, которая, следовательно, предположительно содержала следы воды, дало в основном гемиацеталь , а не диоксолан с замкнутым кольцом. Использование комплекса мочевины, который давал безводный материал, позволило получить диоксолан в качестве основного продукта. Диоксолан расширяется до системы 1,3-диоксана, обнаруженной в спороле на более поздней стадии синтеза.
Функциональные группы, содержащие гетероатомы в низких степенях окисления может быть окислен трифторперуксусной кислотой. Общие случаи включают окисление йода (например, образование соединения гипервалентного йода из упомянутого ранее йодбензола), азота, серы и селена.
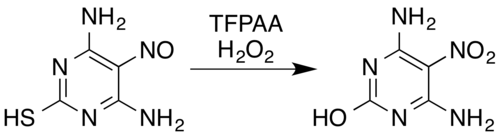
В случае азотсодержащих соединений известные превращения включают оксимы и ароматические первичные амины в нитросоединения (даже с электроноакцепторные заместители, например, от пентафторанилина до пентафторнитробензола), от нитрозаминов до нитраминов, образование ароматических N-оксидов и ароматических азинов N-оксиды и преобразование нитрозо соединений в нитросоединения или нитрамины. Например, смесь пероксида водорода и трифторперуксусной кислоты окисляет нитрозозамещенный пиримидин 4,6-диамино-5-нитрозопиримидин-2-тиол до его нитроаналога, одновременно удаляя тиол фрагмент окислительным гидролитическим десульфуризацией :
В случае элементов халькогена сульфидные фрагменты (R – S – R) могут быть окислены трифторопераксусной кислотой до формы сульфоксида (R – S (O) –R) и / или сульфона (R – S (O) 2 –R) в зависимости от используемых условий. В аналогичной селеновой системе окисление селеноэфиров (R – Se – R) трифторперуксусной кислотой дает селоны (R – Se (O) 2 –R) без образования связанных селеноксиды (R – Se (O) –R) в качестве выделяемого продукта, реакция, которая особенно эффективна, когда R представляет собой арильную группу. Общий подход к образованию сульфинилхлоридов (RS (O) Cl) представляет собой реакцию соответствующего тиола с сульфурилхлоридом (SO. 2Cl. 2). В случаях, когда вместо этого получается сульфенилхлорид (RSCl), последующее окисление трифторперуксусной кислоты дает желаемый продукт, как в случае 2,2,2-трифтор-1,1-дифенил этантиола. :

Окисление тиофена трифторперуксусной кислотой иллюстрирует конкурирующие пути реакции, при этом возможно как S-окисление, так и эпоксидирование. Основной путь первоначально образует сульфоксид, но это химическое вещество быстро подвергается димеризации типа Дильса-Альдера , прежде чем произойдет какое-либо дальнейшее окисление - ни тиофен-S-оксид, ни тиофен-S, S -диоксид находятся среди продуктов реакции. Затем димер может быть окислен дальше, превращая одну из групп S-оксида в S, S-диоксид. В второстепенном пути реакции эпоксидирование Прилежаева приводит к образованию тиофен-2,3-эпоксида, который быстро перестраивается в изомер тиофен-2-он. Эксперименты по захвату демонстрируют, что это эпоксидный путь не является альтернативной реакцией промежуточного соединения S-оксида, и эксперименты по изотопному мечению демонстрируют, что 1,2-гидридный сдвиг (NIH shift ), и, таким образом, задействован катионный промежуточный продукт. Выбор метода получения трифторпераксусной кислоты важен, поскольку вода подавляет второстепенный путь реакции, вероятно, потому, что она действует как конкурирующее основание.

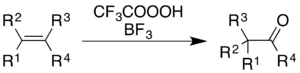
Использование трифторопераксусной кислоты с трифторидом бора вызывает окисление алкенов и ароматических колец с сопутствующей перегруппировкой молекулярного скелета.
Для алкенов реакция дает кетонный продукт, хотя механистический процесс это не просто эпоксидирование, за которым следует BF 3 -катализируемая перегруппировка Вагнера – Меервейна :
Для ароматических углеводородов примером, продемонстрированным в отчете по органическому синтезу, является преобразование 1,2,3,4, От 5,6- гексаметилбензола до 2,3,4,5,6,6-гексаметил-2,4-циклогексадиенона:

В дополнение к простому окислению ароматических колец с образованием карбонильных соединений (см. § Окисление с кислотной перегруппировкой ), трифторперуксусная кислота может полностью расщеплять c углерод-углеродные связи внутри кольца. В отличие от других окислений алкилароматических структур, которые дают бензойные кислоты и родственные соединения путем расщепления алкильной цепи в реакционноспособном бензильном положении, трифторпераксусная кислота вызывает «обратное окисление», расщепляя само ароматическое кольцо, оставляя алкил группа неповреждена.

Такая селективность по отношению к определенным типам связей позволяет использовать ее для разложения сложных смесей углеводородов, таких как уголь, с целью определения структурных деталей.
Ароматические системы содержащие гетероатомы, устойчивы к этому раскрытию кольца, поскольку окисление гетероатомов происходит предпочтительно и дезактивирует кольцо в направлении электрофильной атаки пероксикислоты. Например, пурины, пиридины и хинолины вместо этого образуют N-оксиды, а системы серы, такие как октафтор дибензотиофен, превращаются в сульфоны.
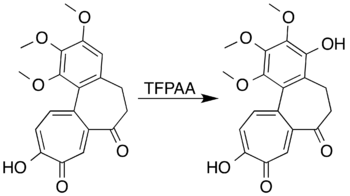
Ароматические системы с заместителями, активирующими кольцо, могут быть окислены с образованием фенолов вместо того, чтобы подвергаться реакции раскрытия цикла. Мезитилен, например, реагирует с трифторопераксусной кислотой с образованием мезитола (2,4,6-триметилфенола). Исследователи, пытавшиеся образовать лактон путем окисления Байера-Виллигера 7-оксодацетамидо колхицина, не смогли получить желаемый продукт, но достигли окисления ароматического кольца с образованием фенольного производного с высоким выходом: