 Цитоплазматический динеин на микротрубочке
Цитоплазматический динеин на микротрубочке Динеин - это семейство моторных белков цитоскелета , которые перемещаются по микротрубочкам в клетках. Они преобразуют химическую энергию, запасенную в АТФ, в механическую работу. Динеин транспортирует различные клеточные грузы, обеспечивает силы и смещения, важные для митоза, и управляет ритмом эукариотических ресничек и жгутиков. Все эти функции зависят от способности динеина перемещаться к минус-концу микротрубочек, известной как ретроградный транспорт, поэтому они называются «направленными на минус-конец двигателями». Напротив, большинство моторных белков кинезина перемещаются к положительному концу микротрубочек.
| Тяжелая цепь динеина, N-концевой участок 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | DHC_N1 | ||||||||
| Pfam | PF08385 | ||||||||
| InterPro | IPR013594 | ||||||||
| |||||||||
| тяжелая цепь динеина, N-концевой участок 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | DHC_N2 | ||||||||
| Pfam | PF08393 | ||||||||
| InterPro | IPR013602 | ||||||||
| |||||||||
| Тяжелая цепь динеина и область D6 мотора динеина | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Dynein_heavy | ||||||||
| Pfam | PF03028 | ||||||||
| InterPro | IPR004273 | ||||||||
| |||||||||
| Легкая промежуточная цепь динеина (DLIC) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||
| Символ | DLIC | ||||||||||
| Pfam | PF05783 | ||||||||||
| Pfam клан | CL0023 | ||||||||||
| |||||||||||
| Легкая цепь динеина типа 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура димера pin / lc8 человека со связанным пептидом структура димера pin / lc8 человека со связанным пептидом | |||||||||
| Идентификаторы | |||||||||
| Символ | Dynein_light | ||||||||
| Pfam | PF01221 | ||||||||
| InterPro | IPR001372 | ||||||||
| PROSITE | PDOC00953 | ||||||||
| SCOPe | 1bkq / SUPFAM | ||||||||
| |||||||||
| Roadblock | |||||||||
|---|---|---|---|---|---|---|---|---|---|
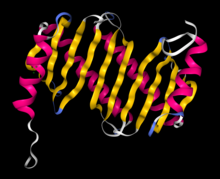 Структура Roadblock / LC7 белка - RCSB PDB 1y4o Структура Roadblock / LC7 белка - RCSB PDB 1y4o | |||||||||
| Идентификаторы | |||||||||
| Symbol | Robl1, Robl2 | ||||||||
| Pfam | PF03259 | ||||||||
| InterPro | IPR016561 | ||||||||
| SCOPe | 1y4o / SUPFAM | ||||||||
| |||||||||
Динеины можно разделить на две группы: цитоплазматические динеины и аксонемные динеины, которые также называют цилиарными или жгутиковыми динеинами..
Аксонемальный динеин вызывает скольжение микротрубочек в аксонемах ресничек и жгутиков и обнаруживается только в клетках, которые имеют эти структуры..
Цитоплазматический динеин, обнаруженный во всех клетках животных и, возможно, также в клетках растений, выполняет функции, необходимые для выживания клеток, такие как транспорт органелл и сборка центросомы. Цитоплазматический динеин движется по микротрубочке; то есть один или другой его стебель всегда прикреплен к микротрубочке, так что динеин может «проходить» значительное расстояние вдоль микротрубочки, не отделяясь.
Цитоплазматический динеин помогает позиционировать комплекс Гольджи и другие органеллы в клетке. Он также помогает транспортировать грузы, необходимые для функционирования клеток, такие как везикулы, образованные эндоплазматическим ретикулумом, эндосомами и лизосомами (Karp, 2005). Динеин участвует в перемещении хромосом и позиционировании митотических веретен для деления клеток. Динеин переносит органеллы, везикулы и, возможно, фрагменты микротрубочек вдоль аксонов нейронов к телу клетки в процессе, называемом ретроградным аксоплазматическим транспортом.
Цитоплазматический динеин позиционирует веретено в месте цитокинеза, заякоряясь в коре клеток и притягивая астральные микротрубочки, исходящие из центросомы. Постдокторант Томоми Киёмицу из Массачусетского технологического института обнаружил, что динеин играет роль моторного белка в выравнивании хромосом в середине клетки во время метафазы митоза. Динеин притягивает микротрубочки и хромосомы к одному концу клетки. Когда конец микротрубочек приближается к клеточной мембране, они испускают химический сигнал, который направляет динеин на другую сторону клетки. Он делает это неоднократно, поэтому хромосомы оказываются в центре клетки, что необходимо для митоза. Бутонированные дрожжи были мощным модельным организмом для изучения этого процесса и показали, что динеин нацелен на плюс-концы астральных микротрубочек и доставляется в кору клетки посредством механизма разгрузки.
И динеин, и кинезин могут использоваться вирусами для опосредования процесса репликации вируса. Многие вирусы используют систему транспорта микротрубочек для транспортировки ядер нуклеиновых кислот / белков к местам внутриклеточной репликации после проникновения через клеточную мембрану. Мало что известно о мотор-специфических сайтах связывания вирусов, но известно, что некоторые вирусы содержат богатые пролином последовательности (которые расходятся между вирусами), которые при удалении снижают связывание динактина, транспорт аксонов (в культура) и нейроинвазия in vivo. Это говорит о том, что богатые пролином последовательности могут быть основным сайтом связывания, кооптирующим динеин.
Каждая молекула динеинового мотора представляет собой сложную белковую сборку, состоящую из множества более мелких полипептидных субъединиц. Цитоплазматический и аксонемальный динеин содержат одни и те же компоненты, но они также содержат некоторые уникальные субъединицы..
 Цитоплазматические домены динеина 2 человека. Показан порядок областей, представляющих интерес для моторных доменов цитоплазматического динеина 2 человека, по мере их прохождения от линкера до С-конца. Это ориентировано на демонстрацию общего связанного положения Dynein на микротрубочке. Эффект зеркала позволяет наблюдать динеин с обеих сторон комплекса.
Цитоплазматические домены динеина 2 человека. Показан порядок областей, представляющих интерес для моторных доменов цитоплазматического динеина 2 человека, по мере их прохождения от линкера до С-конца. Это ориентировано на демонстрацию общего связанного положения Dynein на микротрубочке. Эффект зеркала позволяет наблюдать динеин с обеих сторон комплекса. Цитоплазматический динеин, молекулярная масса которого составляет около 1,5 мегадальтон (МДа), представляет собой димер димеров, содержащий примерно двенадцать полипептидных субъединиц: две идентичные «тяжелые цепи», массой 520 кДа, которые содержат активность АТФазы и, таким образом, ответственны за создание движения вдоль микротрубочки; две промежуточные цепи 74 кДа, которые, как предполагается, прикрепляют динеин к его грузу; две легкие промежуточные цепи 53–59 кДа; и несколько легких цепей.
Генерирующая силу АТФазная активность каждой тяжелой цепи динеина находится в его большой пончиковой «голове», которая связана с другими белками ААА, в то время как два выступа из головы соединяются это к другим цитоплазматическим структурам. Один выступ, стержень в виде спиральной спирали, связывается с поверхностью микротрубочки и «ходит» по ней через повторяющийся цикл отсоединения и повторного прикрепления. Другой выступ, удлиненный хвост, связывается с субъединицами легкой промежуточной, промежуточной и легкой цепей, которые прикрепляют динеин к его грузу. Чередующаяся активность спаренных тяжелых цепей в полном цитоплазматическом двигателе динеина позволяет одной молекуле динеина транспортировать свой груз, «идя» на значительное расстояние по микротрубочке, не отделяясь полностью.
В апо-состоянии динеина мотор не содержит нуклеотидов, кольцо домена AAA существует в открытой конформации, а MTBD существует в состоянии с высоким сродством. Многое о доменах AAA остается неизвестным, но AAA1 хорошо известен как первичный сайт гидролиза АТФ в динеине. Когда АТФ связывается с AAA1, он инициирует конформационное изменение кольца домена AAA в «закрытую» конфигурацию, перемещение опоры и конформационное изменение линкера. Линкер изгибается и смещается с AAA5 на AAA2, оставаясь связанным с AAA1. Одна прикрепленная к ножке альфа-спираль вытягивается контрфорсом, сдвигая спираль на половину гептадного повтора относительно ее партнера по спиральной спирали и изгибая ножку. В результате MTBD динеина переходит в состояние низкого сродства, позволяя двигателю перемещаться к новым сайтам связывания. После гидролиза АТФ ножка вращается, продвигая динеин дальше по MT. После высвобождения фосфата MTBD возвращается в состояние высокого сродства и повторно связывает MT, запуская силовой удар. Линкер возвращается к прямой конформации и возвращается к ААА5 от ААА2 и создает рычажное действие, вызывая максимальное смещение динеина, достигаемое за счет силового удара. Цикл завершается высвобождением АДФ, который возвращает кольцо домена ААА обратно в «Открытая» конфигурация.
Динеин дрожжей может проходить по микротрубочкам, не отделяясь, однако у многоклеточных животных цитоплазматический динеин должен активироваться связыванием динактина, другого мультисубъединичного белка, необходимого для митоз и грузовой адаптер. Три-комплекс, который включает динеин, динактин и грузовой адаптер, является ультрапроцессорным и может проходить большие расстояния, не отделяясь, чтобы достичь внутриклеточного назначения груза. На данный момент идентифицированные грузовые адаптеры включают BicD2, Hook3, FIP3 и Spindly. Легкая промежуточная цепь, которая является членом суперсемейства Ras, опосредует прикрепление нескольких грузовых адаптеров к динеиновому двигателю. Другие субъединицы хвоста также могут способствовать этому взаимодействию, что подтверждается структурой динеин-динактин-BicD2 с низким разрешением.
Одной из основных форм моторной регуляции динеина в клетках является динактин. Он может потребоваться почти для всех функций цитоплазматического динеина. В настоящее время это наиболее изученный динеиновый партнер. Динактин - это белок, который помогает во внутриклеточном транспорте по клетке, связываясь с цитоплазматическим динеином. Динактин может функционировать как каркас, с которым связываются другие белки. Он также действует как рекрутирующий фактор, который локализует динеин там, где он должен быть. Есть также некоторые свидетельства того, что он может регулировать кинезин-2. Комплекс динактина состоит из более чем 20 субъединиц, из которых p150 (Glued) является самой крупной. Нет окончательных доказательств того, что динактин сам по себе влияет на скорость мотора. Однако это влияет на процессивность мотора. Регуляция связывания, вероятно, является аллостерической: эксперименты показали, что усиление процессивности динеинового мотора не зависит от домена связывания субъединицы p150 с микротрубочками.
 Поперечный разрез аксонема с плечами аксонемного динеина
Поперечный разрез аксонема с плечами аксонемного динеина Аксонема-динеины бывают разных форм, которые содержат одну, две или три неидентичные тяжелые цепи (в зависимости от организма и расположения в ресничке ). Каждая тяжелая цепь имеет глобулярный моторный домен со структурой в форме пончика, которая, как полагают, напоминает структуру других белков ААА, спиралевидный «стержень», который связывается с микротрубочкой, и удлиненный хвост (или «стержень»).), которая прикрепляется к соседней микротрубочке той же аксонемы. Каждая молекула динеина, таким образом, образует поперечный мостик между двумя соседними микротрубочками аксонемы ресничек. Во время «силового удара», который вызывает движение, моторный домен ААА-АТФазы претерпевает конформационное изменение, которое заставляет стержень, связывающий микротрубочки, поворачиваться относительно хвоста, связывающего груз, в результате чего одна микротрубочка скользит относительно другой (Karp, 2005). Это скольжение вызывает изгибающее движение, необходимое для того, чтобы реснички ударяли и толкали клетку или другие частицы. Группы молекул динеина, ответственные за движение в противоположных направлениях, вероятно, активируются и инактивируются скоординированным образом, так что реснички или жгутики могут двигаться вперед и назад. Радиальная спица была предложена в качестве (или одной из) структур, которые синхронизируют это движение.
Регуляция активности аксонемального динеина имеет решающее значение для частоты биений жгутиков и формы волны ресничек. Способы регуляции аксонемного динеина включают фосфорилирование, окислительно-восстановительный потенциал и кальций. Механические силы на аксонему также влияют на функцию аксонемного динеина. Тяжелые цепи внутреннего и внешнего плеч аксонемального динеина фосфорилируются / дефосфорилируются для контроля скорости скольжения микротрубочек. Тиоредоксины, связанные с другими ветвями аксонемы динеина, окисляются / восстанавливаются, чтобы регулировать место связывания динеина в аксонеме. Центерин и компоненты внешних плеч аксонемального динеина обнаруживают колебания концентрации кальция. Колебания кальция играют важную роль в изменении формы волны ресничек и частоты биений жгутиков (King, 2012).
Белок, ответственный за движение ресничек и жгутиков, был впервые обнаружен и назван динеином в 1963 году. (Карп, 2005). 20 лет спустя был выделен и идентифицирован цитоплазматический динеин, существование которого предполагалось с момента открытия жгутикового динеина (Karp, 2005).
Сегрегация гомологичных хромосом на противоположных полюсах клетки происходит во время первого деления мейоза. Правильная сегрегация важна для производства гаплоидных продуктов мейоза с нормальным набором хромосом. Формирование хиазм (события кроссоверной рекомбинации), по-видимому, обычно способствует правильной сегрегации. Однако у делящихся дрожжей Schizosaccharomyces pombe, когда хиазмы отсутствуют, динеин способствует сегрегации. Dhc1, моторная субъединица динеина, необходима для хромосомной сегрегации как при наличии, так и при отсутствии хиазм. Белок легкой цепи Dlc1 динеина также необходим для сегрегации, особенно при отсутствии хиазм.