| Фактор элонгации Thermo Unstable | |||||||||
|---|---|---|---|---|---|---|---|---|---|
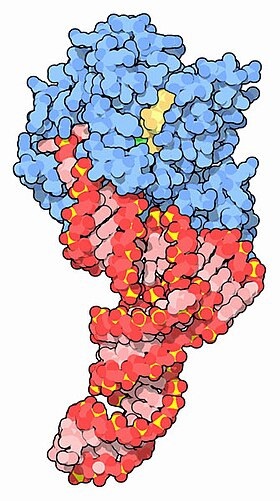 EF-Tu (синий) в комплексе с тРНК (красный) и GTP (желтый) EF-Tu (синий) в комплексе с тРНК (красный) и GTP (желтый) | |||||||||
| Идентификаторы | |||||||||
| Символ | EF-Tu | ||||||||
| Pfam | GTP_EFTU | ||||||||
| Pfam клан | CL0023 | ||||||||
| InterPro | IPR004541 | ||||||||
| PROSITE | PDOC00273 | ||||||||
| CATH | 1ETU | ||||||||
| SCOPe | 1ETU / SUPFAM | ||||||||
| CDD | cd00881 | ||||||||
| |||||||||
| EF-Tu | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | GTP_EFTU_D2 | ||||||||
| Pfam | PF03144 | ||||||||
| InterPro | IPR004161 | ||||||||
| CDD | cd01342 | ||||||||
| |||||||||
| Коэффициент удлинения Tu домен 3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | GTP_EFTU_D3 | ||||||||
| Pfam | PF03143 | ||||||||
| InterPro | IPR004160 | ||||||||
| CDD | cd01513 | ||||||||
| |||||||||
EF-Tu (термонестабильный фактор элонгации ) - это фактор удлинения прокариот, ответственный за катализирование связывания аминоацил-тРНК (аа-тРНК) к рибосоме. Это G-белок, который облегчает отбор и связывание aa-тРНК с A-сайтом рибосомы. Как отражение его решающей роли в трансляции, EF-Tu является одним из наиболее распространенных и высококонсервативных белков у прокариот. Он обнаружен в митохрондриях эукариот как TUFM.
. Как семейство факторов элонгации, EF-Tu также включает его эукариотический и архейный гомолог, альфа-субъединицу eEF-1 (EF-1A)..
Факторы элонгации являются частью механизма, который синтезирует новые белки посредством трансляции в рибосоме. Трансферные РНК (тРНК) несут отдельные аминокислоты, которые интегрируются в последовательность белка, и имеют антикодон для конкретной аминокислоты, которой они заряжены. Информационная РНК (мРНК) несет генетическую информацию, которая кодирует первичную структуру белка, и содержит кодоны, кодирующие каждую аминокислоту. Рибосома создает белковую цепь, следуя коду мРНК и интегрируя аминокислоту аминоацил-тРНК (также известную как заряженная тРНК) в растущую цепь полипептида.
Есть три сайты на рибосоме для связывания тРНК. Это аминоацильный / акцепторный сайт (сокращенно A), пептидильный сайт (сокращенно P) и сайт выхода (сокращенно E). P-сайт содержит тРНК, связанную с синтезируемой полипептидной цепью, а A-сайт является сайтом связывания заряженной тРНК с антикодоном, комплементарным кодону мРНК, ассоциированному с этим сайтом. После связывания заряженной тРНК с A-сайтом, пептидная связь образуется между растущей полипептидной цепью на P-сайте тРНК и аминокислотой тРНК A-сайта, и весь полипептид становится переносится с тРНК P-сайта на тРНК A-сайта. Затем, в процессе, катализируемом прокариотическим фактором элонгации EF-G (исторически известным как транслоказа), происходит скоординированная транслокация тРНК и мРНК, при этом тРНК P-сайта перемещается в E-сайт, где он отделяется от рибосомы, и тРНК A-сайта перемещается, чтобы занять свое место в P-сайте.
 Циклическая роль EF-Tu в трансляции. Структуры происходят из PDB 1EFT, 1TUI и 1TTT.
Циклическая роль EF-Tu в трансляции. Структуры происходят из PDB 1EFT, 1TUI и 1TTT.EF-Tu участвует в процессе удлинения полипептида при синтезе белка. У прокариот основная функция EF-Tu заключается в транспортировке правильной аа-тРНК к А-сайту рибосомы. Как G-белок он использует GTP для облегчения своей функции. Вне рибосомы EF-Tu образует комплекс с комплексами GTP (EF-Tu • GTP) с aa-тРНК с образованием стабильного EF-Tu • GTP • aa-тРНК тройного комплекса. EF-Tu • GTP связывает все правильно заряженные аа-тРНК примерно с одинаковым сродством, за исключением заряженных инициирующих остатков и селеноцистеина. Это может быть достигнуто, потому что, хотя разные аминокислотные остатки имеют разные свойства боковой цепи, тРНК, связанные с этими остатками, имеют различные структуры, чтобы компенсировать различия в аффинности связывания боковой цепи.
Связывание аа-тРНК с EF-Tu • GTP позволяет тройному комплексу перемещаться в А-сайт активной рибосомы, в котором антикодон тРНК связывается с кодоном мРНК. Если правильный антикодон связывается с кодоном мРНК, рибосома изменяет конфигурацию и изменяет геометрию домена GTPase EF-Tu, что приводит к гидролизу GTP, связанного с EF -Вт до GDP и Pi. По существу, рибосома функционирует как белок, активирующий GTPase (GAP) для EF-Tu. При гидролизе GTP конформация EF-Tu резко изменяется и диссоциирует от аа-тРНК и комплекса рибосом. Затем aa-тРНК полностью входит в A-сайт, где ее аминокислота приближается к полипептиду P-сайта, и рибосома катализирует ковалентный перенос полипептида на аминокислоту.
В цитоплазме на деактивированный EF-Tu • GDP действует фактор удлинения прокариот EF-Ts, который заставляет EF-Tu высвобождать связанный GDP. После диссоциации EF-Ts, EF-Tu способен образовывать комплекс с GTP из-за того, что концентрация GTP в цитоплазме в 5–10 раз выше, чем GDP, что приводит к реактивации EF-Tu • GTP, которая затем может связываться с другой аа-тРНК.
EF-Tu способствует точности перевода тремя способами. При трансляции фундаментальная проблема заключается в том, что близкие к родственным антикодоны обладают сходной аффинностью связывания с кодоном, как родственные антикодоны, так что связывания антикодон-кодон в одной рибосоме недостаточно для поддержания высокой точности трансляции. Это решается тем, что рибосома не активирует ГТФазную активность EF-Tu, если тРНК в А-сайте рибосомы не соответствует кодону мРНК, что предпочтительно увеличивает вероятность того, что неправильная тРНК покинет рибосому. Кроме того, независимо от соответствия тРНК, EF-Tu также вызывает задержку после освобождения от аа-тРНК, прежде чем аа-тРНК полностью войдет в А-сайт (процесс, называемый аккомодацией). Этот период задержки является второй возможностью для неправильно заряженных аа-тРНК выйти из A-сайта до того, как неправильная аминокислота будет необратимо добавлена к полипептидной цепи. Третий механизм - это менее изученная функция EF-Tu по грубой проверке ассоциаций а-тРНК и отклонению комплексов, в которых аминокислота не связана с правильной тРНК, кодирующей для нее.
EF-Tu был обнаружен в больших количествах в цитоскелете бактерий, совместно локализующихся под клеточной мембраной с MreB, элементом цитоскелета, который поддерживает форма ячейки. Было показано, что дефекты в EF-Tu приводят к дефектам бактериальной морфологии. Кроме того, EF-Tu обладает некоторыми характеристиками, подобными шаперону, при этом некоторые экспериментальные данные свидетельствуют о том, что он способствует рефолдингу ряда денатурированных белков in vitro.
 EF-Tu, связанный с GDP (желтый) и GDPNP (красный), GTP-подобной молекулой. ГТФазный домен (домен I) EF-Tu изображен темно-синим цветом, а олигонуклеотид-связывающие домены II и III - светло-синим. Структуры взяты из PDB 1EFT и 1TUI для GDP- и GDPNP-связанного EF-Tu, соответственно.
EF-Tu, связанный с GDP (желтый) и GDPNP (красный), GTP-подобной молекулой. ГТФазный домен (домен I) EF-Tu изображен темно-синим цветом, а олигонуклеотид-связывающие домены II и III - светло-синим. Структуры взяты из PDB 1EFT и 1TUI для GDP- и GDPNP-связанного EF-Tu, соответственно. EF-Tu представляет собой мономерный белок с молекулярная масса около 43 кДа в Escherichia coli. Белок состоит из трех структурных доменов : GTP-связывающего домена и двух олигонуклеотидных -связывающих доменов, часто называемых доменом 2 и доменом 3. N-концевой домен I EF-Tu представляет собой GTP-связывающий домен. Он состоит из шести бета-нити ядра, окруженного шестью альфа-спиралями. Домены II и III EF-Tu, олигонуклеотидсвязывающие домены, оба имеют структуры бета-бочки.
GTP-связывающий домен I претерпевает резкие конформационные изменения при гидролизе GTP до GDP, позволяя EF-Tu диссоциировать от аа-тРНК и покидать рибосому. Реактивация EF-Tu достигается связыванием GTP в цитоплазме, что приводит к значительным конформационным изменениям, которые реактивируют сайт связывания тРНК EF-Tu. В частности, связывание GTP с EF-Tu приводит к повороту домена I на ~ 90 ° относительно доменов II и III, обнажая остатки активного сайта связывания тРНК.
Домен 2 принимает бета-цилиндрическая структура и участвует в связывании заряженной тРНК. Этот домен структурно связан с С-концевым доменом EF2, с которым он проявляет слабое сходство последовательностей. Этот домен также обнаружен в других белках, таких как фактор инициации трансляции IF-2 и белки устойчивости к тетрациклину. Домен 3 представляет собой С-концевой домен, который принимает структуру бета-ствола и участвует в связывании как с заряженной тРНК, так и с EF1B (или EF-Ts).
GTP-связывающий домен консервативен как в EF-1alpha / EF-Tu, так и в EF-2 / EF -G и, таким образом, кажется типичным для GTP-зависимых белков, которые связывают неинициаторные тРНК с рибосомой. Семейство GTP-связывающего фактора синтеза белка также включает эукариотический пептидный фактор высвобождения цепи GTP-связывающий субъединицы и прокариотические фактор высвобождения пептидной цепи 3 (RF-3); прокариотический GTP-связывающий белок lepA и его гомолог у дрожжей (GUF1) и Caenorhabditis elegans (ZK1236.1); дрожж HBS1;рат статин S1; и прокариотический селеноцистеин -специфический фактор элонгации selB.
Наряду с рибосомой, EF-Tu является одной из наиболее важных мишеней опосредованного антибиотиком ингибирования трансляции. Антибиотики, нацеленные на EF-Tu, можно разделить на одну из двух групп, в зависимости от механизма действия, и на одно из четырех структурных семейств. В первую группу входят антибиотики пульвомицин и GE2270A, ингибирующие образование тройного комплекса. Ко второй группе относятся антибиотики кирромицин и энацилоксин, которые предотвращают высвобождение EF-Tu из рибосомы после гидролиза GTP.