 | |
| Имена | |
|---|---|
| Название IUPAC 2-амино-3-селанилпропановая кислота | |
| Другое названия L-селеноцистеин; 3-селанил- L -аланин; Селен цистеин | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.236.386 |
| KEGG8200> | |
| PubChem CID | |
| UNII | |
| Панель мониторинга CompTox (EPA ) | |
InChI
| |
УЛЫБАЕТСЯ
| |
| Свойства | |
| Химическая формула | C3H7NO2Se |
| Молярная масса | 168,065 г · моль |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
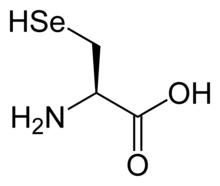
Селенок Истеин (символ Sec или U, в более ранних публикациях также как Se-Cys ) - 21-я протеиногенная аминокислота.
селеноцистеин естественным образом существует во всех трех сферах жизни, но не во всех родословных, как строительный блок селенопротеинов. Селеноцистеин представляет собой аналог цистеина с селен -содержащей селенольной группой вместо сера -содержащей тиола группа.
Селеноцистеин присутствует в нескольких ферментах (например, глутатионпероксидазах, тетрайодтиронин-5'-дейодиназах, тиоредоксинредуктазах, формиатдегидрогеназы, глицинредуктазы, метионин-R-сульфоксидредуктаза B1 (SEPX1 ) и некоторые гидрогеназы ).
Селеноцистеин был открыт биохимиком Трессой Штадтман в Национальном институте здравоохранения.
Биохимическая полезность селеноцистеина была описана биохимиком Робертом Хондалом (Университет Вермонта ) и химик Ханс Райх (Университет Висконсина-Мэдисон ).
Селеноцистеин имеет структуру, аналогичную структуре цистеина, но с атомом селена вместо обычная сера, образующая селенольную группу, которая депротонирована при физиологическом pH. (Как и другие природные протеиногенные аминокислоты, цистеин и селеноцистеин имеют L хиральность в старых обозначениях D / L, основанных на гомологии с D- и L- глицеральдегидом. В новой системе обозначения хиральности R / S на основе атомных номеров атомов рядом с асимметричным углеродом, у них есть R chira Это связано с присутствием серы или селена в качестве второго соседа асимметричного углерода. (Остальные хиральные аминокислоты, имеющие только более легкие атомы в этом положении, обладают S-хиральностью.)
Белки, содержащие один или несколько остатков селеноцистеина, называются селенопротеинами . Большинство селенопротеинов содержат один остаток селеноцистеина. Селенопротеины, зависящие от каталитической активности селеноцистеина, называются селеноферментами . Было обнаружено, что в селеноферментах используются структуры каталитической триады, которые влияют на нуклеофильность селеноцистеина активного центра.
Селеноцистеин имеет как более низкую pKa (5,47) и более низкий восстановительный потенциал, чем у цистеина. Эти свойства делают его очень подходящим для белков, которые участвуют в антиоксидантной активности.
Хотя он обнаружен в трех сферах жизни, он не универсален для всех организмов. В отличие от других аминокислот, присутствующих в биологических белках, селеноцистеин не кодируется непосредственно в генетическом коде. Вместо этого он кодируется особым образом с помощью кодона UGA , который обычно является стоп-кодоном . Такой механизм называется, и его эффективность зависит от синтезируемого селенопротеина и от факторов инициации трансляции . Когда клетки растут в отсутствие селена, трансляция селенопротеинов заканчивается на кодоне UGA, что приводит к усеченному нефункциональному ферменту. Кодон UGA кодирует селеноцистеин за счет присутствия последовательности вставки селеноцистеина (SECIS) в мРНК. Элемент SECIS определяется характерными нуклеотидными последовательностями и образцами спаривания оснований вторичной структуры. В бактериях элемент SECIS обычно располагается сразу после кодона UGA в пределах рамки считывания селенопротеина. У архей и в эукариот элемент SECIS находится в 3'-нетранслируемой области (3'-UTR) мРНК и может направлять множество кодонов UGA для кодирования остатки селеноцистеина.
Опять же, в отличие от других аминокислот, в клетке не существует свободного пула селеноцистеина. Его высокая реактивность может вызвать повреждение клеток. Вместо этого клетки хранят селен в менее реакционной окисленной форме, селеноцистине, или в метилированной форме, селенометионине. Синтез селеноцистеина происходит на специализированной тРНК, которая также функционирует для включения ее в возникающие полипептиды.
Первичная и вторичная структура селеноцистеин-специфической тРНК, тРНК, отличается от стандартных тРНК по нескольким параметрам, в первую очередь наличием 8-пар оснований (бактерии) или 10-пар оснований (эукариоты).) акцепторный стержень, длинное плечо вариабельной области и замены в нескольких хорошо законсервированных положениях оснований. Селеноцистеиновые тРНК изначально заряжены серином с помощью серил-тРНК лигазы, но полученная Ser-тРНК не используется для трансляции, потому что она не распознается нормальным фактором элонгации трансляции (EF-Tu у бактерий, eEF1A у эукариот).
Скорее, тРНК-связанный сериловый остаток превращается в остаток селеноцистеина с помощью пиридоксальфосфат -содержащего фермента селеноцистеинсинтаза. У эукариот и архей для превращения тРНК-связанного серилового остатка в тРНК селеноцистеиниловый остаток требуются два фермента: PSTK (O-фосфосерил-тРНК [Ser] Sec киназа) и селенцистеинсинтаза. Наконец, полученная Sec-тРНК специфически связывается с альтернативным фактором элонгации трансляции (SelB или mSelB (или eEFSec)), который целенаправленно доставляет ее к рибосомам, транслирующим мРНК для селенопротеинов. Специфичность этого механизма доставки обусловлена наличием дополнительного белкового домена (у бактерий, SelB) или дополнительной субъединицы (SBP2 для эукариотических mSelB / eEFSec), которые связываются с соответствующими вторичными структурами РНК, образованными элементами SECIS в мРНК селенопротеидов.
Селеноцистеин расщепляется ферментом селеноцистеинлиазой на L-аланин и селенид.
По состоянию на 2016 год, пятьдесят четыре белка человека, как известно, содержат селеноцистеин (селенопротеины).
Производные селеноцистеина γ-глутамил-Se-метилселеноцистеин и Se-метилселеноцистеин встречаются в природе в растениях родов Allium и Brassica.
Биотехнологические применения селеноцистеина включают использование Se-меченного Sec (период полураспада Se = 7,2 часа) в исследованиях позитронно-эмиссионной томографии (ПЭТ) и Se-меченного Sec ( период полураспада Se = 118,5 дней) при специфическом радиоактивном мечении, облегчение определения фазы с помощью многоволновой аномальной дифракции в рентгеновской кристаллографии белков путем введения только Sec, или Sec вместе с селенометионином (SeMet) и включение стабильного изотопа Se, который имеет ядерный спин 1/2 и может использоваться для высокого разрешения ЯМР и др.