 | |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название IUPAC Фосфат | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| Справочник Байльштейна | 3903772 | ||
| ChEBI | |||
| ChemSpider | |||
| Справочник Гмелина | 1997 | ||
| MeSH | Фосфаты | ||
| PubChem CID | |||
| UNII | |||
InChI
| |||
УЛЫБАЕТСЯ
| |||
| Свойства | |||
| Химическая формула | PO. 4 | ||
| Молярная масса | 94,9714 г моль | ||
| Конъюгированная кислота | Моногидрофосфат | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки ink | |||
In химия, фосфат представляет собой анион, соль, функциональную группу или производное сложного эфира из фосфорной кислоты. Чаще всего это означает ортофосфат, производное ортофосфорной кислоты H. 3PO. 4.
. Ион фосфата или ортофосфат [PO. 4]. получен из фосфорной кислоты удалением трех протонов H.. Удаление одного или двух протонов дает ион дигидрофосфат [H. 2PO. 4]. и ион гидрофосфат [HPO. 4]. ион, соответственно. Эти названия также используются для солей этих анионов, таких как дигидрофосфат аммония и тринатрийфосфат.

H. 3PO. 4. фосфорная. кислота

[H. 2PO. 4].. дигидроген. фосфат
[HPO. 4].. Водород. фосфат

[PO. 4].. фосфат
В органической химии, фосфат или ортофосфат представляет собой органофосфат, сложный эфир ортофосфорной кислоты в форме PO. 4RR'R ″, где один или несколько атомов водорода заменены органическими группами. Примером является триметилфосфат, (CH. 3). 3PO. 4. Термин также относится к трехвалентной функциональной группе OP (O-). 3в таких сложных эфирах.
Ортофосфаты особенно важны среди различных фосфатов из-за их ключевой роли в биохимии, биогеохимии и экологии, а также их экономической важности для сельского хозяйства и промышленности. Добавление и удаление фосфатных групп (фосфорилирование и дефосфорилирование ) являются ключевыми этапами метаболизма клеток .
Ортофосфаты могут конденсироваться с образованием пирофосфатов.
Фосфа Ион имеет молярную массу 94,97 г / моль и состоит из центрального атома фосфора, окруженного четырьмя атомами кислорода в тетраэдре расположение. Это основание конъюгата иона гидрофосфата H (PO. 4)., которое, в свою очередь, является основанием конъюгата иона дигидрофосфата H. 2(PO. 4)., которое, в свою очередь, является сопряженное основание ортофосфорной кислоты, H. 3PO. 4.
Многие фосфаты не растворимы в воде при стандартной температуре и давлении. фосфаты калия, рубидия, цезия и аммония растворимы в воде. Большинство других фосфатов растворимы в воде лишь слабо или нерастворимы. Как правило, водород и дигидрофосфаты немного более растворимы, чем соответствующие фосфаты.
 Фосфорная кислота состав
Фосфорная кислота состав В водном растворе ортофосфорная кислота и три производных от нее аниона сосуществуют в соответствии с равновесия диссоциации и рекомбинации ниже
| Равновесия | Константа диссоциации K a | pKa |
|---|---|---|
| H3PO4⇌ H. 2PO. 4+ H. | Ka1= [H. ] [H. 2PO. 4] / [H. 3PO. 4] ≈ 7,5 × 10 | pKa1= 2,14 |
| H. 2PO. 4⇌ HPO. 4+ H. | Ka2= [H. ] [HPO. 4] / [H. 2PO. 4] ≈ 6,2 × 10 | pKa2= 7,20 |
| HPO. 4⇌ PO. 4+ H. | Ka3= [H. ] [PO. 4] / [HPO. 4] ≈ 2,14 × 10 | pKa3= 12,37 |
Значения даны при 25 ° C и нулевой ионной силе.
Значения pK a представляют собой значения pH, где концентрация каждого вида равна концентрации его конъюгированных оснований. При pH 1 или ниже фосфорная кислота практически не диссоциирует. При pH около 4,7 (посередине между первыми двумя значениями pK a) ион дигидрофосфата, [H. 2PO. 4]., является практически единственным присутствующим веществом. При pH около 9,8 (между вторым и третьим значениями pK a) ион моногидрофосфата, [HPO. 4]., является единственным присутствующим веществом. При pH 13 или выше кислота полностью диссоциирует в виде фосфат-иона (PO. 4)..
Это означает, что соли моно- и ди-фосфат-ионов могут быть избирательно кристаллизованы из водного раствора, установив значение pH равным 4,7 или 9.8.
Фактически, H. 3PO. 4, H. 2(PO. 4). и H (PO. 4). ведут себя как отдельные слабые кислоты, потому что последующие pK a отличаются более чем на 4.
Фосфат может образовывать множество полимерных ионов, таких как пирофосфат ), (P. 2O. 7). и трифосфат, (P. 3O. 10).. Различные ионы метафосфата (которые обычно представляют собой длинные линейные полимеры) имеют эмпирическую формулу (PO. 3). и встречаются во многих соединениях.
В биологических системах фосфор можно найти в виде свободных анионов фосфата в растворе (неорганический фосфат ) или связать с различными органическими молекулами органофосфаты.
Неорганический фосфат обычно обозначается Piи в физиологических (гомеостатических)) pH в основном состоит из смеси ионов [HPO. 4]. и [H. 2PO. 4].. При нейтральном pH, как в цитозоле (pH = 7,0), концентрации ортофосфорной кислоты и трех ее анионов имеют отношения
Таким образом, только ионы [H. 2PO. 4]. и [HPO. 4]. присутствуют в значительных количествах в цитозоле (62% [H. 2PO. 4]., 38% [HPO. 4].). Во внеклеточной жидкости (pH = 7,4) эта пропорция инвертирована (61% [HPO. 4]., 39% [H. 2PO. 4].).
Неорганический фосфат может также присутствовать в виде пирофосфатных анионов [P. 2O. 7]., которые могут давать ортофосфат путем гидролиза :
Органические фосфаты обычно встречаются в форме сложных эфиров в виде нуклеотидов (например, AMP, ADP и ATP >) и в ДНК и РНК. Свободные ортофосфатные анионы могут высвобождаться гидролизом фосфоангидридных связей в АТФ или АДФ. Эти реакции фосфорилирования и дефосфорилирования являются непосредственным накоплением и источником энергии для многих метаболических процессов. АТФ и АДФ часто называют высокоэнергетическими фосфатами, как и фосфагены в мышечной ткани. Аналогичные реакции существуют для других нуклеозидов дифосфатов и трифосфатов.
 Референсные диапазоны для анализов крови, показывающие «неорганический фосфор» фиолетовым цветом справа, что почти идентично молярной концентрации фосфата.
Референсные диапазоны для анализов крови, показывающие «неорганический фосфор» фиолетовым цветом справа, что почти идентично молярной концентрации фосфата. Фосфаты встречаются в биологических системах как структурный материал костей и зубов. Эти структуры состоят из кристаллического фосфата кальция в форме гидроксиапатита. Твердая плотная эмаль зубов млекопитающих состоит из фторапатита, гидрокси фосфата кальция, в котором некоторые из гидроксильных групп заменены на ионы фтора.
ортофосфатные соли натрия и калия, которые являются обычными агентами для приготовления буферные растворы для клеток животных.
Растения поглощают фосфор несколькими путями: путь арбускулярной микоризы и путь прямого поглощения.
 Фосфатный рудник около Пылающего ущелья, Юта, 2008 г.
Фосфатный рудник около Пылающего ущелья, Юта, 2008 г.  Поезд, загруженный фосфоритом, Метлауи, Тунис, 2012
Поезд, загруженный фосфоритом, Метлауи, Тунис, 2012 Фосфаты - это встречающаяся в природе форма элемента фосфор, обнаруженная во многих фосфатных минералах. В минералогии и геологии фосфат относится к породе или руде, содержащей ионы фосфата. Неорганические фосфаты добываются для получения фосфора для использования в сельском хозяйстве и промышленности.
Крупнейшим мировым производителем и экспортером фосфатов является Марокко. В пределах Северной Америки самые большие месторождения находятся в регионе Боун-Вэлли центральной части Флориды, Сода-Спрингс регионе юго-востока Айдахо и побережье Северной Каролины. Менее крупные месторождения расположены в Монтана, Теннесси, Джорджия и Южная Каролина. Небольшое островное государство Науру и его сосед остров Банаба, на котором когда-то находились огромные залежи фосфатов самого высокого качества, были добыты чрезмерно. Фосфатные породы также можно найти в Египте, Израиле, Западной Сахаре, острове Навасса, Тунисе, Того и Иордании, странах с крупными предприятиями по добыче фосфатов.
Фосфоритные рудники в основном находятся в:
В В 2007 г. при текущих темпах потребления запас фосфора оценивался в 345 лет. Однако некоторые ученые полагали, что «пик фосфора » произойдет через 30 лет, а Дана Корделл из Института устойчивого будущего заявила, что «при нынешних темпах запасы будут исчерпаны в следующие 50-100 лет». Под запасами понимается предполагаемая извлекаемая сумма по текущим рыночным ценам, и в 2012 году Геологическая служба США оценила мировые запасы в 71 миллиард тонн, в то время как в 2011 году мировая добыча составила 0,19 миллиарда тонн. Фосфор составляет 0,1% по массе от средней породы (тогда как, для перспективы, его типичная концентрация в растительности составляет от 0,03% до 0,2%), и, следовательно, в земной коре 3 * 10 тонн содержатся квадриллионы тонн фосфора, хотя и в основном с более низкой концентрацией, чем отложения, считающиеся запасами из-за инвентаризации и более дешевые. экстракт; если предположить, что фосфатные минералы в фосфоритной породе представляют собой гидроксиапатит и фторапатит, фосфатные минералы содержат примерно 18,5% фосфора по весу, а если фосфатная порода содержит около 20% этих минералов, в среднем фосфатная порода содержит примерно 3,7% фосфора. % фосфора по весу.
Некоторые месторождения фосфатных пород, такие как Mulberry во Флориде, отличаются наличием значительных количеств радиоактивных изотопов урана. Этот синдром заслуживает внимания, потому что радиоактивность может выделяться в поверхностные воды в процессе внесения полученного фосфатного удобрения (например, во многих операциях по выращиванию табака на юго-востоке США).
В декабре 2012 года Cominco Resources объявила об обновленном ресурсе, соответствующем JORC, своего проекта на хинде в Конго-Браззавиль на 531 млн тонн, что сделало его крупнейшее измеренное и указанное месторождение фосфатов в мире.
Три основных страны-производителя фосфатов (Китай, Марокко и США ) составляют около 70% мирового производства.
| Страна | Производство. (млн кг) | Доля. мировой. добычи (%) | Запасы. (млн кг) |
|---|---|---|---|
| Алжир | 1200 | 0,54 | 2,200,000 |
| Австралия | 2,600 | 1,17 | 1,030,000 |
| Бразилия | 6,700 | 3,00 | 315,000 |
| Китай | 100,000 | 44.83 | 3,700,000 |
| Египет | 5,500 | 2,47 | 1,250,000 |
| Индия | 1100 | 0,49 | 65,000 |
| Ирак | 200 | 0,09 | 430,000 |
| Израиль | 3,300 | 1,48 | 130,000 |
| Иордания | 7,500 | 3.36 | 1,300,000 |
| Казахстан | 1600 | 0,72 | 260,000 |
| Мексика | 1,700 | 0,76 | 30,000 |
| Марокко | 30,000 | 13,45 | 50,000,000 |
| Перу | 4,000 | 1,79 | 820,000 |
| Россия | 12,500 | 5.60 | 1,300,000 |
| Sa уди Аравия | 3,300 | 1,48 | 956,000 |
| Сенегал | 1,000 | 0,45 | 50,000 |
| Южная Африка | 2,200 | 0,99 | 1,500,000 |
| Сирия | 750 | 0,34 | 1,800,000 |
| Того | 1,000 | 0,45 | 30,000 |
| Тунис | 4,000 | 1,79 | 100,000 |
| США | 27,600 | 12,37 | 1,100,000 |
| Вьетнам | 2,700 | 1.21 | 30,000 |
| Другие страны | 2,600 | 1,17 | 380,000 |
| Всего | 223,000 | 100 | 69,000,000 |
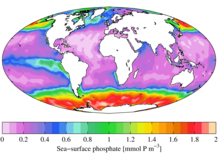 Фосфат морской поверхности из Атласа Мирового океана
Фосфат морской поверхности из Атласа Мирового океана  Связь между поглощением фосфатов и нитратами для фотосинтеза в различных регионах океана. Обратите внимание, что нитрат чаще является ограничивающим фактором, чем фосфат. См. коэффициент Редфилда.
Связь между поглощением фосфатов и нитратами для фотосинтеза в различных регионах океана. Обратите внимание, что нитрат чаще является ограничивающим фактором, чем фосфат. См. коэффициент Редфилда.С экологической точки зрения, из-за его важной роли в биологических системах, фосфат является очень востребованным ресурсом. После использования он часто является ограничивающим питательным веществом в окружающей среде, и его доступность может определять скорость роста организмов. Обычно это справедливо для пресноводных сред, тогда как азот чаще является ограничивающим питательным веществом в морской (морской) среде. Добавление высоких уровней фосфатов в окружающую среду и микросреду, в которых он обычно встречается редко, может иметь серьезные экологические последствия. Например, может произойти расцвет популяций одних организмов за счет других и исчезновение популяций, лишенных таких ресурсов, как кислород (см. эвтрофикация ). В контексте загрязнения фосфаты являются одним из компонентов общего количества растворенных твердых веществ, основного показателя качества воды, но не весь фосфор находится в молекулярной форме, которую водоросли могут расщепить и потребить.
Гидроксиапатит кальция и осадки кальцита могут быть обнаружены вокруг бактерий в аллювиальном верхнем слое почвы. Поскольку глинистые минералы способствуют биоминерализации, присутствие бактерий и глинистых минералов привело к осаждению гидроксиапатита и кальцита кальция.
Фосфатные отложения могут содержать значительные количества встречающихся в природе тяжелых металлов. При добыче полезных ископаемых фосфоритная порода может оставлять хвосты сваи, содержащие повышенные уровни кадмия, свинца, никеля, медь, хром и уран. Без тщательного обращения с этими отходами тяжелые металлы могут попадать в подземные воды или близлежащие устья. Поглощение этих веществ растениями и морскими обитателями может привести к концентрации токсичных тяжелых металлов в пищевых продуктах.
| На Wikimedia Commons есть материалы, связанные с Фосфаты. |