Атомные ядра состоят из протонов и нейтроны, которые притягиваются друг к другу посредством ядерной силы, в то время как протоны отталкиваются друг от друга посредством электрической силы из-за их положительного заряда. Эти две силы конкурируют, что приводит к тому, что некоторые комбинации нейтронов и протонов более стабильны, чем другие. Нейтроны стабилизируют ядро, потому что они притягивают протоны, что помогает компенсировать электрическое отталкивание между протонами. В результате по мере увеличения числа протонов для образования стабильного ядра требуется увеличивающееся отношение нейтронов к протонам ; если присутствует слишком много или слишком мало нейтронов по сравнению с оптимальным соотношением, ядро становится нестабильным и подвержено определенным типам ядерного распада. Нестабильные изотопы распадаются посредством различных путей радиоактивного распада, чаще всего альфа-распадом, бета-распадом или захватом электронов. Известно много редких типов распада, таких как спонтанное деление или распад кластера. (Подробнее см. Радиоактивный распад.)
 Изотоп период полураспада. Более темная область более стабильного изотопа отходит от линии протонов (Z) = нейтронов (N), когда номер элемента Z становится больше.
Изотоп период полураспада. Более темная область более стабильного изотопа отходит от линии протонов (Z) = нейтронов (N), когда номер элемента Z становится больше. Из первых 82 элементов в периодической таблице 80 имеют изотопы считаются стабильными. 83-й элемент, висмут, традиционно считался самым тяжелым стабильным изотопом, висмут-209, но в 2003 году исследователи из Орсе, Франция, измерили период полураспада из . Bi. составляет 1,9 × 10 лет. Технеций и прометий (атомные номера 43 и 61 соответственно) и все элементы с атомным число более 82 содержит только изотопы, которые, как известно, разлагаются посредством радиоактивного распада. Ожидается, что неоткрытые элементы будут стабильными; поэтому свинец считается самым тяжелым стабильным элементом. Однако возможно, что некоторые изотопы, которые сейчас считаются стабильными, будут распадаться с чрезвычайно длительным периодом полураспада (как в случае . Bi. ). В этом списке отражено то, что было согласовано научным сообществом по состоянию на 2019 год.
Для каждого из 80 стабильных элементов указано количество стабильных изотопов. Ожидается, что только 90 изотопов будут совершенно стабильными, а еще 162 изотопов энергетически нестабильны, но никогда не наблюдались распада. Таким образом, 252 изотопа (нуклидов ) являются стабильными по определению (включая тантал-180m, распад которого еще не наблюдался). Те, которые в будущем могут оказаться радиоактивными, будут иметь период полураспада более 10 лет (например, ксенон-134).
В апреле 2019 года было объявлено, что период полураспада ксенона -124 было измерено до 1,8 × 10 лет. Это самый продолжительный период полураспада, измеренный непосредственно для любого нестабильного изотопа; только период полураспада теллура-128 больше.
Из химических элементов только один элемент (олово ) имеет 10 таких стабильных изотопов, пять - семь изотопов, восемь - шесть изотопов, десять - пять изотопов, девять - четыре изотопа, пять имеют три стабильных изотопа, 16 - два стабильных изотопа и 26 - один стабильный изотоп.
Кроме того, около 30 нуклидов естественных элементов имеют нестабильные изотопы с периодом полураспада, превышающим возраст Солнечная система (~ 10 лет и более). Еще четыре нуклида имеют период полураспада более 100 миллионов лет, что намного меньше возраста Солнечной системы, но достаточно долгое, чтобы некоторые из них выжили. Эти 34 радиоактивных нуклида природного происхождения включают радиоактивные первичные нуклиды. Общее количество первичных нуклидов составляет 252 (стабильные нуклиды) плюс 34 радиоактивных первичных нуклида, всего 286 первичных нуклидов. Это число может измениться, если на Земле будут обнаружены новые, более короткоживущие первобытные существа.
Одним из первичных нуклидов является тантал-180m, период полураспада которого, по прогнозам, превышает 10 лет, но никогда не наблюдалось распада. Еще более длительный период полураспада теллура-128, равный 2,2 × 10 лет, был измерен уникальным методом обнаружения его радиогенного дочернего элемента ксенон-128 и является самым длинным из известных экспериментально измеренных половин. -жизнь. Другим примечательным примером является единственный встречающийся в природе изотоп висмута, висмут-209, который, как было предсказано, является нестабильным с очень длительным периодом полураспада, но, как было обнаружено, распадается. Из-за своего длительного периода полураспада такие изотопы до сих пор встречаются на Земле в различных количествах, и вместе со стабильными изотопами они называются первичным изотопом. Все первичные изотопы приведены в порядке их уменьшения распространенности на Земле.. Список первичных нуклидов в порядке полураспада см. Список нуклидов.
118 химический элементы, как известно, существуют. Все элементы до элемента 94 встречаются в природе, а остальные из обнаруженных элементов искусственно произведены, причем все изотопы, как известно, очень радиоактивны с относительно короткими периодами полураспада (см. Ниже). Элементы в этом списке упорядочены по времени жизни их наиболее стабильного изотопа. Из них три элемента (висмут, торий и уран ) являются первичными, потому что их период полураспада достаточно велик, чтобы их можно было найти на Земле, в то время как все остальные образуются либо в результате радиоактивного распада, либо синтезируются в лабораториях и ядерных реакторах. Только 13 из 38 известных, но нестабильных элементов имеют изотопы с периодом полураспада не менее 100 лет. Все известные изотопы оставшихся 25 элементов очень радиоактивны; они используются в академических исследованиях, а иногда и в промышленности и медицине. Некоторые из более тяжелых элементов периодической таблицы, возможно, содержат еще не обнаруженные изотопы с более длительным сроком жизни, чем перечисленные здесь.
Около 338 нуклидов обнаружены в естественных условиях на Земле. Они включают 252 стабильных изотопа, а с добавлением 34 долгоживущих радиоизотопов с периодом полураспада более 100 миллионов лет, всего 286 первичных нуклидов, как отмечалось выше. Обнаруженные нуклиды в природе включают не только 286 первичных, но и еще около 52 короткоживущих изотопов (с периодом полураспада менее 100 миллионов лет, слишком коротким, чтобы выжить с момента образования Земли), которые являются дочерями первичные изотопы (такие как радий из урана ); или же получены в результате энергетических естественных процессов, таких как углерод-14, полученный из атмосферного азота путем бомбардировки космическими лучами.
четное количество протонов или нейтроны более стабильны (более высокая энергия связи ) из-за эффектов спаривания, поэтому четно-четные нуклиды намного более стабильны, чем нечетно-нечетные. Один из эффектов заключается в том, что существует несколько стабильных нечетно-нечетных нуклидов: на самом деле стабильными являются только пять, а еще четыре имеют период полураспада более миллиарда лет.
Другой эффект заключается в предотвращении бета-распада многих четно-четных нуклидов на другой четно-четный нуклид с тем же массовым числом, но с меньшей энергией, потому что распад, происходящий шаг за шагом, должен был бы проходить через нечетные - странный нуклид более высокой энергии. (Двойной бета-распад непосредственно от четно-четного до четно-четного, пропуская нечетно-нечетный нуклид, возможен только изредка, и этот процесс настолько сильно затруднен, что имеет период полураспада больше чем в миллиард раз возраст Вселенной.) Это приводит к большему количеству стабильных четно-четных нуклидов, до трех для некоторых массовых чисел и выше. до семи для некоторых атомных (протонных) номеров и не менее четырех для всех стабильных элементов с четным Z за пределами железа.
Поскольку ядро с нечетным числом протонов относительно менее стабильно, элементы с нечетными номерами, как правило, имеют меньше стабильные изотопы. Из 26 элементов «моноизотопных », которые имеют только один стабильный изотоп, все, кроме одного, имеют нечетный атомный номер - единственным исключением является бериллий. Кроме того, ни один элемент с нечетным номером не имеет более двух стабильных изотопов, в то время как каждый элемент с четным номером со стабильными изотопами, за исключением гелия, бериллия и углерода, имеет как минимум три.
В следующих таблицах приведены элементы с первичными нуклидами, что означает, что элемент все еще может быть идентифицирован на Земле из естественных источников, поскольку присутствовал с Земли. образовалась из солнечной туманности. Таким образом, ни одна из них не является более короткоживущими дочерями более долгоживущих отцовских первооснов, таких как радон. Два нуклида, которые имеют достаточно длительный период полураспада, чтобы быть первичными, но еще не были окончательно обнаружены как таковые (Pu и Sm), были исключены.
Таблицы элементов отсортированы в порядке убывания количества нуклидов, связанных с каждым элементом. (Список полностью отсортирован по периодам полураспада нуклидов со смешиванием элементов см. Список нуклидов.) Даны стабильные и нестабильные (отмеченные распады) нуклиды с символами для нестабильных (радиоактивных) нуклиды выделены курсивом. Обратите внимание, что сортировка не совсем дает элементы только в порядке стабильных нуклидов, поскольку некоторые элементы имеют большее количество долгоживущих нестабильных нуклидов, что ставит их впереди элементов с большим количеством стабильных нуклидов. По соглашению, нуклиды считаются «стабильными», если их распад никогда не наблюдался экспериментально или из наблюдений продуктов распада (чрезвычайно долгоживущие нуклиды, нестабильные только в теории, такие как тантал-180m, считаются стабильными).
Первая таблица предназначена для элементов с четными атомными номерами, которые, как правило, содержат гораздо больше первичных нуклидов из-за стабильности, обеспечиваемой протон-протонным спариванием. Вторая отдельная таблица дана для элементов с нечетными атомными номерами, которые, как правило, имеют гораздо меньше стабильных и долгоживущих (первичных) нестабильных нуклидов.
| Z. | Элемент. | Стабильный. | Распад. | нестабильный курсивом нечетные число нейтронов в розовый | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 50 | олово | 10 | — | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. | . Sn. |
| 54 | ксенон | 7 | 2 | . Xe. | . Xe. | . Xe. | . Xe. | . Xe. | . Xe. | . Xe. | . Xe. | . Xe. | |
| 48 | кадмий | 6 | 2 | . Cd. | . Cd. | . Cd. | . Cd. | . Cd. | . Cd. | . Cd. | . Cd. | ||
| 52 | теллур | 6 | 2 | . Te. | . Te. | . Te. | . Te. | . Te. | . Te. | . Te. | . Te. | ||
| 44 | рутений | 7 | — | . Ru. | . Ru. | . Ru. | . Ru. | . Ru. | . Ru. | . Ru. | |||
| 66 | диспрозий | 7 | — | . Dy. | . Dy. | . Dy. | . Dy. | . Dy. | . Dy. | . Dy. | |||
| 70 | иттербий | 7 | — | . Yb. | . Yb. | . Yb. | . Yb. | . Yb. | . Yb. | . Yb. | |||
| 80 | ртуть | 7 | — | . Hg. | . Hg. | . Hg. | . Hg. | . Hg. | . Hg. | . Hg. | |||
| 42 | молибден | 6 | 1 | . Mo. | . Mo. | . Mo. | . Mo. | . Mo. | . Mo. | . Mo. | |||
| 56 | барий | 6 | 1 | . Ba. | . Ba. | . Ba. | . Ba. | . Ba. | . Ba. | . Ba. | |||
| 64 | гадолиний | 6 | 1 | . Gd. | . Gd. | . Gd. | . Gd. | . Gd. | . Gd. | . Gd. | |||
| 76 | осмий | 6 | 1 | . Os. | . Os. | . Os. | . Os. | . Os. | . Os. | . Os. | |||
| 60 | неодим | 5 | 2 | . Nd. | . Nd. | . Nd. | . Nd. | . Nd. | . Nd. | . Nd. | |||
| 62 | самарий | 5 | 2 | . Sm. | . Sm. | . Sm. | . Sm. | . Sm. | . Sm. | . Sm. | |||
| 46 | палладий | 6 | — | . Pd. | . Pd. | . Pd. | . Pd. | . Pd. | . Pd. | ||||
| 68 | эрбий | 6 | — | . Er. | . Er. | . Er. | . Er. | . Er. | . Er. | ||||
| 20 | кальций | 5 | 1 | . Ca. | . Ca. | . Ca. | . Ca. | . Ca. | . Ca. | ||||
| 34 | селен | 5 | 1 | . Se. | . Se. | . Se. | . Se. | . Se. | . Se. | ||||
| 36 | криптон | 5 | 1 | . Kr. | . Kr. | . Kr. | . Kr. | . Kr. | . Kr. | ||||
| 72 | гафний | 5 | 1 | . Hf. | . Hf. | . Hf. | . Hf. | . Hf. | . Hf. | ||||
| 78 | платина | 5 | 1 | . Pt. | . Pt. | . Pt. | . Pt. | . Pt. | . Pt. | ||||
| 22 | титан | 5 | — | . Ti. | . Ti. | . Ti. | . Ti. | . Ti. | |||||
| 28 | никель | 5 | — | . Ni. | . Ni. | . Ni. | . Ni. | . Ni. | |||||
| 30 | цинк | 5 | — | . Zn. | . Zn. | . Zn. | . Zn. | . Zn. | |||||
| 32 | германий | 4 | 1 | . Ge. | . Ge. | . Ge. | . Ge. | . Ge. | |||||
| 40 | цирконий | 4 | 1 | . Zr. | . Zr. | . Zr. | . Zr. | . Zr. | |||||
| 74 | вольфрам | 4 | 1 | . W. | . W. | . W. | . W. | . W. | |||||
| 16 | сера | 4 | — | . S. | . S. | . S. | . S. | ||||||
| 24 | хром | 4 | — | . Cr. | . Cr. | . Cr. | . Cr. | ||||||
| 26 | железо | 4 | — | . Fe. | . Fe. | . Fe. | . Fe. | ||||||
| 38 | стронций | 4 | — | . Sr. | . Sr. | . Sr. | . Sr. | ||||||
| 58 | церий | 4 | — | . Ce. | . Ce. | . Ce. | . Ce. | ||||||
| 82 | свинец | 4 | — | . Pb. | . Pb. | . Pb. | . Pb. | ||||||
| 8 | кислород | 3 | — | . O. | . O. | . O. | |||||||
| 10 | неон | 3 | — | . Ne. | . Ne. | . Ne. | |||||||
| 12 | магний | 3 | — | . Mg. | . Mg. | . Mg. | |||||||
| 14 | кремний | 3 | — | . Si. | . Si. | . Si. | |||||||
| 18 | аргон | 3 | — | . Ar. | . Ar. | . Ar. | |||||||
| 2 | гелий | 2 | — | . He. | . He. | ||||||||
| 6 | углерод | 2 | — | . C. | . C. | ||||||||
| 92 | уран | 0 | 2 | . U. | . U. | ||||||||
| 4 | бериллий | 1 | — | . Be. | |||||||||
| 90 | торий | 0 | 1 | . Th. | |||||||||
| Z. | Элемент. | Stab. | Dec. | нестабильный: курсив нечетный N розовый | ||
|---|---|---|---|---|---|---|
| 19 | калий | 2 | 1 | . K. | . K. | . K. |
| 1 | водород | 2 | — | . H. | . H. | |
| 3 | литий | 2 | — | . Li. | . Li. | |
| 5 | бор | 2 | — | . B. | . B. | |
| 7 | азот | 2 | — | . N. | . N. | |
| 17 | хлор | 2 | — | . Cl. | . Cl. | |
| 29 | медь | 2 | — | . Cu. | . Cu. | |
| 31 | галлий | 2 | — | . Ga. | . Ga. | |
| 35 | бром | 2 | — | . Br. | . Br. | |
| 47 | серебро | 2 | — | . Ag. | . Ag. | |
| 51 | сурьма | 2 | — | . Sb. | . Sb. | |
| 73 | тантал | 2 | — | . Ta. | . Ta. | |
| 77 | иридий | 2 | — | . Ir. | . Ir. | |
| 81 | таллий м | 2 | — | . Tl. | . Tl. | |
| 23 | ванадий | 1 | 1 | . V. | . V. | |
| 37 | рубидий | 1 | 1 | . Rb. | . Rb. | |
| 49 | индий | 1 | 1 | . In. | . In. | |
| 57 | лантан | 1 | 1 | . La. | . La. | |
| 63 | европий | 1 | 1 | . Eu. | . Eu. | |
| 71 | лютеций | 1 | 1 | . Lu. | . Lu. | |
| 75 | рений | 1 | 1 | . Re. | . Re. | |
| 9 | фтор | 1 | — | . F. | ||
| 11 | натрий | 1 | — | . Na. | ||
| 13 | алюминий | 1 | — | . Al. | ||
| 15 | фосфор | 1 | — | . P. | ||
| 21 | скандий | 1 | — | . Sc. | ||
| 25 | марганец | 1 | — | . Mn. | ||
| 27 | кобальт | 1 | — | . Co. | ||
| 33 | мышьяк | 1 | — | . As. | ||
| 39 | иттрий | 1 | — | . Y. | ||
| 41 | ниобий | 1 | — | . Nb. | ||
| 45 | родий | 1 | — | . Rh. | ||
| 53 | йод | 1 | — | . I. | ||
| 55 | цезий | 1 | — | . Cs. | ||
| 59 | празеодим | 1 | — | . Pr. | ||
| 65 | тербий | 1 | — | . Tb. | ||
| 67 | гольмий | 1 | — | . Ho. | ||
| 69 | тулий | 1 | — | . Tm. | ||
| 79 | золото | 1 | — | . Au. | ||
| 83 | висмут | 0 | 1 | . Bi. | ||
| Z. | Элемент. | t | Самый долгоживущий. изотоп |
|---|---|---|---|
| 94 | плутоний | 8,08 × 10 yr | . Pu. |
| 96 | кюрий | 1,56 × 10 лет | . Cm. |
| 43 | технеций | 4,21 × 10 лет | . Tc. |
| 93 | нептуний | 2,14 × 10 лет | . Np. |
| 91 | протактиний | 32,760 лет | . Pa. |
| 95 | америций | 7,370 лет | . Am. |
| 88 | радий | 1,600 лет | . Ra. |
| 97 | берклий | 1,380 лет | . Bk. |
| 98 | калифорний | 900 лет | . Cf. |
| 84 | полоний | 125 лет | . Po. |
| 89 | актиний | 21,772 года | . Ac. |
| 61 | прометий | 17,7 года | . Pm. |
| 99 | эйнштейний | 1,293 года | . Es. |
| 100 | фермий | 100,5 d | . Fm. |
| 101 | менделевий | 51,3 d | . Md. |
| 86 | радон | 3,823 d | . Rn. |
| 105 | дубний | 1,2 d | . Db. |
| Z. | Элемент. | t | Самый долгоживущий. изотоп. |
|---|---|---|---|
| 103 | лоуренсий | 11 h | . Lr. |
| 85 | астат | 8,1 ч | . At. |
| 104 | резерфорд | 1,3 ч | . Rf. |
| 102 | нобелий | 58 мин | . No. |
| 87 | франций | 22 мин | . Fr. |
| 106 | сиборгий | 14 мин | . Sg. |
| 111 | рентгений | 1,7 мин | . Rg. |
| 107 | борий | 1 мин | . Bh. |
| 112 | коперниций | 28 s | . Cn. |
| 108 | гассий | 16 с | . Hs. |
| 110 | дармштадтий | 12,7 с | . Ds. |
| 113 | нихоний | 9,5 с | . Nh. |
| 109 | мейтнерий | 4,5 с | . Mt. |
| 114 | флеровий | 1,9 с | . Fl. |
| 115 | московский | 650 ms | . Mc. |
| 116 | ливерморий | 57 мс | . Lv. |
| 117 | теннессин | 51 мс | . Ts. |
| 118 | оганессон | 690 μs | . Og. |
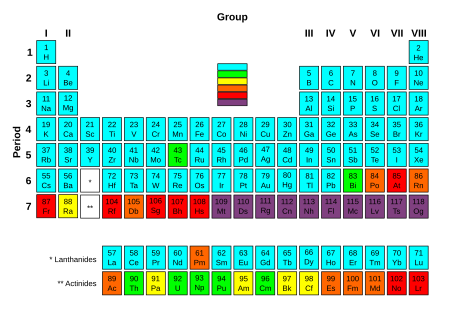 Периодическая таблица с элементами окрашены в соответствии с периодом полураспада их наиболее стабильного изотопа. Элементы, содержащие хотя бы один стабильный изотоп. Легкорадиоактивные элементы: самый стабильный изотоп очень долгоживущий, с периодом полураспада более двух миллионов лет. Значительно радиоактивные элементы: самые стабильные период полураспада изотопа составляет от 800 до 34 000 лет. Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от одного дня до 130 лет. Высокорадиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от нескольких минут и один день. Чрезвычайно радиоактивные элементы: самый стабильный изотоп имеет период полураспада менее нескольких минут.
Периодическая таблица с элементами окрашены в соответствии с периодом полураспада их наиболее стабильного изотопа. Элементы, содержащие хотя бы один стабильный изотоп. Легкорадиоактивные элементы: самый стабильный изотоп очень долгоживущий, с периодом полураспада более двух миллионов лет. Значительно радиоактивные элементы: самые стабильные период полураспада изотопа составляет от 800 до 34 000 лет. Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от одного дня до 130 лет. Высокорадиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от нескольких минут и один день. Чрезвычайно радиоактивные элементы: самый стабильный изотоп имеет период полураспада менее нескольких минут.