 Элементарная ячейка из рутила. Центры Ti (IV) серые; кислородные центры красные. Обратите внимание, что кислород образует три связи с титаном, а титан образует шесть связей с кислородом.
Элементарная ячейка из рутила. Центры Ti (IV) серые; кислородные центры красные. Обратите внимание, что кислород образует три связи с титаном, а титан образует шесть связей с кислородом. Оксида ( / ɒ к с aɪ д / ) представляет собой химическое соединение, которое содержит по меньшей мере один кислородный атом и один другой элемент в своей химической формуле. Сам «оксид» - это дианион кислорода, (молекулярный) ион O 2–. Металлические оксиды, таким образом, как правило, содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкий слой Al 2 O 3 (называемый пассивирующим слоем ), который защищает фольгу от дальнейшей коррозии. Некоторые элементы могут образовывать несколько оксидов, различающихся по количеству элемента, соединяющегося с кислородом. Примерами являются углерод, железо, азот (см. Оксид азота ), кремний, титан, литий и алюминий. В таких случаях оксиды выделяются путем указания числа атомов, участвующих, как и в окиси углерода и двуокиси углерода, или путем указания элемента окисления, как в оксиде железа (II) и оксид железа (III).
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов. Благородные металлы (такие как золото или платина ) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Комбинация воды и кислорода еще более агрессивна. Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы - натрий - быстро реагируют с образованием гидроксидов. Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической, т. Е. Самородной, форме. Цезий настолько реактивен с кислородом, что он используется в качестве газопоглотителя в вакуумных трубках, а растворы калия и натрия, так называемый NaK, используются для деоксигенации и обезвоживания некоторых органических растворителей. Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию. Слой оксида алюминия может быть увеличен с помощью процесса электролитического анодирования. Хотя твердые магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры. Мелкозернистые порошки большинства металлов могут быть взрывоопасными на воздухе. Следовательно, они часто используются в твердотопливных ракетах.
 Оксиды, такие как оксид железа (III) или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 n H 2 O и оксида-гидроксида железа (III) (FeO (OH), Fe (OH) 3), образуются, когда кислород соединяется с другими элементами
Оксиды, такие как оксид железа (III) или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 n H 2 O и оксида-гидроксида железа (III) (FeO (OH), Fe (OH) 3), образуются, когда кислород соединяется с другими элементами В сухом кислороде железо легко образует оксид железа (II), но для образования гидратированных оксидов железа Fe 2 O 3 - x (OH) 2 x, которые в основном содержат ржавчину, обычно требуется кислород и вода. Производство свободного кислорода фотосинтезирующими бактериями около 3,5 миллиардов лет назад привело к осаждению железа из раствора в океанах в виде Fe 2 O 3 в экономически важном железорудном гематите.
Оксиды имеют ряд различных структур, от отдельных молекул до полимерных и кристаллических структур. В стандартных условиях оксиды могут варьироваться от твердых веществ до газов.
Оксиды большинства металлов имеют полимерную структуру. Оксид обычно связывает три атома металла (например, структура рутила) или шесть атомов металла (структуры карборунда или каменной соли ). Поскольку МО-связи обычно прочные, а эти соединения представляют собой сшитые полимеры, твердые вещества, как правило, нерастворимы в растворителях, хотя на них действуют кислоты и основания. Формулы часто обманчиво просты, если многие из них являются нестехиометрическими соединениями.

Двуокись углерода является основным продуктом сгорания ископаемого топлива.

Окись углерода является продуктом неполного сгорания топлива на основе углерода и прекурсором многих полезных химикатов.

Двуокись азота является проблемным загрязнителем из двигателей внутреннего сгорания.

Диоксид серы, основной оксид серы, испускается вулканами.
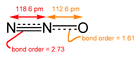
Закись азота («веселящий газ») - мощный парниковый газ, производимый почвенными бактериями.
Хотя большинство оксидов металлов являются полимерными, некоторые оксиды представляют собой молекулы. Примерами молекулярных оксидов являются диоксид углерода и монооксид углерода. Все простые оксиды азота являются молекулярными, например NO, N 2 O, NO 2 и N 2 O 4. Пятиокись фосфора - более сложный молекулярный оксид с обманчивым названием, реальная формула которого - P 4 O 10. Некоторые полимерные оксиды деполимеризуются при нагревании с образованием молекул, примерами которых являются диоксид селена и триоксид серы. Тетроксиды встречаются редко. Более общие примеры: рутений, осмий тетраоксид и тетраоксид ксенон.
Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, некоторыми примерами являются нитрозоний (NO +), ванадил (VO 2+) и уранил ( UO2+ 2). Конечно, известно много соединений как с оксидами, так и с другими группами. В органической химии к ним относятся кетоны и многие родственные карбонильные соединения. Для переходных металлов известно много оксокомплексов, а также оксигалогенидов.
Превращение оксида металла в металл называется восстановлением. Восстановление может быть вызвано многими реагентами. Многие оксиды металлов превращаются в металлы просто при нагревании.
Металлы «извлекаются» из оксидов химическим восстановлением, то есть добавлением химического реагента. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды. Участвует много реакций, но упрощенное уравнение обычно отображается как:
Оксиды металлов можно восстанавливать органическими соединениями. Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств ферментами P450 и производство этиленоксида, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Металлы с более низкой реактивностью можно уменьшить только путем нагревания. Например, оксид серебра разлагается при 200 ° C:
Металлы с более высокой реакционной способностью вытесняют оксид металлов с меньшей реакционной способностью. Например, цинк более активен, чем медь, поэтому он замещает оксид меди (II) с образованием оксида цинка :
Помимо металлов, водород также может замещать оксиды металлов с образованием оксида водорода, также известного как вода:
Поскольку металлы, которые являются реакционноспособными, образуют оксиды, которые являются стабильными, некоторые оксиды металлов необходимо подвергнуть электролизу для восстановления. Это включает в себя оксид натрия, оксид калия, оксид кальция, оксид магния и оксид алюминия. Перед погружением в них графитовых электродов оксиды необходимо расплавить:
Оксиды обычно реагируют с кислотами или основаниями, иногда с обоими. Те, которые вступают в реакцию только с кислотами, называются основными оксидами. Те, которые вступают в реакцию только с помощью оснований, называются «кислыми оксидами». Оксиды, которые реагируют с обоими, являются амфотерными. Металлы имеют тенденцию образовывать основные оксиды, неметаллы - кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами ( металлоидами ). Эта реакционная способность лежит в основе многих практических процессов, таких как извлечение некоторых металлов из их руд в процессе, называемом гидрометаллургией.
Оксиды более электроположительных элементов имеют тенденцию быть основными. Их называют основными ангидридами. Под воздействием воды они могут образовывать основные гидроксиды. Например, оксид натрия является основным - при гидратации он образует гидроксид натрия. Оксиды более электроотрицательных элементов имеют тенденцию быть кислыми. Их называют «ангидридами кислот»; добавляя воду, они образуют оксокислоты. Например, гептоксид дихлора представляет собой ангидрид кислоты; хлорная кислота - это полностью гидратированная форма. Некоторые оксиды могут действовать как кислоты и основания. Они амфотерные. Пример - оксид алюминия. Некоторые оксиды не проявляют поведения как кислоты или основания.
Ион оксида имеет формулу O 2-. Это сопр женное основание из гидроксида иона, OH - и встречается в ионных твердых веществ, таких как оксид кальция. O 2- нестабилен в водном растворе - его сродство к H + настолько велико (p K b ~ -38), что он отрывает протон от молекулы H 2 O растворителя:
Константа равновесия вышеуказанных реакций p K eq ~ −22.
В 18 веке оксиды называли кальцием или кальцием в честь процесса прокаливания, используемого для производства оксидов. Позже Calx был заменен на oxyd.
Восстановительное растворение оксида переходного металла происходит, когда растворение связано с окислительно- восстановительным процессом. Например, оксиды трехвалентного железа растворяются в присутствии восстановителей, которые могут включать органические соединения. или бактерии Восстановительное растворение является неотъемлемой частью геохимических явлений, таких как цикл железа.
Восстановительное растворение не обязательно происходит на участке адсорбции восстановителя. Вместо этого добавленный электрон проходит через частицу, вызывая восстановительное растворение в другом месте частицы.
Иногда для обозначения оксидов используют соотношение металл-кислород. Таким образом, NbO будет называться монооксидом ниобия, а TiO 2 - диоксидом титана. Это название следует за греческими числовыми префиксами. В более ранней литературе и в настоящее время в промышленности оксиды называют добавлением суффикса -a к названию элемента. Следовательно, оксид алюминия, оксид магния и оксид хрома представляют собой соответственно Al 2 O 3, MgO и Cr 2 O 3.
К особым видам оксидов относятся пероксид, O2- 2, и супероксид, O- 2. В таких формах кислород имеет более высокую (менее отрицательную) степень окисления, чем оксид.
В химических формулах оксидов этих химических элементов в их самой высокой степени окисления предсказуемы и являются производными от числа валентных электронов для этого элемента. Даже химическая формула O 4, тетракислорода, предсказуема как элемент группы 16. Единственным исключением является медь, для которой оксидом с наивысшей степенью окисления является оксид меди (II), а не оксид меди (I). Другим исключением является фторид, который существует не как F 2 O 7, как можно было бы ожидать, а как OF 2.
Поскольку фтор более электроотрицателен, чем кислород, дифторид кислорода (OF 2) не представляет собой оксид фтора, а вместо этого представляет собой фторид кислорода.
В следующей таблице приведены примеры обычно встречающихся оксидов. Приведено лишь несколько представителей, так как количество встречающихся на практике многоатомных ионов очень велико.