Haemosporidium undecimanae Haemosporidium Lewkowiczimoridium Lewkowicz Plasmodium falciparum - это одноклеточный простейший паразит людей, и самые смертоносные виды Плазмодий, вызывающий малярию у людей. Паразит передается через укус самки Anopheles комара вызывает наиболее опасную форму заболевания - малярию falciparum. На его долю приходится около 50% всех случаев малярии. Таким образом, P. falciparum считается самым смертоносным паразитом у людей, в 2018 году унесшим жизнь 405 000 человек. Он также связан с развитием рака крови (лимфома Беркитта ) и классифицируется как канцероген группы 2A.
Вид произошел от малярийного паразита Laverania, обнаруженного у горилл около 10 000 лет назад. Альфонс Лаверан был первым, кто идентифицировал паразита в 1880 году, и назвал его Oscillaria malariae. Рональд Росс обнаружил его передачу через комары в 1897 году. Джованни Баттиста Грасси истолнил полную передачу от самки анофелинового комара человеку в 1898 году. В 1897 году Уильям Х. Велч создал название Plasmodium falciparum, которое ICZN официально было принято в 1954 году. P. falciparum принимает несколько различных форм в течение своего жизненного цикла. Стадия заражения человека - это спорозоит из слюнной железы комара. Спорозоиты растут и размножаются в печени, превращаясь в мерозоиты. Эти мерозоиты проникают в эритроциты (эритроциты) с образованием трофозоитов, шизонтов и гаметоцитов, во время которых симптомы малярии. У комара гаметоциты подвергаются сексуальному представлению в зиготу, которая превращается в оокинету. Оокинеты образуют ооциты, из которых образуются спорозоиты.
По данным Всемирной организации здравоохранения Доклада о малярии в мире за 2019 год, в 2018 году во всем мире было зарегистрировано 228 миллионов случаев малярии, что привело к примерно 405000 смертей. Почти все случаи смерти от малярии вызваны P. falciparum, и 94% таких случаев произошел в Африке. Больше всего страдают дети в возрасте до пяти лет, на долю которых приходится 61% от общего числа смертей. В Африке к югу от Сахары более 75% случаев вызваны P. falciparum, тогда как в других малярийных странах преобладают другие, менее вирулентные виды плазмодий.
Содержание
- 1 История
- 1.1 Открытие
- 1.2 Происхождение и эволюция
- 2 Структура
- 3 Жизненный цикл
- 3.1 У людей
- 3.1.1 Стадия печени или экзоэритроцитарная шизогония
- 3.1.2 Стадия крови или эритроцитарная шизогония
- 3.1.2.1 Трофозоит
- 3.1.2.2 Шизонт
- 3.1.2.3 Гаметоцит
- 3.2 Инкубационный период
- 3.3 У комаров
- 4 Взаимодействие с иммунной системой человека
- 4.1 Иммунный ответ
- 4.2 Уклонение от иммунной системы
- 5 Патогенез
- 6 Распространение и эпидемиология
- 7 Лечение
- 7.1 История
- 7.2 Неосложненная малярия
- 7.3 Тяжелая малярия
- 7.4 Вакцинация
- 8 Рак
- 9 Влияние на геном человека
- 10 См. Также
- 11 Ссылки
- 12 Дополнительная литература
- 13 Внешние ссылки
История
 Рисунок Лавераном различных стадий P. falciparum, как видно на свежая кровь (1880).
Рисунок Лавераном различных стадий P. falciparum, как видно на свежая кровь (1880). Малярия Falciparum была известна древним грекам, которые дали общее название πυρετός pyretós «лихорадка». Гиппократ (ок. 460–370 гг. До н.э.) дал несколько описаний третичной лихорадки и четвертичной лихорадки. Он был распространен во всей древнеегипетской и римской цивилизации. Именно римляне назвали болезнь «малярией» - мала для плохого и aria для воздуха, поскольку они считали, что болезнь распространяется через загрязненный воздух или миазмы.
Discovery
немецкий врач, Иоганн Фридрих Меккель, должно быть, первым увидел P. falciparum, но не знал, что это было. В 1847 году он сообщил о наличии гранул черного пигмента в крови и селезенке пациента, умер от малярии. Врач французской армии Шарль Луи Альфонс Лаверан, работая в больнице Бонице (ныне Аннаба в Алжире), правильно определил паразита как возбудителя малярии в 1880 году. Он представил свое открытие перед Французской медицинской академией в Париже и опубликовал его в The Lancet в 1881 году. Он дал научное название Oscillaria malariae. Теодор Альбрехт Эдвин Клебс и Коррадо Томмази-Крудели, заявили, что они представляют собой бактерию, его открытие было воспринято скептически главным образом, как они были назвали Bacillus malariae) как возбудитель малярии. Открытие Лаверана было широко принято только через пять лет, когда Камилло Гольджи подтвердил наличие паразита с помощью более совершенного микроскопа и техники окрашивания. Лаверан был удостоен Нобелевской премии по физиологии и медицине в 1907 году за свою работу. В 1900 году итальянский зоолог Джованни Баттиста Грасси классифицировал Плазмодиум виды на основании времени лихорадки у пациента; злокачественная третичная малярия, вызвана Laverania malariae (теперь P. falciparum), доброкачественная третичная малярия - Haemamoeba vivax (теперь P. vivax ), четвертичная малярия - Haemamoeba malariae (теперь P. malariae ).
Британский врач Патрик Мэнсон сформулировал теорию малярии от комаров в 1894 году; до этого времени считалось, что малярийные паразиты распространяются в воздухе как миазмы, Греческое слово, обозначающее загрязнение Росс обнаружил в 1897 году, что малярийный паразиты обитают в определенных комарах, что малярийный паразиты, обитающие в определенных комарах, его коллега Рональд Росс, хирург британской армии, отправился в Индию, чтобы проверить эту теорию. Примерно в то же время Грасси, что P. falciparum передается от человека только самками анофелинового комара (в его случае Anopheles claviger ) Росс, Мэнсон и Грасси были номинированы на Нобелевскую премию по физиологии и медицине в 1902 году. При спорных обстоятельствах для награждения был выбран только Рональд Росс.
Таксономия велась долго. Только в 1954 году Международная комиссия по зоологической номенклатуре официально утвердила биномиальный Plasmodium falciparum. Допустимый род Plasmodium был создан двумя врачами Этторе Маркиафава и Анджело Челли в 1885 году. Название вида было введено американским врачом Уильямом Генри Велчем в 1897 году.. Это происходит от латинского falx, что означает «серп», и parum, что означает «подобный или равный другому».
Происхождение и эволюция
P. falciparum, в настоящее время принято, что он произошел от вида Laverania (подрод Plasmodium, обнаруженного у обезьян), обитающих у горилл в Африке. Генетическое разнообразие указывает на то, что человеческие простейшие появились около 10 000 лет назад. Ближайшим родственником P. falciparum является P. praefalciparum, паразит горилл, что подтверждено митохондриальной, апикопластической и ядерной ДНК отслеживается. Эти два вида связаны с паразитом шимпанзе P. reichenowi, который ранее считался ближайшим родственником P. falciparum. Когда-то считалось, что P. falciparum произошел от паразита птиц.
Уровни генетического полиморфизма очень низкий в геноме P. falciparum по сравнению с геномом близкородственных видов, заражающих обезьяны. Плазмодий (включая P. praefalciparum). Это свидетель о недавнем происхождении P. falciparum у людей, поскольку единственный штамм P. praefalciparum стал инфицировать людей. Генетическая информация Plasmodium falciparum сигнализирует о недавнем расширении, которое совпадает с сельскохозяйственной революцией. Вероятно, что развитие экстенсивного сельского хозяйства увеличило плотность месторождений, что могло спровоцировать эволюцию и распространение Plasmodium falciparum.
Структура
 Мазок крови P. falciparum культура (штамм K1 - бесполые формы) - несколько эритроцитов имеют внутри себя кольцевые стадии. Ближе к центру - шизонт, слева - трофозоит.
Мазок крови P. falciparum культура (штамм K1 - бесполые формы) - несколько эритроцитов имеют внутри себя кольцевые стадии. Ближе к центру - шизонт, слева - трофозоит. П. falciparum не имеет фиксированной структуры, но претерпевает постоянные изменения в течение своего жизненного цикла. Спорозоит имеет веретеновидную форму, длину 10–15 мкм. В печени он вырастает в яйцевидный шизонт диаметром 30–70 мкм. Каждый шизонт производит мерозоиты, каждый из которых составляет примерно 1,5 мкм в длину и 1 мкм в диаметре. В эритроците мерозоит образует кольцевидную структуру, превращаясь в трофозоит. Трофозоиты питаются гемоглобином и образуют гранулированный пигмент, называемый гемозоином. В отличие от гаметоцитов других видов плазмодий, гаметоциты P. falciparum имеют удлиненную форму полумесяца, по которой их иногда можно идентифицировать. Зрелый гаметоцит имеет длину 8–12 мкм и ширину 3–6 мкм. Оокинета также имеет удлиненную форму, ее размер составляет около 18–24 мкм. Ооциста имеет округлую форму и может достигать 80 мкм в диаметре. Микроскопическое исследование мазка крови выявляет только ранние (кольцевые) трофозоиты и гаметоциты, находящиеся в периферической крови. Зрелые трофозоиты или шизонты в мазках периферической крови, поскольку они обычно секвестрируются в тканях. Иногда на поверхности эритроцитов видны нечеткие красные точки в форме запятой. Эти точки представляют собой щель Маурера и предоставляют собой секреторные органеллы, вырабатывающие белки и ферменты, необходимые для роста питательных веществ и процессов иммунного уклонения.
Апикальный комплекс, который на самом деле представляет собой комбинацию органелл, является важным состав. Он содержит секреторные органеллы, называемые роттриями и микронемами, которые жизненно важны для подвижности, адгезии, инвазии клеток-хозяев и образования паразитофорных вакуолей. Как апикомплексан, он содержит пластиду, апикопласт, похожую на растительные хлоропласты, которые они, вероятно, приобрели, поглощая (или подвергаясь вторжению) эукариотическая водоросль и сохраняющая пластиду водорослей как отличительная четыре органеллу , заключенная в мембраны. Апикопласт участвует в синтезе липидов и некоторых других соединений и является привлекательной мишенью для лекарств. Во время стадии инфекции, используется функция бесполой кровью, используется функция апикопласта - производство предшественников изопреноидов изопентенилпирофосфата (IPP) и диметилаллилпирофосфата (DMAPP) через MEP (немевалонатный).
Геном
В 1995 г. был запущен проект Malaria Genome для секвенирования генома P. falciparum. О геноме его митохондрии сообщалось в 1995 г., о геноме нефотосинтетической пластиды, известной как апикопласт, в 1996 г., а о последовательности первой ядерной хромосомы (хромосомы 2) в 1998 году. Последовательность хромосомы представлена в 1999 году, весь геном представлен 3 октября 2002 года. Геном размером примерно 24 мегабаза чрезвычайно богат AT (около 80%) и организован в 14 хромосом. Было описано чуть более 5300 генов. Многие гены, участвующие в антигенных вариациях, расположены в субтеломерных областях хромосом. Они делятся на семейство вар, риф и стевор. В геноме существует 59 генов var, 149 Rif и 28 генов stevor, а также несколько псевдогенов и усечений. По оценкам, 551, или примерно 10%, из предсказанных кодируемых ядер белков нацелены на апикопласт, в то время как 4,7% протеома нацелены на митохондрии.
Жизненный цикл
Люди являются промежуточными хозяевами, в которых происходит бесполое размножение, а самки анофелиновых комаров являются окончательными хозяевами, несущими стадию полового размножения.
У человека
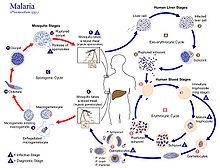 Жизненный цикл плазмодия
Жизненный цикл плазмодия Заражение человека начинается с укуса инфицированной самки комара Anopheles. Из примерно 460 видов Anopheles комаров более 70 видов являются переносчиками малярии falciparum. Anopheles gambiae является одним из самых известных и наиболее распространенных переносчиков, особенно в Африке.
Инфекционная стадия, называемая спорозоитами, выделяющаяся из слюнных желез через хоботок комара, попадает в кровоток во время кормления. Слюна комаров содержит антигемостатические и противовоспалительные ферменты, которые нарушают свертываемость крови и подавляют болевую реакцию. Обычно в инфицированном укусе 20–200 спорозоитов. Иммунная система выводит спорозоиты из кровотока в течение 30 минут. Но некоторые из них убегают и быстро проникают в клетки печени (гепатоциты ). Спорозоиты перемещаются в кровотоке за счет скольжения, состоящим из белков актина и миозина под их плазматической мембраной.
Стадия печени или экзоэритроцитарная шизогония
Проникновение в гепатоциты, паразит теряет свой апикальный комплекс и поверхностную оболочку превращается в трофозоит. Внутри паразитофорной вакуоли гепатоцита он проходит 13–14 раундов митоза и мейоза, в результате чего образуется синцитиальная клетка (ценоцит ), называемая шизонтом. Этот процесс называется шизогонией. Шизонт состоит из десятков тысяч ядер. С поверхности шизонта появляются десятки тысяч гаплоидных (1n) дочерних клеток, называемые мерозоитами. На стадии печени может образовываться до 90 000 мерозоитов, которые в конечном итоге попадают в кровоток в заполненных паразитами пузырьках, называемых меросомами.
Стадия крови или эритроцитарная шизогония
мерозоиты использовать апикомплексан органеллы инвазии (апикальный комплекс, пленка и поверхностная оболочка) для распознавания и проникновения в эритроцитина (красные кровяные тельца). Паразит сначала связывается с эритроцитом в случайной ориентации. Затем он переориентируется так, что апикальный комплекс находится в непосредственной близости от мембраны эритроцита. Паразит образует паразитофорную вакуоль, позволяющую ему развиваться внутри эритроцита. Этот цикл заражения происходит очень синхронно, когда все паразиты в крови находятся на одной и той же стадии развития. Было показано, что этот точный механизм синхронно зависит от собственного циркадного ритма.
человека-хозяина. В эритроците метаболизм паразита зависит от переваривания гемоглобина. Клинические симптомы малярии, такие как лихорадка, анемия и неврологические расстройства, возникают на стадии крови.
Паразит также может вызвать морфологию эритроцита, вызывая выступы на мембране эритроцита. Инфицированные эритроциты часто секвестрируются в различных тканях или органах человека, таких как сердце, печень и мозг. Это вызвано присутствием на мембране эритроцитов белков клеточной поверхности, полученных из паразитов, и именно эти белки связываются с рецепторами на клетках человека. Секвестрация в головном мозге вызывает церебральную малярию, очень тяжелую форму заболевания, которая увеличивает вероятность смерти жертвы.
Трофозоит
После проникновения в эритроцит паразит теряет свои специфические органеллы инвазии (апикальный комплекс и поверхностная оболочка) и де-дифференцируется в круглый трофозоит, расположенный в паразитофорной вакуоли. Молодой трофозоит (или стадия «кольца» из-за его морфологии на окрашенных мазках крови) вырастает до того, как подвергнуться шизогонии.
Schizont
На стадии шизонта паразит многократно реплицирует свою ДНК и множественные митотические деления выполняются асинхронно. Каждый шизонт образует 16-18 мерозоитов. Эритроциты разрушаются мерозоитами. Освободившиеся мерозоиты проникают в свежие эритроциты. Свободный мерозоит в кровотоке примерно 60 секунд, прежде чем попадет в другой эритроцит.
Продолжительность каждой стадии крови составляет примерно 48 часов. Это вызывает характерные клинические проявления малярии falciparum, такие как лихорадка и озноб, соответствующие синхронному разрыву инфицированных эритроцитов.
Гаметоцит
Некоторые мерозоиты разделяются на половые, мужские и женские формы гаметоциты. Этим гаметоцитам требуется примерно 7–15 дней для достижения полной зрелости в ходе процесса, называемого гаметоцитогенезом. Затем они поглощаются самкой комара Anopheles во время еды кровью.
Инкубационный период
Время появления симптомов инфекции (так называемый инкубационный период ) - самый короткий для P. falciparum среди видов Plasmodium. Средний инкубационный период составляет 11 дней, но может меняться от 9 до 30 дней. В единичных случаях регистрировались продолжительные инкубационные периоды до 2, 3 или даже 8 лет. Беременность и коинфекция ВИЧ - важные условия для отсроченных симптомов. Паразитов можно обнаружить в образцах крови к 10-му дню после заражения (предпатентный период).
У комаров
В средней кишке комара процесс созревания женской гаметы влечет за собой незначительные морфологические изменения, становясь более увеличенные и сферические. Мужской гаметоцит подвергается быстрому ядерному делению в течение 15 минут, образуя восемь флагеллированных микрогамет в процессе, называемом эксфлагелляцией. Жгутиковая микрогамета оплодотворяет самку макрогаметы с образованием диплоидной клетки, называемой зиготой. Затем зигота превращается в оокинет. Оокинета - подвижная клетка, способная проникать в другие органы комара. Он проходит через перитрофическую мембрану средней кишки комара и проходит через эпителий средней кишки. Пройдя через эпителий, оокинета попадает в базальную пластинку и оседает на неподвижную ооцисту. В течение нескольких дней ооциста претерпевает от 10 до 11 циклов клеточного деления с образованием синцитиальной клетки (споробласта ), содержащей тысячи ядер. Мейоз происходит внутри споробласта с образованием более 3000 гаплоидных дочерних клеток, называемых спорозоитами, на поверхности материнской клетки. Незрелые спорозоиты прорываются сквозь стенку ооцисты в гемолимфу. Они мигрируют в слюнные железы комаров, где подвергаются дальнейшему развитию и становятся инфекционными для человека.
Взаимодействие с иммунной системой человека
Иммунный ответ
Один анофелиновый комар может передавать сотни спорозоитов P. falciparum за один укус в условиях эксперимента. Но в природе их обычно меньше 80. Спорозоиты не попадают в кровоток напрямую и остаются в тканях кожи в течение 2–3 часов. Около 15–20% спорозоитов попадают в лимфатическую систему, где они активируют дендритные клетки, которые отправляют их на разрушение Т-лимфоцитами (CD8 + Т-клетки ). Через 48 часов после инфицирования специфичные для плазмодия CD8 + Т-клеткимогут быть обнаружены в лимфатических узлах, связанных с клетками кожи. Большинство спорозитов, остающихся в кожной ткани, уничтожается врожденной иммунной системой. Гликопротеин спорозоитов специфически активирует тучные клетки. Затем тучные клетки продуцируют сигнальные молекулы, такие как TNFα и MIP-2, которые активируют пожирателей клеток (профессиональные фагоциты), таких как нейтрофилы и макрофаги..
Лишь небольшое количество (0,5-5%) спорозоитов попадает с кровотоком в печень. В печени активированные CD8 + Т-клетки из лимфы связывают спорозоиты через циркумспорозоитный белок (CSP). Презентация антигена дендритными клетками кожи Т-клеткам также является важным процессом. Начинают с этой стадии паразиты производят различные белки, которые подавляют коммуникацию иммунных клеток. Даже на пике инфекции, когда эритроциты разрываются, иммунные сигналы недостаточно сильны, чтобы активировать макрофаги или естественные клетки-киллеры.
Уклонение иммунной системы
Хотя P. falciparum легко распознается человеком. Находясь в кровотоке, иммунная система ускользает от иммунитета, продуцируя более 2000 антигенов клеточных мембран. Спорозоиты на начальной стадии инфекции продуцируют белок циркумспорозоит (CSP), который связывается с гепатоцитами. Связыванию с гепатоцитами и проникновению в них другой белок, анонимный белок, связанный с тромбоспондином (TRAP). TRAP и другие секреторные белки (включая белок микронемы спорозоитов, необходимые для прохождения клеток 1, SPECT1 и SPECT2) из микронемы позволяют спорозоитам перемещаться по крови, избегая иммунных клеток и проникая в гепатоциты.
Во время инвазии эритроцитов мерозоиты высвобождают белок-шапка мерозоитов-1 (MCP1), антиген 1 апикальной мембраны (AMA1), антигены, связывающие эритроциты (EBA), белок, обеспечивающий с хвостовым доменом миозина A (MTIP), и поверхностные белки мерозоитов (MSP). Из этих MSP, MSP1 и MSP2 в первую очередь избегание иммунных клеток. Вирулентность P. falciparum опосредуется белками мембранных эритроцитов, которые продуцируются шизонтами и трофозоитами внутри эритроцитов и увеличиваются на мембране эритроцитов. PfEMP1 является наиболее важным способом действия как антиген и как молекула адгезии.
Патогенез
Клинические симптомы малярии falciparum вызываются разрывом шизонта. и разрушение эритроцитов. Большинство пациентов испытывают жар (>92% случаев), озноб (79%), головные боли (70%) и потливость ( 64%). Головокружение, недомогание, мышечная боль, боль в животе, тошнота, рвота, Легкая диарея и сухой кашель также обычно связаны. Высокая частота сердечных сокращений, желтуха, бледность, ортостатическая гипотензия, увеличение печени и увеличение селезенки также диагностированы.
П. falciparum, действует через секвестрацию - отличное свойство, которого нет у немногих других плазмодий. Зрелые шизонты изменяют поверхностные свойства инфицированных эритроцитов, заставляя их прилипать к стенкам кровеносных сосудов (цитоадгезия). Это приводит к нарушению микроциркуляции и нарушению функций многих органов, таких как мозг при церебральной малярии.
P. falciparum является причиной (почти) всех тяжелых заболеваний и смертей людей, вызванных малярией, в состоянии, которое называется сложным или тяжелой малярией. Осложненная малярия чаще встречается у детей в возрасте до 5 лет, а иногда и у беременных женщин (состояние, которое конкретно называется малярией, специ с беременностью ). Женщины становятся восприимчивыми к тяжелой малярии во время первой беременности. Восприимчивость к тяжелой форме малярии снижается при беременностях из-за повышенных уровней антител против вариантов поверхностных антигенов, которые на инфицированных эритроцитах. Но повышенный иммунитет увеличивает восприимчивость к малярии у новорожденных.
Распространение и эпидемиология
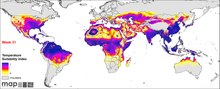 Play media Нормализованный индекс Z (T) температурной пригодности для P. falciparum, отображаемый по неделям в среднем год.
Play media Нормализованный индекс Z (T) температурной пригодности для P. falciparum, отображаемый по неделям в среднем год. П. falciparum встречается на всех континентах, кроме Европы. Согласно Всемирному докладу о малярии за 2019 год, в 2018 году от малярии пострадали 228 миллионов человек, что немного меньше 231 миллиона в 2017 году. 405 000 человек умерли от нее. Инфекция наиболее распространенной в Африке, где происходит 94% случаев смерти от малярии. Больше всего страдают дети в возрасте до пяти лет, и 61% случаев смерти от малярии приходится на эту возрастную группу. 80% инфекции обнаруживается в Африке к югу от Сахары, 7% в Юго-Восточной Азии и 2% в Восточном Средиземноморье. Нигерия имеет самый высокий уровень заболеваемости - 27% от числа случаев в мире. За пределами Африки самый высокий уровень заболеваемости в Индии, на которую приходится 4,5% глобального бремени. Европа рассматривается регионом, свободным от малярии. Исторически паразит и его болезнь были наиболее известны в Европе. Медицинские, такие как распыление инсектицидов, лекарственная терапия и экологическая инженерия с начала 20 века, привели к полному искоренению в 1970-х годах. По оценкам, около 2,4 миллиарда человек находятся в постоянном риске заражения.
Лечение
История
В 1640 году Хуан дель Вего впервые применил настойку коры хинного дерева для лечения малярии; коренные индейцы Перу и Эквадора использовали его еще раньше для лечения лихорадки. Томпсон (1650) представил этот «иезуитский лайк» Англии. Его первое зарегистрированное использование Джоном Метфордом из Нортгемптона в 1656 году. Мортон (1696) представил первое подробное описание клинической картины малярии и ее лечения хинным хвойным орехом. Гиз (1816) изучал экстракцию кристаллического хинина из коры хинного дерева и Пеллетье и Кавенту (1820) в Франции. экстрагировали чистый хинин алкалоиды, которые они назвали хинином и цинхонином. Полный синтез хинина осуществлен американскими химиками Р. Б. Вудвордом и У. Деринг в 1944 году. Вудворд получил Нобелевскую премию по химии в 1965 году.
Попытки создать синтетические противомалярийные препараты начались в 1891 году. Атабрин, используемый в 1933 году, широко использовался в Тихоанском регионе во время мировой войны. II, но был непопулярен из-за своих побочных эффектов. В конце 1930-х годов немцы разработали хлорохин, который использовался в кампаниях Северной Африки. Создав секретный военный проект под названием Проект 523, Мао Цзэдун вдохновил китайских ученых на поиск новых противомалярийных препаратов, увидев жертвы войны во Вьетнаме. Ту Юю открыл артемизинин в 1970-х годах из сладкой полыни (Artemisia annua ). Этот препарат стал известен западным ученым в конце 1980-х - начале 1990-х годов и сейчас является стандартным средством лечения. Ту получил Нобелевскую премию по физиологии и медицине в 2015 году.
Неосложненная малярия
В соответствии с рекомендациями 2010 года комбинированная терапия на основе артемизинина (АКТ) является рекомендуемой первая линия противомалярийная терапия неосложненной малярии, вызванной P. falciparum. ВОЗ комбинации такие комбинации, как артеметер / люмефантрин, артесунат / амодиахин, артесунат / мефлохин, артесунат / сульфадоксин-пириметамин и дигидроартемизинин / пиперахин.
Выбор ACT основан на уровне устойчивости к компонентам комбинации. Артемизинин и его производные не подходят для монотерапии. В качестве второго линии противомалярийного лечения не работает альтернативная альтернативная АКТ, которая, как известно, например, эффективна в данном регионе, например, например, эффективна в данном регионе, например, например, эффективна в данном регионе, например, например, эффективна в данном регионе, например, как пример, эффективна в данном регионе, например, например, эффективна в данном регионе, например, хинин плюс тетрациклин или доксициклин или клиндамицин. Любую из этих комбинаций следует применять в течение 7 дней. Для беременных в течение первого триместра рекомендуется лечение первой линии: хинин плюс клиндамицин в течение 7 дней. Артесунат плюс клиндамицин в течение 7 дней показан, если это лечение не дает результатов. Путешественникам, возвращающимся в неэндемичные страны, рекомендуются атоваквон / прогуанил, артеметер / люмефантринани и хинин плюс доксициклин или клиндамицин.
Тяжелая форма малярии
Для взрослым рекомендуется внутривенно (IV) или внутримышечно (IM) артесунат. Хинин является приемлемой альтернативой, если парентеральный артесунат недоступен.
Для детей, особенно в эндемичных по малярии Африки, артесунат внутривенно или внутримышечно, хинин (внутривенная инфузия или разделенная внутримышечная инъекция) и артеметер внутримышечно. рекомендуется.
Парентеральные противомалярийные средства ввести в минимум 24 часов, независимо от способности пациента переносить пероральные препараты раньше. После этого рекомендуется полное лечение, включая полный курс АКТ или хинина плюс клиндамицин доксициклин.
Вакцинация
RTS, S - единственный кандидат в качестве вакцины против малярии, прошедший клинические испытания. Анализ результатов испытаний фазы III (проведенного в период с 2011 по 2016 год) выявил довольно низкую эффективность (20-39% в зависимости от возраста, до 50% у детей в возрасте 5-17 месяцев), что указывает на то, что вакцина будет не приводит к полной защите и искоренению.
Рак
Международное агентство по изучению рака (IARC) классифицирует малярию, вызванную P. falciparum, как канцероген группы 2A, Это означает, что паразит, вероятно, вызывает у человека рак. Установлена его связь с раком клеток крови (лимфоцит ), называемым лимфомой Беркитта. Лимфома Беркита была обнаружена Денисом Беркита в 1958 году у африканских детей, вероятно, вызван некоторыми инфекционными заболеваниями. В 1964 году из раковых клеток был идентифицирован вирус, позже названный вирусом Эпштейна-Барра (EBV) в честь первооткрывателей. Впоследствии было доказано, что вирус является прямым агентом рака, и теперь он классифицируется как канцероген группы 1. В 1989 году стало понятно, что для ВЭБ необходимы другие инфекции, такие как малярия, чтобы вызвать трансформацию лимфоцитов. Сообщалось, что заболеваемость лимфомой Беркитта снизилась благодаря эффективному лечению малярии в течение нескольких лет. Фактическая роль P. falciparum оставалась неясной в течение следующих двух с половиной десятилетий. Известно, что EBV вызывает злокачественные опухоли лимфоцитов с использованием своих вирусных белков (таких антигенов, как EBNA-1, EBNA-2, LMP-1 и LMP2A ). С 2014 года стало ясно, что P. falciparum способствует развитию лимфомы. Эритроциты, инфицированные P. falciparum, напрямую связываются с В-лимфоцитами через домен CIDR1α PfEMP1. Это связывание активирует толл-подобные рецепторы (TLR7 и TLR10 ), вызывая непрерывную активацию лимфоцитов, которые подвергаются пролиферации и дифференцировке в плазматические клетки, тем самым увеличивая секрецию IgM и цитокинов. Это, в свою очередь, активирует фермент, называемый индуцированной активацией цитидиндезаминазы (AID), который имеет тенденцию вызывать мутацию в ДНК (посредством двухцепочечного разрыва ) лимфоцитов, инфицированных EBV. Поврежденная ДНК подвергается неконтролируемой репликации, что делает клетку злокачественной.
Влияние на геном человека
Высокая смертность и заболеваемость, вызванный P. falciparum, оказал сильное избирательное давление на геном человека. Некоторые генетические факторы обеспечивают некоторую устойчивость к инфекции Plasmodium, включая серповидно-клеточный признак, талассемию, дефицит глюкозо-6-фосфатдегидрогеназы, и отсутствие антигенов Даффи на красных кровяных тельцах. Э. А. Бет, врач, работающий в Южной Родезии (ныне Зимбабве ), в 1948 году заметил, что серповидно-клеточная анемия связана с более низким уровнем заражения малярией. Это предположение было повторено Дж. Б. С. Холдейн в 1948 году, который предположил, что талассемия может обеспечить аналогичную защиту. Эта гипотеза с тех пор была подтверждена и распространена на гемоглобин E, гемоглобин C и гемоглобин S.
См. Также
Ссылки
Дополнительная литература
- Колумбийские ученые разрабатывают вычислительный инструмент для обнаружения Plasmodium falciparum (на испанском языке)
- Allison, AC (февраль 1954 г.). «Защита, обеспечиваемая серповидно-клеточной характеристикой против субтертианской малярийной инфекции». Br Med J. 1 (4857): 290–4. doi : 10.1136 / bmj.1.4857.290. PMC 2093356. PMID 13115700. CS1 maint: ref = harv (ссылка )
- Allison, AC (1964). «Полиморфизм и естественный отбор в популяциях людей». Холод Spring Harb. Symp. Quant. Biol. 29 : 137–49. doi : 10.1101 / sqb.1964.029.01.018. PMID 14278460. CS1 maint: ref = harv (ссылка )
- Cholera, R; Brittain NJ; Gillrie MR; et al. (Январь 2008 г.). «Нарушение цитоадгезии Эритроциты, инфицированные Plasmodium falciparum, содержащие серповидный гемоглобин ". Proc. Natl. Acad. Sci. USA 105 (3): 991–6. Bibcode : 2008PNAS..105..991C. doi : 10.1073 / pnas.0711401105. PMC 2242681. PMID 18192399.
- Mockenhaupt, FP; Ehrhardt, S.; Otchwemah, R; et al. (Май 2004 г.). «Ограниченное влияние вариантов гемоглобина на аллели msp1 и msp2 Plasmodium falciparum при симптоматической малярии». Trans. Soc. Trop. Med. Hyg. 98 (5): 302–10. doi : 10.1016 / j.trstmh.2003.10.001. PMID 15109555. CS1 maint: ref = harv (ссылка )
- Roberts, Larry S.; Яновы, Джон (2005). Основы паразитологии (7-е изд.). McGraw-Hill Education (выпуски ISE). ISBN 978-0-07-111271-0. CS1 maint: ref = harv (ссылка )
Внешние ссылки
Последняя правка сделана 2021-06-02 07:44:14
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное).
Обратная связь: support@alphapedia.ru

