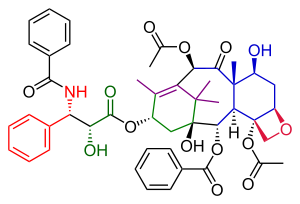
 Данишефский Общий синтез таксола обзор с точки зрения сырья
Данишефский Общий синтез таксола обзор с точки зрения сырья Итого по таксолу Данишефского Синтез в органической химии является важным третьим объектом Синтез таксола, опубликованным группой Самуэля Данишефски в 1996 году, через два года после первых двух попыток, описанных в Общий синтез таксола Холтона и полный синтез таксола Николау. В совокупности они дают хорошее представление о применении органической химии в тотальном синтезе.
Путь Данишевского к таксолу во многом похож на путь Николау. Оба являются примерами конвергентного синтеза со связыванием A и C кольца из двух предшественников. Основной характеристикой варианта Данишефского является завершение кольца оксетана D на кольце циклогексанола C до образования 8-членного кольца B. Наиболее известным исходным материалом является (+) энантиомер кетона Виланда-Мишера. Это соединение коммерчески доступно в виде единственного энантиомера, и единственная хиральная группа, присутствующая в этой молекуле, способна управлять всей последовательностью органических реакций до единственного оптически активного конечного продукта таксола. Последний этап, добавление хвоста, идентичен таковому у Николау и основан на химии Одзима.
С точки зрения закупки сырья эта молекула таксола состоит из вышеупомянутого кетона Виланда-Мишера, 2-метил-3-пентанон, литийалюмогидрид, тетроксид осмия, фениллитий, хлорхромат пиридиния, реактив Кори-Чайковского и акрилоилхлорид. Ключевые химические превращения: реакция Джонсона-Кори-Чайковского и реакция Хека.
Таксол в результате добавления хвоста лактама Одзима к спирт 51, представляющий собой баккатин III (исходная целевая молекула синтеза Данишефского). Спирт 51 был получен в результате аллильного окисления α-ацилкетона 49 . Соединение 49 в конечном итоге было получено в результате реакции Хека трифлата енола трифлата 38, который использовали для замыкания B-кольца. Трифлат енола 38 образовался в результате перегруппировки соединения 31 после защиты его гидроксильной группы. Соединение 31 было получено в результате соединения колец A и C с альдегидом 21 в сочетании с реагентом виниллития, полученным из циангидрина 29. Цианогидрин 29 произошел как этилизопропилкетон (22 ). Альдегид 21 получали из соединения 17, которое являлось продуктом открытия кеталя 12. Кетал 12 в конечном итоге был получен из кетона Виланда-Мишера (1).
 |
| Ретросинтез |
|---|
Схема 1 показывает синтез оксетанового D-кольца из C-кольца, начиная с (+) энантиомера кетона Виланда-Мишера (1). Восстановление этого дикетона борогидридом натрия давало ненасыщенный кетоспирт 2, который был защищен как ацетат. Образование кеталя сопровождалось перегруппировкой алкена. Ацетильная группа была заменена трет-бутилдиметилсилильной защитной группой. Гидроборирование с последующим окислением перекисью водорода давало спирт 5 . Затем гидроксильную группу окисляли до карбонильной группы с образованием кетона 6 под действием дихромата пиридиния. После того как все чувствительные функциональные группы защищены, метиленовая группа, необходимая для оксетанового кольца D, была затем предоставлена реагентом Кори-Чайковского, который преобразовал карбонильную группу в эпоксид (7 ). Обработка этого эпоксида изопропоксидом алюминия давала аллиловый спирт 8. Еще две гидроксильные группы добавляли окислением вновь образованной двойной связи каталитическим количеством тетроксида осмия в присутствии N-метилморфолина N-оксида. Этой реакции не хватало стереоспецифичности, поэтому выход триола 9 с правильной стереохимией был снижен. Первичный спирт был защищен как силиловый эфир, а вторичный спирт был активирован как трифлат ( (11). Нагревание этого триметилсилилзащищенного трифлата в кипящем с обратным холодильником этиленгликоле замыкает кольцо с образованием оксетана 12.
 |
| Схема 1 |
|---|
На следующей стадии (Схема 2 ), начиная с из кеталя 12 циклогексановое кольцо было отщеплено, чтобы обеспечить две точки закрепления для слияния с кольцом A. Спирт 12 защищен бензильной группой. Ацетонидную защитную группу удаляли из кетона. Кетон 14 превращали в силиленольный эфир 15реакцией с триметилсилилтрифлатом и модифицированным окислением Руботтома с использованием 3,3-диметилдиоксиран с последующим обработкой камфорсульфоновой кислотой введена гидроксильная группа альфа в кетон. Раскрытие цикла окислительным расщеплением с помощью тетраацетата свинца в метаноле давало соединение 17 . На следующей стадии альдегид защищали как диметилацеталь, а сложный эфир восстанавливали с получением первичного спирта 18 . Гидроксильная группа была преобразована в элиминировании Грико в селенид (19), который при окислении пероксидом водорода давал алкен 20. Озонолиз с озон и трифенилфосфин предоставили альдегид 21.
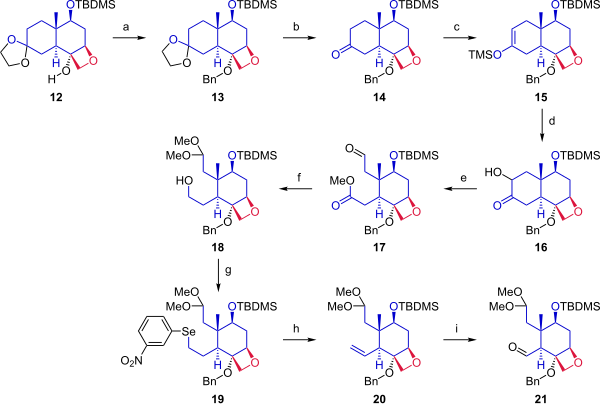 |
| Схема 2 |
|---|
Для этого синтеза (Схема 3 ) морфолиненамин этилового эфира изопропилкетон подвергают взаимодействию с акрилоилхлоридом в сочетании присоединением нуклеофильного конъюгата и нуклеофильным ацильным замещением с получением после гидролиза дикетона 25 . Реакция с гидразином в триэтиламине и этаноле давала гидразон 26. После необычного йодирования гидразона, которое также включало иодирование альфа до карбонильной группы и удаление HI, полностью конъюгированный винилйодид 28 был получен при неожиданном дегидрировании. Кетон превращали в циангидрин 29с помощью триметилсилилцианида, цианида калия и краун-эфира.
|
| Схема 3 |
|---|
Как показано в Схема 4, нижняя часть синтеза кольца В таксола включает реакцию кольцевой С альдегидной группы 21 . Группа кетона была снята с защиты под действием фторида тетра-н-бутиламмония, и двойная связь была эпоксидирована мета-хлорпероксибензойной кислотой до эпоксида 32 . Этот эпоксид затем гидрогенизировали водородом над палладием на угле с получением диола 33, который на следующей стадии был защищен как циклический карбонатный эфир (34).
L-селектрид восстановление енона 34 давало кетон 35 . Кетон превращали в винил трифлат 36с использованием фенилтрифлимида и гексаметилдисилазида калия в тетрагидрофуране при -78 ° C.. Этот винилтрифлат был одной из функциональных групп, необходимых для реакции Хека. Для образования другой реакционноспособной группы ацетальную группу удаляли с получением альдегида 37, который впоследствии превращали в концевой алкен 38в реакции Виттига. с участием метилентрифенилфосфорана. Внутримолекулярная реакция Хека включала тетракис (трифенилфосфин) палладий (0) и карбонат калия в ацетонитриле при кипячении с обратным холодильником. чтобы получить диен 39 и завершить образование кольца B.
|
| Схема 4 |
|---|
Вторая часть синтеза кольца В (Схема 5 ) была связана с правильным химическим составом вновь образованного этиленового мостика, соединяющего А и Кольца C. После схемы 4 этот мостик содержал экзоциклическую метиленовую группу, но в конечной молекуле таксола этот мостик представляет собой -ацилкетон. Требуемое преобразование было выполнено за следующие 10 шагов.
Защитная группа трет-бутилсилила в диене 39 несовместима в последующих реакциях и была заменена на триэтилсилил. Эпоксидирование диена 40 с помощью мета-хлорпероксибензойной кислоты дало оксирановое кольцо. Это служило исключительно защитной группой при подготовке к модификации экзоциклического алкена. На следующих двух стадиях бензильная защитная группа в соединении 41 была заменена ацетильной группой. Карбонатный эфир 43открывали реакцией с фениллитием с получением спирта 44 . Расщепление экзоциклической двойной связи было трудным и достигалось только при принудительных условиях (19 эквивалентов, 105 ° C, 24 часа) предполагаемыми (45). Последующее окислительное расщепление тетраацетатом свинца давало кетон 46 . Защитную группу эпоксида удаляли с помощью иодида самария (II) с получением α-ß-ненасыщенного кетона 47 . енолят получали реакцией кетона 47 с трет-бутоксидом калия, и последующая реакция с последующим ацилированием давала -ацилкетон 49.
 |
| Схема 5 |
|---|
Стадия добавления хвоста в этом синтезе (Схема 6 ) была идентична таковой в добавлении хвоста Николау и была основана на Ойма химия. Кольцо A функционализировали гидроксильной группой посредством окисления хлорхроматом пиридин α-ацилкетона 49 с образованием кетона 50. Последующее восстановление с использованием боргидрида натрия давало спирт 51 . Реакция этого спирта с лактамом Ojima 52и завершающая стадия снятия защиты силила в двух положениях триэтилсилила в соединении 53 давали таксол.
 |
| Схема 6 |
|---|
Защита: уксусный ангидрид, 4- (диметиламино) пиридин и пиридин.
Снятие защиты: этоксид натрия, этанол
Гидроксильная группа в спирте 3 (Схема 1) была защищена как ацетат во время последующего алкена. перестановка. Ацетат удаляли с помощью защитной группы трет-бутилдиметилсилил (кетон 6 ).
Защита: этиленгликоль, нафталинсульфоновая кислота
Снятие защиты: п-толуолсульфоновая кислота, ацетон и вода.
Кетон 3 (Схема 1) защищали с использованием ацетонидной группы, которая удалялась после замыкания кольца D (кетон 14, Схема 2 ).
Защита: бензилхлорид, пиридин
Снятие защиты: уксусный ангидрид, 4- (диметиламино) пиридин и пиридин
Гидроксильная группа в кетале 12(Схема 2 ) была защищена как бензиловый эфир, который был заменен намного позже в синтезе (спирт 42, Схема 5 )
Защита: карбонилдиимидазол, гидрид натрия, диметилформамид
Снятие защиты: фениллитий
Диол 33 защищен как циклический карбонатный эфир (Схема 4 ). Обработка карбонатного эфира фениллитием снимает защиту с одной гидроксильной группы и оставляет бензоильную группу, необходимую для таксола, на другой. кислород (спирт 44, Схема 5 ).
Защита: метанол, п-толуолсульфонат коллидина
Снятие защиты: тозилат пиридиния
Карбонильная группа в альдегиде 17 Схемы 2 была защищена как диметилацеталь, чтобы позволить добавление кольца A к кольцу C (Схема 4 ). Позднее с альдегида снимают защиту с помощью тозилата пиридиния, позже на Схема 4 .
Защита: мета-хлорпероксибензойная кислота
Снятие защиты: йодид самария (II), уксусный ангидрид, тетрагидрофуран
Одна из двойных связей диена 39(Схема 5 ) была защищена в виде эпоксида при подготовке к модификации другого алкена. Эпоксид присутствовал в течение 4 стадий, прежде чем был удален оксидом самария (II).
Защита: трет-бутилдиметилсилилхлорид, лутидин
Снятие защиты: тетра-н-бутиламмоний фторид, тетрагидрофуран
Ацетатная защитная группа, необходимая для ацетилирования енона 3(Схема 1 ), была заменена более устойчивой трет-бутилдиметилсилильной защитной группой. Эта силильная группа была удалена намного позже, чтобы иметь более легко удаляемую защитную группу, присутствующую на заключительных стадиях синтеза таксола (соединение 40, Схема 5 ).
Защита: триэтилсилилтрифлат, триэтиламин и дихлорметан.
Снятие защиты: фтороводород, пиридин и ацетонитрил
Триэтилсилильная группа заменяла трет-бутилсилильную защитную группу на поздней стадии синтеза (соединение 40, Схема 5 ). Группа TES позже удаляется на заключительной стадии снятия защиты силила, которая дает конечное соединение таксола.
Защита: см.: Одзима лактам
Снятие защиты: фтористый водород, пиридин и ацетонитрил
Защитная группа TES, которая присутствовала в лактаме Ojima, удаляется на заключительной стадии снятия защиты силила полного синтеза таксола.
Защита: триметилсилилцианид, цианид калия и краун-эфир
Снятие защиты: тетра- Замещение фторида н-бутиламмония
Кетон диена 28(Схема 3 ) был защищен триметилсилильной группой и удалялся, когда винилитиевая группа 30 кольца A была добавлен к альдегидной группе кольца С на 21(схеме 4 ).