 Общая структура силилового эфира
Общая структура силилового эфира Силиловые эфиры представляют собой группу химических соединений, которые содержат атом кремния , ковалентно связанный с алкокси группой. Общая структура представляет собой RRRSi-O-R, где R представляет собой алкильную группу или арильную группу. Силиловые эфиры обычно используются в качестве защитных групп для спиртов в органическом синтезе. Поскольку RRR могут представлять собой комбинации различных групп, которые можно варьировать для получения ряда силиловых эфиров, эта группа химических соединений обеспечивает широкий спектр селективности для химии защитных групп. Обычными силиловыми эфирами являются: триметилсилил (TMS ), трет-бутилдифенилсилил (TBDPS), трет-бутилдиметилсилил (TBS / TBDMS ) и триизопропилсилил (TIPS ). Они особенно полезны, потому что их можно очень выборочно устанавливать и снимать в мягких условиях.
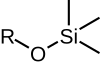 |  |  |  | 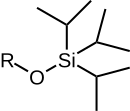 |
| TMS | TES | TBS / TBDMS | TBDPS | TIPS |
| Триметилсилиловый эфир | Триэтилсилиловый эфир | трет-бутилдиметилсилиловый эфир | трет-бутилдифенилсилиловый эфир | Триизопропилсилиловый эфир |
Хотя доступно множество методов для образования силиловых эфиров существуют две общие стратегии силилирования спиртов: реакция спирта с силилхлоридом с использованием аминового основания при комнатной температуре и реакция спирта с силилом трифлат с использованием затрудненного амина основания при низкой температуре. Силилтрифлаты более реакционноспособны, чем их соответствующие хлориды, поэтому их можно использовать для установки силильных групп в затрудненные положения. Одной исключительно надежной и быстрой процедурой является протокол Кори, в котором спирт реагирует с силилхлоридом и имидазолом в высокой концентрации в ДМФ. Если ДМФ заменить дихлорметаном, реакция протекает несколько медленнее, но очистка соединения упрощается. Обычным затрудненным основанием для использования с силилтрифлатами является 2,6-лутидин. Первичные спирты можно защитить менее чем за час, в то время как для некоторых затрудненных спиртов может потребоваться время реакции.
При использовании силилхлорида особых мер предосторожности обычно не требуется, за исключением исключения большого количества воды. Можно использовать избыток силилхлорида, но это не обязательно. Если используется избыток реагента, для продукта потребуется флэш-хроматография для удаления избытка силанола и силоксана. Силилтрифлаты чувствительны к воде и должны работать в условиях инертной атмосферы. Очистка включает добавление водной кислоты, такой как насыщенный раствор хлорида аммония. Это гасит оставшийся силильный реагент и протонирует аминные основания, удаляя их из реакционной смеси. После экстракции продукт можно очистить флэш-хроматографией.
Силилтрифлат более реакционноспособен и также преобразует кетоны в простые эфиры силиленола.
Реакция с кислотами или фторидами, такими как фторид тетра-н-бутиламмония удаляет силильную группу, когда защита больше не требуется. Более крупные заместители повышают устойчивость к гидролизу, но также затрудняют введение силильной группы.
В кислой среде относительное сопротивление составляет:
В основных средах относительное сопротивление составляет:
Можно моносилилировать симметричный диол, хотя, как известно, иногда это бывает проблематично. Например, сообщалось о следующем моносилилировании:
Однако оказалось, что эту реакцию трудно повторить. Если бы реакцию контролировали исключительно термодинамикой, то статистически, если дианион имеет реакционную способность, аналогичную моноаниону, тогда будет получена соответствующая статистическая смесь 1: 2: 1 дисилилированный: моносилилированный: несилилированный диол. Однако реакция в ТГФ осуществляется селективной благодаря двум факторам: кинетическому депротонированию первого аниона И нерастворимости моноаниона. При первоначальном добавлении TBSCl в растворе присутствует лишь незначительное количество моноаниона, а остальное находится в суспензии. Эта небольшая часть реагирует и сдвигает равновесие моноаниона, чтобы втягивать больше в раствор, тем самым позволяя получить высокие выходы соединения моно-TBS. В некоторых случаях превосходные результаты могут быть получены с бутиллитием :
. В третьем методе используется смесь DMF и DIPEA.
Селективное снятие защиты силильных групп возможно во многих случаях. Например, при синтезе таксола :

силиловые эфиры в основном дифференцируются на основе стерических или электронных свойств. В общем, кислотное снятие защиты снимает защиту менее затрудненных силильных групп быстрее, причем стерическая масса кремния является более значительной, чем стерическая масса кислорода. Снятие защиты на основе фтора снимает защиту силильных групп с низким содержанием электронов быстрее, чем силильные группы с высоким содержанием электронов. Есть некоторые свидетельства того, что снятие некоторых силильных групп происходит через гипервалентные формы кремния.
Селективное снятие защиты с силиловых эфиров подробно рассмотрено. Хотя селективное снятие защиты было достигнуто во многих различных условиях, некоторые процедуры, описанные ниже, являются более надежными. Избирательное снятие защиты, вероятно, будет успешным, если есть существенные различия в стерильности (например, первичный TBS против вторичного TBS или первичный TES против первичного TBS) или электронике (например, первичный TBDPS против первичного TBS). К сожалению, неизбежно требуется некоторая оптимизация, и часто необходимо частично выполнить снятие защиты и переработать материал.