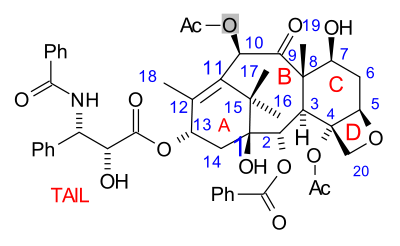
 Молекулярная структура паклитаксела.
Молекулярная структура паклитаксела.  Кристаллическая структура паклитаксела.
Кристаллическая структура паклитаксела. Паклитаксел полный синтез в органической химии является одним из основных текущих исследований усилия в общем синтезе из паклитаксела (таксола). Этот дитерпеноид является важным лекарством при лечении рака, но также дорогостоящим, поскольку его получают из ограниченного ресурса, а именно из тихоокеанского тиса ( Taxus brevifolia). Не только синтетическое воспроизведение самого соединения имеет большое коммерческое и научное значение, но также открывает путь к производным паклитаксела, которые не встречаются в природе, но обладают большим потенциалом.
Молекула паклитаксела состоит из тетрациклического ядра, называемого баккатином III, и амидного хвоста. Основные кольца удобно называть (слева направо) кольцом A ( циклогексен ), кольцом B ( циклооктан ), кольцом C ( циклогексан ) и кольцом D ( оксетаном ).
Процесс разработки лекарственного средства паклитаксела занял более 40 лет. Противоопухолевая активность экстракта коры тиса тихоокеанского была обнаружена в 1963 году в результате программы скрининга растений правительства США, которая уже существовала за 20 лет до этого. Активное вещество, отвечающее за противоопухолевую активность, было обнаружено в 1969 году, а выяснение структуры было завершено в 1971 году. Роберт А. Холтон из Университета штата Флорида преуспел в полном синтезе паклитаксела в 1994 году, проекте, который он начал в 1982 году. 1989 Холтон также разработал полусинтетический способ получения паклитаксела, исходя из 10-деацетилбаккатина III. Это соединение является предшественником биосинтеза и содержится в больших количествах, чем сам паклитаксел, в Taxus baccata (тис европейский). В 1990 году компания Bristol-Myers Squibb купила лицензию на патент на этот процесс, который в последующие годы принёс Университету штата Флорида и Холтону (с 40% долей) более 200 миллионов долларов США.
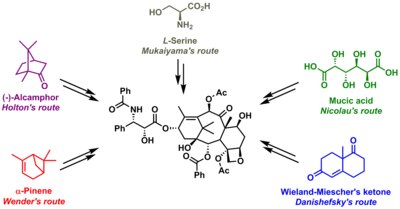 Маршруты синтеза таксола с указанием предшественников, используемых каждым из них.
Маршруты синтеза таксола с указанием предшественников, используемых каждым из них. Полный синтез таксола называют одним из самых жарких споров в 1990-х годах, когда к 1992 году было около 30 конкурирующих исследовательских групп. Число исследовательских групп, фактически сообщивших о полном синтезе, в настоящее время составляет 10 с группой Холтона (статья, впервые принятая для публикации) и группа Николау (первая опубликованная статья) первой и второй в так называемом фотофинише.
Некоторые из них действительно синтетические, но в других включена молекула-предшественник, встречающаяся в природе. Основные данные собраны ниже. Общее у всех стратегий - это синтез молекулы баккатина с последующим добавлением хвоста на последней стадии, процесс (кроме одного), основанный на лактаме Одзима.
Текущие исследования направлены на синтез промежуточных таксадиеновых и таксадиеноновых соединений. Синтез родственных таксанова decinnamoyltaxinine E и taxabaccatin III был сообщен
Коммерческий полусинтез (компанией Bristol-Myers Squibb ) паклитаксела из 10-деацетилбаккатина III (выделенного из тиса европейского) основан на добавлении хвоста так называемого лактама Одзима к его свободной гидроксильной группе:
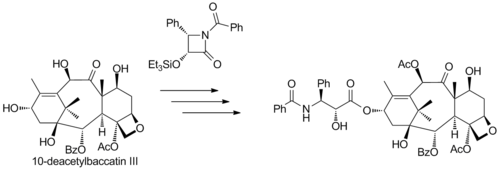 Полусинтез таксола из 10-деацетилбаккатина и (3 R, 4 S) -3-триэтилсиланилокси-4-фенил- N- Boc-2-азетидинона
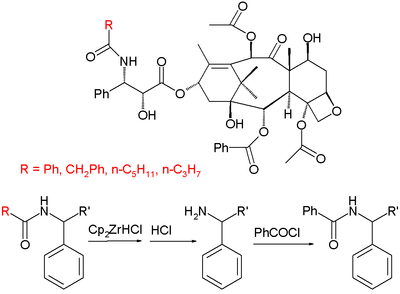
Полусинтез таксола из 10-деацетилбаккатина и (3 R, 4 S) -3-триэтилсиланилокси-4-фенил- N- Boc-2-азетидинона Другой коммерческий полусинтез (произведенный компанией Natural Pharmaceuticals) основан на выделении группы производных паклитаксела, выделенных из первичных декоративных таксанов. Эти производные имеют тот же скелет, что и паклитаксел, за исключением органического остатка R концевой амидной группы, который может быть фенилом, пропилом или пентилом (среди прочих), тогда как в паклитакселе это явная фенильная группа. Полусинтез состоит из превращения амидной группы в амин с реактивом Шварца через имин с последующей кислотной обработкой и бензоилированием.
В процессе производства тисы, выращенные в штате Мичиган, созревают через 8 лет, их периодически покрывают и сушат. Этот материал отправляется в Мексику для первой стадии экстракции (содержание паклитаксела 10%), а затем в Канаду для дальнейшей очистки до чистоты 95%. Полусинтез до конечного продукта происходит в Китае.

Путь биосинтеза паклитаксела был исследован и состоит примерно из 20 ферментативных стадий. Полная схема пока недоступна. Известные сегменты сильно отличаются от опробованных до сих пор синтетических путей ( схема 1). Исходное соединение является геранилгеранильным дифосфатом 2, который является димером гераниола 1. Это соединение уже содержит все необходимые 20 атомов углерода для скелета паклитаксела. Большее замыкание кольца через промежуточное соединение 3 ( таксадиен ) приводит к таксусину 4. Две основные причины, по которым этот тип синтеза невозможен в лаборатории, заключаются в том, что природа намного лучше справляется с управлением стереохимией и намного лучше активирует углеводородный скелет с кислородными заместителями, за которые цитохром P450 отвечает за некоторые из оксигенации. Промежуточное соединение 5 называется 10-деацетилбаккатин III.
Сообщалось о биохимическом производстве таксадиена в килограммах с использованием генно-инженерной E. coli в 2011 году.