 Маркер размера молекулярной массы в виде лестницы ДНК размером 1 т.п.н. в самой правой полосе, используемый в гель-электрофорезе. Условия геля: 1% агароза, 3 вольт / см и окраска бромистым этидием.
Маркер размера молекулярной массы в виде лестницы ДНК размером 1 т.п.н. в самой правой полосе, используемый в гель-электрофорезе. Условия геля: 1% агароза, 3 вольт / см и окраска бромистым этидием. Размер маркера молекулярной массы, также упоминается как белка лестница, ДНК лестница или РНК лестница, представляет собой набор стандартов, которые используются для определения приблизительной размер молекулы перспективы на гель во время электрофореза, используя принцип, что молекулярный вес обратно пропорционален скорости миграции через гелевую матрицу. Следовательно, при использовании в гель-электрофорезе маркеры эффективно обеспечивают логарифмическую шкалу для оценки размера других фрагментов (при условии, что размеры фрагментов маркера известны).
Белковые, ДНК и РНК-маркеры с заранее определенными размерами фрагментов и концентрациями коммерчески доступны. Их можно запускать как в агарозном, так и в полиакриламидном гелях. Маркеры загружаются в дорожки, прилегающие к дорожкам для отбора проб, до начала прогона.
 Электрофорезный гель с лестницами ДНК различной длины в левой и средней полосах. Размеры фрагментов указаны справа в парах оснований.
Электрофорезный гель с лестницами ДНК различной длины в левой и средней полосах. Размеры фрагментов указаны справа в парах оснований. Хотя концепция маркеров молекулярной массы сохранилась, методы разработки менялись на протяжении многих лет. Новые изобретения маркеров молекулярной массы распространяются в наборах, соответствующих типу маркера.
Первой проблемой при разработке маркеров было достижение высокого разрешения по всей длине маркера. В зависимости от условий проведения гель-электрофореза фрагменты могли быть сжаты, что нарушало четкость изображения. Для решения этой проблемы в 1990 году был разработан набор для Саузерн-блоттинга, который стал первым маркером, объединяющим ДНК-мишень и ДНК зонда. В этом методе использовалось преимущество логарифмического интервала, и его можно было использовать для идентификации целевых полос длиной более 20 000 нуклеотидов.
Существует два распространенных метода конструирования маркера размера молекулярной массы ДНК. В одном из таких методов используется техника частичного лигирования. Лигирование ДНК - это процесс, с помощью которого линейные части ДНК соединяются друг с другом ковалентными связями ; более конкретно, эти связи представляют собой фосфодиэфирные связи. Здесь фрагмент дуплексной ДНК размером 100 п.н. частично лигирован. Следствием этого является то, что образуются димеры 200 п.о., тримеры 300 п.о., тетрамеры 400 п.о., пентамеры 500 п.о. и т.д. Кроме того, останется часть дцДНК размером 100 п.н. В результате на геле создается «лестница» ДНК, состоящая из кусочков ДНК известной молекулярной массы.
Второй метод использует рестрикционные ферменты и узнаваемую последовательность ДНК. ДНК переваривается определенным рестрикционным ферментом, в результате чего образуются фрагменты ДНК различной молекулярной массы. Одним из преимуществ этого метода является то, что можно легко создать больше маркеров, просто переварив больше известной ДНК. С другой стороны, размер фрагментов ДНК зависит от участков, где рестрикционный фермент разрезает. Это затрудняет контроль размера фрагментов в маркере.
В последнее время в лабораториях используется другой метод конструирования маркеров размера молекулярной массы ДНК. Эта стратегия включает использование полимеразной цепной реакции (ПЦР). Это достигается одним или двумя способами: 1) ДНК-мишень амплифицируется одновременно с помощью наборов праймеров, или 2) различные ДНК-мишени амплифицируются независимо с помощью определенных праймеров.
Как и в случае с экспериментальными образцами, состояние геля может влиять на маркер размера молекулярной массы, который проходит рядом с ними. Такие факторы, как буфер, заряд / напряжение и концентрация геля, могут повлиять на подвижность и / или внешний вид вашего маркера / лестницы / стандарта. Эти элементы необходимо учитывать при выборе маркера и при анализе окончательных результатов на геле.
 1,2% агарозный гель, показывающий две разные лестницы ДНК, окрашенные красителем GelRed
1,2% агарозный гель, показывающий две разные лестницы ДНК, окрашенные красителем GelRed Раньше белковые маркеры разрабатывались с использованием различных цельных белков. Разработка набора, включающего маркер размера молекулярной массы на основе фрагментов белка, началась в 1993 году. Этот маркер белка, состоящий из 49 различных аминокислотных последовательностей, включал мультидоменные белки и позволял анализировать белки, расщепляемые на разных участках.
Современные технические усовершенствования белковых маркеров включают использование саморазвития. Первый саморазвивающийся белковый маркер с регулярным весом был изобретен в 2012 году.
Подобно ДНК-маркерам, эти маркеры обычно состоят из очищенных белков, молекулярные массы которых уже известны. В приведенном ниже списке указаны некоторые белки, а также молекулярная масса, которые обычно используются при конструировании белкового маркера.
 Иммуноблот с белковой лестницей в крайней левой полосе. Размеры фрагментов измеряются в кДа ( килодальтон ).
Иммуноблот с белковой лестницей в крайней левой полосе. Размеры фрагментов измеряются в кДа ( килодальтон ). | Протеин | Молекулярная масса ( кДа ) |
| Бета-галактозидаза | 120 |
| Фосфорилаза B | 94 |
| Альбумин бычьей сыворотки (BSA) | 67 |
| Овальбумин | 43 год |
| Альбумин индейки | 40 |
| Карбоангидраза | 30 |
| Ингибитор трипсина сои | 20,1 |
| а-лактальбумин | 14,4 |
| Лизоцим | 14 |
Маркеры размера молекулярной массы можно разделить на две категории: маркеры молекулярной массы и маркеры молекулярной лестницы. Маркеры бывают окрашенными или неокрашенными, и в зависимости от обстоятельств один может быть более подходящим, чем другой. Маркеры размера молекулярной массы также могут быть изменены биохимически. Конъюгация с биотином является наиболее распространенной. Маркеры размера молекулярной массы наиболее часто используются в электрофорезе в SDS-полиакриламидном геле и вестерн-блоттинге. При всех различных типах и использовании маркеров размера молекулярной массы важно выбрать соответствующий стандарт белка. Помимо наиболее распространенного использования в качестве способа расчета молекулярной массы образцов, другие применения включают предоставление визуальных свидетельств миграции и эффективности переноса белка, а иногда даже используются для положительного контроля.
Как и в случае с электрофорезом ДНК, при выборе белкового маркера следует учитывать такие условия, как буферность, заряд / напряжение и концентрация.
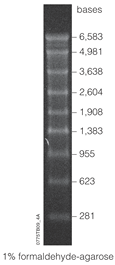 Полоса подвергнутого электрофорезу агарозного геля, показывающая лестницу РНК с полосами в диапазоне 281-6583 пар оснований
Полоса подвергнутого электрофорезу агарозного геля, показывающая лестницу РНК с полосами в диапазоне 281-6583 пар оснований Лестницы РНК, состоящие из маркеров размера молекулярной массы РНК, были первоначально разработаны с использованием метода синтетического круга для получения маркеров разного размера. Этот метод был усовершенствован изобретателем Эриком Т. Кулом для использования кольцевых ДНК- векторов в качестве метода получения маркеров размера молекулярной массы РНК. Так называемый метод катящегося круга, усовершенствования этого метода связаны с его эффективностью в синтезе олигонуклеотидов РНК. Из кольцевой ДНК-матрицы можно получить одноцепочечную РНК длиной от 4 до 1500 п.н. без необходимости использования праймеров и путем рециклирования нуклеотидтрифосфата. ДНК также можно синтезировать из круглого шаблона, что делает этот метод более универсальным. По сравнению с транскрипцией стока, метод синтетического круга дает олигонуклеотиды РНК без стока. По сравнению с ПЦР метод синтетических кругов позволяет получать олигонуклеотиды РНК без необходимости использования полимеразы или термоциклера. Этот метод также экономически эффективен, поскольку позволяет синтезировать большие количества продукта с меньшим количеством ошибок, чем машинные синтезаторы.
Маркеры РНК состоят из транскриптов РНК различной увеличивающейся длины. Например, Lonza 0.5-9 т.п.н. маркер имеет полосы маркировки 0,5, 1, 1,5, 2, 2,5, 3, 4, 5, 6, 9 и килобаза пар. Маркеры растворяются в буфере для хранения, таком как EDTA, и могут иметь срок годности до 2 лет при хранении при -80 ° C. Чтобы использовать маркер, например, для Нозерн-блот-анализа, его сначала размораживают, а затем окрашивают, чтобы его можно было обнаружить с помощью гель-электрофореза. Одним из наиболее распространенных красителей, используемых для маркеров, является бромистый этидий.
Диапазон конкретного маркера относится к множеству диапазонов, которые он может отображать. «Высокий» диапазон относится к относительно большим фрагментам (измеряется в п.о.), тогда как «низкий» диапазон относится к маркерам, которые различают небольшие фрагменты (измеряются в п.о.). Некоторые маркеры можно даже охарактеризовать как «ультранизкий диапазон», но еще более точным является маркер микроРНК. Маркер микроРНК можно использовать для измерения фрагментов РНК в пределах дюжины нуклеотидов, таких как маркер микроРНК 17-25 нуклеотидов.
При эквивалентной молекулярной массе РНК будет мигрировать быстрее, чем ДНК. Однако и РНК, и ДНК имеют отрицательный линейный наклон между расстоянием миграции и логарифмической молекулярной массой. То есть образцы меньшего веса могут перемещаться на большее расстояние. Это соотношение необходимо учитывать при выборе РНК или ДНК-маркеров в качестве стандарта.
При прогоне РНК-маркеров и образцов РНК на геле важно предотвратить загрязнение нуклеазами, поскольку РНК очень чувствительна к деградации рибонуклеазой (РНКазой) в результате катализа. Таким образом, необходимо учитывать все материалы, которые будут использоваться в процедуре. Любые изделия из стекла, который должен входить в контакт с РНК должны быть предварительно обработано с диэтилпирокарбонатом (DEPC) и пластмассовые материалы должны быть одноразовыми.
 SDS-PAGE гель с использованием стандарта размера молекулярной массы в левой внешней полосе
SDS-PAGE гель с использованием стандарта размера молекулярной массы в левой внешней полосе Одно из наиболее распространенных применений маркеров размера молекулярной массы - электрофорез в геле. Цель гель-электрофореза состоит в том, чтобы разделить белки по физическим или химическим свойствам, которые включают заряд, размер молекулы и pH. lt;При разделении по размеру идеальным методом является электрофорез в SDS-PAGE или полиакриламидном геле и маркеры размера молекулярной массы. соответствующие стандарты для использования.
Гели могут различаться по размеру. Подходящий размер геля будет зависеть от количества проб, подлежащих анализу. Все гели разделены на полосы, которые проходят через гель параллельно. Каждая дорожка будет содержать определенный образец. Обычно стандарты размера молекулярной массы размещаются на внешней дорожке. Если гель имеет особенно большое количество полосок, то для большей прозрачности можно разместить несколько лестниц поперек геля.
Белки и стандарты наносят пипеткой на гель в соответствующие дорожки. Додецилсульфат натрия (SDS) взаимодействует с белками, денатурируя их и придавая им отрицательный заряд. Поскольку все белки имеют одинаковое отношение заряда к массе, подвижность белка через гель будет зависеть исключительно от молекулярной массы. Как только электрическое поле будет включено, начнется миграция белка. По завершении можно использовать механизм обнаружения, такой как вестерн-блоттинг, который выявит наличие полос. Каждая полоса представляет определенный белок. Расстояние путешествия зависит исключительно от молекулярной массы; поэтому молекулярная масса каждого белка может быть определена путем сравнения расстояния между неизвестным белком и стандартом известной молекулярной массы.
Существует множество типов маркеров размера молекулярной массы, и каждый из них обладает уникальными характеристиками, что позволяет использовать их в ряде биологических методов. Выбор маркера размера молекулярной массы зависит от типа маркера (ДНК, РНК или белок) и предлагаемого диапазона длин (например, 1 килобайт). Прежде чем выбрать маркер размера молекулярной массы, важно ознакомиться с этими характеристиками и свойствами. В конкретном случае один тип может быть более подходящим, чем другой. Хотя конкретные маркеры могут различаться в разных протоколах для данной техники, в этом разделе будут описаны общие маркеры и их роли.
Первым типом молекулярных маркеров, разработанных и исследованных на гель-электрофорезе, были аллозимы. Эти маркеры используются для обнаружения изменений белка. Слово «аллозим» (также известное как «аллофермент») происходит от « аллельных вариантов ферментов ». При работе с гелем белки разделяются по размеру и заряду. Хотя аллозимы могут показаться устаревшими по сравнению с другими доступными маркерами, они все еще используются сегодня, в основном из-за их низкой стоимости. Одним из основных недостатков является то, что, поскольку доступно только ограниченное количество, специфичность является проблемой.
Хотя аллозимы могут обнаруживать вариации ДНК, это косвенный метод и не очень точный. Маркеры на основе ДНК были разработаны в 1960-х годах. Эти маркеры гораздо более эффективны при различении вариантов ДНК. Сегодня это наиболее часто используемые маркеры. Маркеры на основе ДНК работают, исследуя нуклеотиды, которые могут выполнять множество функций, таких как обнаружение различий в нуклеотидах или даже количественное определение количества мутаций.
Успех маркеров на основе ДНК привел к развитию ПЦР. ПЦР ( полимеразная цепная реакция ) - это метод амплификации ДНК, который можно применять к различным типам фрагментов. До этой разработки, чтобы амплифицировать ДНК, ее нужно было клонировать или изолировать. Вскоре после открытия ПЦР возникла идея использовать основанные на ПЦР маркеры для гель-электрофореза. Этот тип маркеров основан на праймерах ПЦР и классифицируется как полиморфизм последовательности ДНК.
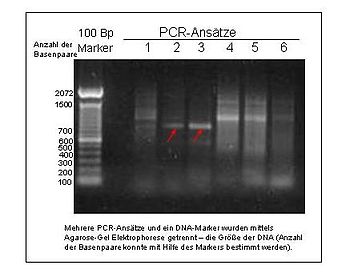 Электрофорезный гель с продуктами ПЦР. Самая левая полоса представляет собой лестницу ДНК с фрагментами с интервалами 100 п.н.
Электрофорезный гель с продуктами ПЦР. Самая левая полоса представляет собой лестницу ДНК с фрагментами с интервалами 100 п.н. Хотя технически говоря, полиморфизм последовательностей ДНК имеет место с момента использования RFLP в 1960-х годах, анализ значительно изменился с годами. Полиморфизм последовательности ДНК использует более старые методы, такие как RFLP, но в более крупном масштабе. Секвенирование происходит намного быстрее и эффективнее. Анализ автоматизирован, так как он использует метод, известный как секвенирование дробовика. Этот высокопроизводительный метод обычно используется в популяционной генетике.
Углеводные маркеры используются в методике, известной как анализ полисахаридов с помощью электрофореза в углеводном геле (PACE), который представляет собой измеримый метод разделения. Он позволяет анализировать продукты ферментативного гидролиза. Он использовался в таких приложениях, как характеристика ферментов, участвующих в разложении гемицеллюлозы, определение структуры полисахаридов гемицеллюлозы и анализ ферментативного расщепления целлюлозных продуктов.
PACE зависит от дериватизации, то есть превращения химического соединения в производное. Здесь интерес представляют моносахариды, олигосахариды и полисахариды. Они помечены на их восстанавливающих концах флуоресцентной меткой (т. Е. Флуорофором ). Эта дериватизация с помощью флуорофора позволяет как разделение на геле при желаемых условиях, так и получение изображения флуоресценции геля. В этом случае используется полиакриламидный гель.
Как и в случае электрофореза ДНК, РНК и белков, маркеры анализируются вместе с интересующими образцами при электрофорезе в углеводном геле. Маркеры состоят из олигосахаридов с известной молекулярной массой. Как и в образцах, представляющих интерес, маркер также derivitized с флуорофором ( как правило, с 8-амино - нафталин -1,3,6- trisulfonic кислоты (ANTS) или 2- aminoacridone ).