| Фруктозо-бисфосфат альдолаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Октамер фруктозо-бисфосфатальдолазы, человек Октамер фруктозо-бисфосфатальдолазы, человек | |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 4.1.2.13 | ||||||||
| № CAS | 9024-52-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
| Фруктозо-бисфосфатальдолаза I класса | |||||||||
|---|---|---|---|---|---|---|---|---|---|
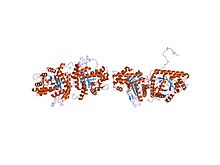 фруктозо-1,6-бисфосфатальдолаза из печени кролика фруктозо-1,6-бисфосфатальдолаза из печени кролика | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Гликолитический | ||||||||
| Pfam | PF00274 | ||||||||
| ИнтерПро | IPR000741 | ||||||||
| ПРОФИЛЬ | PDOC00143 | ||||||||
| SCOP2 | 1ald / SCOPe / SUPFAM | ||||||||
| CDD | cd00344 | ||||||||
| |||||||||
| Фруктозо-бисфосфатальдолаза II класса | |||||||||
|---|---|---|---|---|---|---|---|---|---|
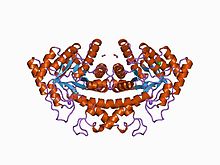 фруктозо-1,6-бисфосфатальдолаза класса II в комплексе с фосфогликологидроксаматом фруктозо-1,6-бисфосфатальдолаза класса II в комплексе с фосфогликологидроксаматом | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | F_bP_aldolase | ||||||||
| Pfam | PF01116 | ||||||||
| Клан пфам | CL0036 | ||||||||
| ИнтерПро | IPR000771 | ||||||||
| ПРОФИЛЬ | PDOC00523 | ||||||||
| SCOP2 | 1dos / SCOPe / SUPFAM | ||||||||
| CDD | cd00453 | ||||||||
| |||||||||
Альдолаза ( ЕС 4.1.2.13 ), часто просто альдолазы, является фермент, катализирующий на обратимую реакцию, которая расщепляет альдольное, фруктозо-1,6-дифосфата, в триозах фосфатов дигидроксиацетонфосфата (DHAP) и глицеральдегид - 3-фосфат (G3P). Альдолаза также может продуцировать DHAP из других (3S, 4R) - кетозо- 1-фосфатов, таких как фруктозо-1-фосфат и седогептулозо-1,7-бисфосфат. Глюконеогенез и цикл Кальвина, являющиеся анаболическими путями, используют обратную реакцию. Гликолиз, катаболический путь, использует прямую реакцию. Альдолаза делится на два класса по механизму.
Слово альдолаза также относится, в более общем смысле, к ферменту, который выполняет альдольную реакцию (создавая альдол ) или ее обратную (расщепляющую альдол), такому как альдолаза сиаловой кислоты, которая образует сиаловую кислоту. См. Список альдолаз.
Белки класса I образуют протонированное промежуточное основание Шиффа, связывающее высококонсервативный активный центр лизина с карбонильным углеродом DHAP. Кроме того, в этом механизме решающее значение имеют остатки тирозина, которые действуют как стабилизирующие акцепторы водорода. Белки класса II используют другой механизм, который поляризует карбонильную группу двухвалентным катионом, таким как Zn 2+. Кишечная палочка галацитолы оперон белки, gatY, и N-ацетил - галактозамин оперон белки, Agay, которые являются тагатоз-бисфосфатом альдолазами, являются гомологами из класса II альдолаза. Было показано, что два остатка гистидина в первой половине последовательности этих гомологов участвуют в связывании цинка.
В белковых субъединиц обоих классов, каждый имеют / amp; beta ; домен amp; alpha ; сложенную в бочке TIM, содержащей активный сайт. Несколько субъединиц собраны в полный белок. Эти два класса имеют небольшую идентичность последовательностей.
За некоторыми исключениями только белки класса I были обнаружены у животных, растений и зеленых водорослей. За некоторыми исключениями в грибах были обнаружены только белки класса II. Оба класса были широко обнаружены у других эукариот и бактерий. Эти два класса часто присутствуют вместе в одном организме. В дополнение к обычной цитозольной альдолазе растения и водоросли содержат пластидную альдолазу, иногда являющуюся пережитком эндосимбиоза. Бифункциональная фруктозо-бисфосфатальдолаза / фосфатаза с механизмом класса I была широко обнаружена у архей и некоторых бактерий. Активный центр этой архейной альдолазы также находится в стволе TIM.
Глюконеогенез и гликолиз разделяют серию из шести обратимых реакций. В процессе глюконеогенеза глицеральдегид-3-фосфат восстанавливается до фруктозо-1,6-бисфосфата с помощью альдолазы. При гликолизе 1,6-бисфосфат фруктозы превращается в глицеральдегид-3-фосфат и дигидроксиацетонфосфат с помощью альдолазы. Альдолаза, используемая в глюконеогенезе и гликолизе, представляет собой цитоплазматический белок.
Три формы класса I белка обнаружены в позвоночных. Альдолаза А преимущественно экспрессируется в мышцах и головном мозге; альдолаза B в печени, почках и энтероцитах ; и альдолаза C в головном мозге. Альдолазы A и C в основном участвуют в гликолизе, тогда как альдолаза B участвует как в гликолизе, так и в глюконеогенезе. Некоторые дефекты альдолазы B вызывают наследственную непереносимость фруктозы. Метаболизм свободной фруктозы в печени основан на способности альдолазы B использовать фруктозо-1-фосфат в качестве субстрата. Предположительно, архейная фруктозо-бисфосфатальдолаза / фосфатаза участвует в глюконеогенезе, поскольку ее продуктом является фруктозо-6-фосфат.
Цикл Кальвина - это путь фиксации углерода ; это часть фотосинтеза, который преобразует углекислый газ и другие соединения в глюкозу. Он и глюконеогенез разделяют серию из четырех обратимых реакций. В обоих путях 3-фосфоглицерат (3-PGA или 3-PG) восстанавливается до фруктозо-1,6-бисфосфата с альдолазой, катализирующей последнюю реакцию. Пятая реакция, катализируемая обоими путями фруктозо-1,6-бисфосфатазой, гидролизует фруктозо-1-6-бисфосфат до фруктозо-6-фосфата и неорганического фосфата. Сильное уменьшение свободной энергии делает эту реакцию необратимой. В цикле Кальвина альдолаза также катализирует производство 1,7-бисфосфата седогептулозы из DHAP и эритрозо-4-фосфата. Основными продуктами цикла Кальвина являются триозофосфат (TP), который представляет собой смесь DHAP и G3P, и фруктозо-6-фосфат. Оба они также необходимы для регенерации RuBP. Альдолаза, используемая растениями и водорослями в цикле Кальвина, обычно представляет собой нацеленный на пластиды белок, кодируемый ядерным геном.
Альдолаза катализирует
а также
Альдолаза используется в обратимом стволе глюконеогенеза / гликолиза.
Альдолаза также используется в части цикла Кальвина, общей с глюконеогенезом, с необратимым гидролизом фосфата в конце, катализируемым фруктозо-1,6-бисфосфатазой.
В глюконеогенезе 3-PG продуцируется энолазой и фосфоглицератмутазой, действующими последовательно.
В цикле Кальвина 3-PG производится RuBisCO.
G3P продуцируется фосфоглицераткиназой, действующей последовательно с глицеральдегид-3-фосфатдегидрогеназой (GAPDH) в глюконеогенезе и последовательно с глицеральдегид-3-фосфатдегидрогеназой (NADP +) (фосфорилируя) в цикле Кальвина.
Триозофосфатизомераза поддерживает DHAP и G3P в почти равновесном состоянии, образуя смесь, называемую триозофосфатом (TP).
Таким образом, и DHAP, и G3P доступны для альдолазы.
Альдолаза также участвует во многих «подрабатывающих» или некаталитических функциях, основываясь на ее сродстве связывания с множеством других белков, включая F-актин, α-тубулин, динеин легкой цепи, WASP, анионообменник Band 3, фосфолипазу D ( PLD2 )., глюкоза транспортер GLUT4, инозитолтрифосфат, V-АТФаза и ARNO (а гуаниннуклеотид обмен фактор в ARF6 ). Считается, что эти ассоциации преимущественно участвуют в клеточной структуре, однако их участие в эндоцитозе, инвазии паразитов, перестройке цитоскелета, подвижности клеток, переносе и рециклинге мембранных белков, трансдукции сигналов и компартментализации тканей было исследовано.
|
|---|
 АТФ ADP АТФ ADP   АТФ ADP АТФ ADP   + +  Глицеральдегид-3- фосфатдегидрогеназа НАД + + P i НАДН + Н + ADP АТФ ADP АТФ 2 × 3-фосфоглицерат 2 × 2 × 2-фосфоглицерат 2 × Phosphopyruvate гидратаз ( енолаз ) H 2 O2 × Фосфоенолпируват 2 × ADP АТФ ADP АТФ 2 × Пируват 2 × |