| Цилиндр TIM альдолазного типа | |
|---|---|
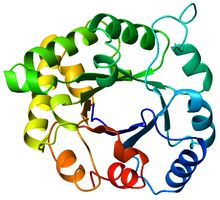 Цилиндр триозофосфатизомеразы (TIM), вид сверху (PDB : 8TIM ), цвет от синего (N-конец) до красного (C-конец). Цилиндр триозофосфатизомеразы (TIM), вид сверху (PDB : 8TIM ), цвет от синего (N-конец) до красного (C-конец). | |
| Идентификаторы | |
| Symbol | Aldolase_TIM |
| Pfam клан | CL0036 |
| InterPro | IPR013785 |
| CATH | 8tim |
| SCOPe | 8tim / SUPFAM |
The TIM баррель, также известная как α / β цилиндр, представляет собой консервативную белковую складку, состоящую из восьми α-спиралей и восьми параллельных β-нити, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента . Цилиндры ТИМ встречаются повсеместно, примерно 10% всех ферментов принимают эту складку. Кроме того, 5 из 7 классов ферментов комиссии по ферментам (ЕС) включают бочковые белки TIM. Бочкообразная складка ТИМ является эволюционно древней, и многие ее элементы сегодня обладают незначительным сходством, вместо этого они попадают в сумеречную зону сходства последовательностей.
Внутренняя β-бочка во многих случаях стабилизирована запутанными сетками солевых мостиков. Петли на C-концевых концах β-цилиндра отвечают за каталитическую активность, в то время как N-концевые петли важны для устойчивость ТИМ-стволов. Структурные вставки в диапазоне от расширенных петель до независимых доменов могут быть вставлены вместо этих петель или на N / C-концах. Бочки TIM, по-видимому, эволюционировали в результате событий дупликации гена и слияния доменов белков-полубаррелей, при этом большинство бочек TIM произошло от общего предка. Это привело к тому, что многие стволы TIM обладают внутренней симметрией. Дальнейшие события дупликации генов этого предкового ствола TIM приводят к расхождению ферментов, обладающих функциональным разнообразием, наблюдаемым сегодня. Цилиндры TIM также были давней мишенью для разработчиков белков. Успешные конструкции цилиндров TIM включают как домены слияния существующих белков, так и конструкции de novo. Эксперименты по слиянию доменов привели к множеству успешных дизайнов, в то время как проекты de novo дали успех только после 28 лет постепенной разработки.
 Триозофосфатизомераза (TIM) выделена из куриные мышцы (PDB : 1TIM ), архетипический бочкообразный фермент TIM. (A) Мультяшное изображение конструкции ствола TIM. α-спирали окрашены в бирюзовый цвет, β-нити - в оранжевый, а петли - в зеленый. Обратите внимание, что С-концевые концы β-тяжей обозначены стрелками. (B) Основные и поровые области выделены. Аминокислотные остатки, принадлежащие поре, окрашены в синий цвет. Аминокислотные остатки ядра окрашены в оранжевый цвет. Обратите внимание, что цилиндр TIM изображен сверху вниз, где С-концевые концы β-цилиндра направлены в сторону считывающего устройства.
Триозофосфатизомераза (TIM) выделена из куриные мышцы (PDB : 1TIM ), архетипический бочкообразный фермент TIM. (A) Мультяшное изображение конструкции ствола TIM. α-спирали окрашены в бирюзовый цвет, β-нити - в оранжевый, а петли - в зеленый. Обратите внимание, что С-концевые концы β-тяжей обозначены стрелками. (B) Основные и поровые области выделены. Аминокислотные остатки, принадлежащие поре, окрашены в синий цвет. Аминокислотные остатки ядра окрашены в оранжевый цвет. Обратите внимание, что цилиндр TIM изображен сверху вниз, где С-концевые концы β-цилиндра направлены в сторону считывающего устройства.  Топология цилиндра TIM. α-спирали окрашены в голубой цвет, петли - в окрашены в зеленый цвет, а β-нити - в два оттенка оранжевого. Более светлые оттенки указывают на остатки, направленные внутрь, к поре ствола. Более темные оттенки указывают на остатки, направленные наружу, к сердцевине ствола. Голубые линии изображают пример цепи водородных связей β-цилиндра основной цепи. Обратите внимание, что сети водородных связей боковых цепей здесь не изображены. Внутренние β-цилиндрические остатки (поровые остатки) демонстрируют 4-х кратную геометрическую симметрию, несмотря на то, что выходят из 8-ми нитевого β-цилиндра. Эта симметрия проиллюстрирована двумя примерными «слоями» красным и синим. Каждый слой содержит 4 остатка, которые указывают на поры и лежат в одной плоскости, перпендикулярной оси ствола. Число сдвига для стволов TIM всегда равно 8 и показано пурпурным цветом. Некоторые стволы TIM естественным образом принимают или спроектированы с учетом двух- или четырехсторонней симметрии. Также выделены примеры асимметричных единиц. Этот рисунок был адаптирован с разрешения из ранее опубликованной работы.
Топология цилиндра TIM. α-спирали окрашены в голубой цвет, петли - в окрашены в зеленый цвет, а β-нити - в два оттенка оранжевого. Более светлые оттенки указывают на остатки, направленные внутрь, к поре ствола. Более темные оттенки указывают на остатки, направленные наружу, к сердцевине ствола. Голубые линии изображают пример цепи водородных связей β-цилиндра основной цепи. Обратите внимание, что сети водородных связей боковых цепей здесь не изображены. Внутренние β-цилиндрические остатки (поровые остатки) демонстрируют 4-х кратную геометрическую симметрию, несмотря на то, что выходят из 8-ми нитевого β-цилиндра. Эта симметрия проиллюстрирована двумя примерными «слоями» красным и синим. Каждый слой содержит 4 остатка, которые указывают на поры и лежат в одной плоскости, перпендикулярной оси ствола. Число сдвига для стволов TIM всегда равно 8 и показано пурпурным цветом. Некоторые стволы TIM естественным образом принимают или спроектированы с учетом двух- или четырехсторонней симметрии. Также выделены примеры асимметричных единиц. Этот рисунок был адаптирован с разрешения из ранее опубликованной работы. Цилиндр TIM получил свое название от фермента триозофосфат-изомеразы (TIM), который был первым белком, имеющим складку, который должен был кристаллизоваться. Цилиндры TIM содержат 200-250 аминокислотных остатков, свернутых в 8 α-спиралей и 8 β-цепей. Β-тяжи расположены в параллельном β-цилиндре и окружены 8 α-спиралями. Определяющим свойством β-цилиндров TIM является то, что они всегда обладают числом сдвига, равным 8. Число сдвига определяется путем выделения остатка x на β-нити-1 и движения вдоль β-цилиндра в перпендикулярном направлении к направления нитей, пока не будет достигнут остаток y на исходной β-цепи-1. Количество остатков между начальным и конечным положениями (| y-x |) является числом сдвига. Поскольку количество нитей равно числу сдвига, боковые цепи поочередно направлены к поре и сердцевине, создавая 4-х кратную симметрию. Α-спирали окружают и полностью закрывают внутренний β-цилиндр. Короткие петли обычно соединяют вторичные структуры α и β, образуя топологию (βα) 8 повторов. В некоторых случаях структуры от расширенных петель до независимых доменов могут быть вставлены вместо этих петель или могут быть присоединены к N / C-концам. Все ферменты TIM-цилиндра обладают каталитическими сайтами на С-конце β-цилиндра, и структурные вставки, присутствующие рядом с этим концом, могут способствовать каталитической активности.
Цилиндры TIM содержат две отдельные скрытые области, в которых аминокислотные остатки полностью окружены своими соседями и не имеют доступа к растворителю. Термин «пора» используется неправильно, поскольку в этой области нет каналов для растворителя. Центральная область состоит из всех остатков, составляющих интерфейс α-β, и находится вне центральной β-бочки. Область пор состоит из всех внутренних остатков β-цилиндра, которые окружены и заключены в основу цепи β-цилиндра.
Из-за гофрированной природы β-тяжей альтернативные остатки вдоль нити почти равномерно разделены между порами (53%) и ядром (47%). Для β-стволов 95% остатков керна захоронены. Только 11% их ядерных остатков являются полярными, обладают сродством к воде и обладают способностью образовывать водородные связи или солевые мостики. Точно так же 84% остатков пор β-нити захоронены. Однако 42% их поровых остатков полярны. Эти остатки образуют сложные сети солевых мостиков, чтобы компенсировать отсутствие доступа к растворителям.
 Пример солевой мостиковой сети в 2-дезоксирибозо-5-фосфатальдолазе (PDB : 1P1X ). Взаимодействия показаны голубыми пунктирными линиями. Полярные остатки окрашены в зеленый цвет. Здесь показаны полярные аминокислоты аспартат (D), глутамат (E), лизин (K) и аргинин (R).
Пример солевой мостиковой сети в 2-дезоксирибозо-5-фосфатальдолазе (PDB : 1P1X ). Взаимодействия показаны голубыми пунктирными линиями. Полярные остатки окрашены в зеленый цвет. Здесь показаны полярные аминокислоты аспартат (D), глутамат (E), лизин (K) и аргинин (R). Солевые мостики в порах ствола TIM, как полагают, вносят вклад в общую стабильность сложить. Пример большой сети солевых мостиков можно найти в 2-дезоксирибозо-5-фосфатальдолазе. Было обнаружено, что эта сеть сохраняется в семействе альдолаз класса I.
Точная причина чрезмерной представленности полярных остатков и солевых мостиков в поре остается неясной. Одно исследование предполагает, что они улучшают складываемость, а не термодинамическую стабильность стволов TIM. Во время процесса складывания остатки внутренних пор на β-нитях будут подвергаться воздействию воды. Частично свернутые модули βαβα, называемые фолдонами, должны быть энергетически стабилизированы полярными остатками пор во время этой стадии сворачивания.
В другом исследовании с участием бочкообразного белка TIM индол-3-глицеринфосфатсинтазы индол-3-глицеринфосфатсинтазы S. solfataricus консервативный модуль βαβαβ оказался важным шаблоном сворачивания, который управлял сворачиванием других второстепенные конструкции. Закрытие β-ствола происходило только в конце процесса складывания. Однако в этом случае авторы приписали разветвленные алифатические аминокислоты (валин, лейцин и изолейцин) в стабильности фолдона.
Еще одним стабилизирующим элементом в стволах TIM является зажим β-шпильки. Доноры Н-связи боковой цепи на N-концах β-цепей с четными номерами часто образуют Н-связи с атомами водорода амидов основной цепи в предшествующих β-цепях с нечетными номерами. Эти зажимы (или аналоги гидрофобных мостиков боковой цепи) законсервированы в ортологах ствола TIM 3 индол-3-глицеринфосфатсинтазы из царства бактерий и архей, что означает, что они возникли в их последнем общем предке и сохранялись более миллиарда лет.
 Примеры структурных вставок в цилиндрической петле TIM и N / C-концевых областях. (A) Bacillus subtilis Оротидин-5'-монофосфатдекарбоксилаза (PDB : 1DBT ). 5'-монофосфат оротидина имеет зеленый цвет. α-спиральные вставки окрашены в голубой цвет. Каталитический остаток аргинина (R215) отображается в виде палочек. (B) Бифункциональная изомераза биосинтеза гистидина / триптофана (PriA) Mycobacterium tuberculosis (PDB : 2Y85 ). CdRP, продукт реакции TrpF, окрашен в зеленый цвет. Взаимозаменяемые структуры β-нитей / петель окрашены в оранжевый цвет. (C) Дигидрооротатдегидрогеназа A Lactococcus lactis (DHODA) (PDB : 2DOR ). β-тяжи, образующие лист, окрашены в оранжевый цвет. Расширенные петли окрашены в зеленый цвет. Полость, образованная этими структурами, отображается в виде синей сетки. Продукт оротат окрашен в пурпурный цвет. кофактор FMN окрашен в розовый цвет. (D) Триметиламиндегидрогеназа Methylophilus methylotrophus (PDB : 2TMD ). Складчатая область Россмана окрашена в соответствии с вторичными структурными элементами. Кофактор FMN окрашен в пурпурный цвет. [4Fe-4S] окрашен в красный цвет. Обратите внимание, что субстрат / продукт не были кристаллизованы.
Примеры структурных вставок в цилиндрической петле TIM и N / C-концевых областях. (A) Bacillus subtilis Оротидин-5'-монофосфатдекарбоксилаза (PDB : 1DBT ). 5'-монофосфат оротидина имеет зеленый цвет. α-спиральные вставки окрашены в голубой цвет. Каталитический остаток аргинина (R215) отображается в виде палочек. (B) Бифункциональная изомераза биосинтеза гистидина / триптофана (PriA) Mycobacterium tuberculosis (PDB : 2Y85 ). CdRP, продукт реакции TrpF, окрашен в зеленый цвет. Взаимозаменяемые структуры β-нитей / петель окрашены в оранжевый цвет. (C) Дигидрооротатдегидрогеназа A Lactococcus lactis (DHODA) (PDB : 2DOR ). β-тяжи, образующие лист, окрашены в оранжевый цвет. Расширенные петли окрашены в зеленый цвет. Полость, образованная этими структурами, отображается в виде синей сетки. Продукт оротат окрашен в пурпурный цвет. кофактор FMN окрашен в розовый цвет. (D) Триметиламиндегидрогеназа Methylophilus methylotrophus (PDB : 2TMD ). Складчатая область Россмана окрашена в соответствии с вторичными структурными элементами. Кофактор FMN окрашен в пурпурный цвет. [4Fe-4S] окрашен в красный цвет. Обратите внимание, что субстрат / продукт не были кристаллизованы. N / C-концевые и петлевые области на бочках TIM могут содержать структурные вставки в диапазоне от простых вторичных структурных мотивов до полных доменов. Эти домены способствуют распознаванию субстрата и каталитической активности. Ниже обсуждаются четыре различных примера цилиндров TIM, содержащих дополнительные мотивы и домены.
Bacillus subtilis Оротидин-5'-фосфатдекарбоксилаза (PDB : 1DBT ) представляет собой бочкообразный белок TIM, имеющий 4 α-спирали на месте петель βα обычно присутствует на С-конце β-ствола (остатки 35-42, 89-91, 126-133 и 215-219). Одна из этих спиралей (R215 → K219) содержит консервативный остаток аргинина (R215), необходимый для взаимодействия с фосфатным фрагментом на оротидин-5'-монофосфате. Было обнаружено, что другие спирали не содержат остатков, критических для каталитической активности, и могут выполнять структурные роли.
Бифункциональная изомераза биосинтеза гистидина / триптофана Mycobacterium tuberculosis (PriA) (PDB : 2Y85 ) обладает способностью катализировать две реакции: (i) реакция HisA: превращение N - [(5-фосфорибозил) формимино] -5-аминоимидазол-4-карбоксамидрибонуклеотида (ProFAR) в N - [(5-фосфорибулозил) формино] -5-аминоимидазол-4-карбоксамидрибонуклеотид (PRFAR), и ( ii) Реакция TrpF: N- (5'-фосфорибозил) антранилат (PRA) в 1- (O-карбоксифениламино) -1'-дезоксирибулозо-5'-фосфат (CdRP). PriA представляет собой фермент в форме цилиндра TIM, который вмещает оба субстрата с помощью петель активного сайта (петли 1, 5 и 6, удлиненные петли βα на С-конце β-цилиндра), которые изменяют конформацию в зависимости от присутствующего реагента. Петля 1 охватывает активный сайт только в присутствии ProFAR. Loop5 оборачивается вокруг активного сайта, принимая конформацию β-листа в присутствии CdRP или узловую конформацию в присутствии ProFAR. Петля 6 охватывает активный центр для всех реагентов.
Lactococcus lactis Дигидрооротатдегидрогеназа A (DHODA) (PDB : 2DOR ) является примером ствола TIM, содержащего β-листы и расширенные петли на С-конце β-цилиндра. DHODA катализирует окисление дигидрооротата до оротата, который является частью пути синтеза уридин-5'-монофосфата (UMP) de novo. Это окисление опосредуется флавинмононуклеотидом (FMN). Здесь β-листы и расширенные петли окружают активный центр, формируя полость, а также содержат несколько каталитических остатков.
Цилиндр TIM Methylophilus methylotrophus триметиламиндегидрогеназа (PDB : 2TMD ) является примером полной вставки домена. Здесь домен складки Россмана вставлен на С-конце TIM-ствола. Триметиламиндегидрогеназа катализирует превращение триметиламина в формальдегид. Для этой реакции требуются как восстановленный кофактор мононуклеотида 6-S-цистеинилфлавина (FMN), так и восстановленный центр железо-сера ([4Fe-4S]). FMN ковалентно связан в C-концевой области β-ствола. Центр [4Fe-4S] слишком велик для размещения внутри цилиндра TIM, и вместо этого расположен в непосредственной близости, на расстоянии 7 Å, на границе раздела между цилиндром TIM и доменами складки Россмана.
Консервация стволовой складки TIM отражается в сохранении ее равновесных и кинетических механизмов складывания у бактериальных паралогов с филогенетически отличными клонами. Химическая денатурация нескольких природных и двух разработанных вариантов ствола TIM неизменно включает высоконаселенный промежуточный продукт равновесия. Кинетические интермедиаты, которые появляются после разбавления из сильно денатурирующих растворов, включают в себя ранние неправильно свернутые виды, которые должны по крайней мере частично разворачиваться, чтобы получить доступ к продуктивному пути складывания. Ограничивающим скорость этапом сворачивания является закрытие 8-ми нитевого β-ствола, при этом предшествующая форма открытого ствола соответствует равновесному промежуточному продукту. Моделирование молекулярной динамики, ориентированное на нативных людей, резюмирует экспериментальные результаты и указывает путь к тестируемым вычислительным моделям для сложных механизмов сворачивания.
Бочкообразные белки TIM обладают необычно высокой пластичностью последовательностей, формируя большие семейства ортологичных и паралоговых ферментов у широко расходящихся организмов. Эта пластичность предполагает ландшафт последовательностей, который позволяет адаптировать белок к множеству условий окружающей среды, в значительной степени независимо от филогенетической истории, при сохранении функции. Подход с глубоким мутационным сканированием и конкурентный анализ использовали для определения пригодности всех возможных аминокислотных мутантов по положениям в 3-х гипертермофильных ферментах TIM-бочонка индол-3-глицеринфосфатсинтазы (IGPS) для поддержки роста дрожжевого хозяина, лишенного IGPS. Хотя 2 бактериальных и 1 архейный фермент IGPS были только на 30-40% идентичны по последовательности, их пригодность сильно коррелировала: одни и те же аминокислоты в одних и тех же положениях в трех разных белках имели очень похожую приспособленность. Корреляцию можно рассматривать как сохранение ландшафта приспособленности для фермента ствола TIM в течение эволюционного времени.
Из примерно 200 остатков, необходимых для полного формирования ствола TIM, около 160 считаются структурно эквивалентными для разных белков, разделяющих эту складку. Остальные остатки расположены на участках петель, которые связывают спирали и нити; петли на C-концевом конце цепей, как правило, содержат активный сайт, что является одной из причин, по которой эта складка настолько распространена: остатки, необходимые для сохранения структуры, и остатки Этот эффект ферментативного катализа по большей части представляют собой отдельные подмножества: связывающие петли могут быть настолько длинными, что содержат другие белковые домены. Недавно было продемонстрировано, что каталитические петли могут обмениваться между различными ферментами TIM-бочки в качестве полуавтономных единиц функциональных групп.
 Координатная диаграмма реакции для SsIGPS при pH 7,8 и 25 ° C. Реакция рефолдинга начинается в развернутом состоянии U, первоначально неправильно свертывается в промежуточное состояние I BP, частично разворачивается для достижения промежуточного состояния I A, преобразование которого в последующее I Промежуточное состояние B ограничивает скорость. Конечным этапом является преобразование I B в нативное состояние N. Кинетические промежуточные соединения I A и I B соответствуют промежуточному соединению, наблюдаемому при равновесном разворачивании. исследования. Ордината представляет свободную энергию каждого состояния в механизме реакции сворачивания в ккал / моль. Абсцисса представляет собой зависимость разницы в свободной энергии между двумя состояниями от концентрации денатуранта и пропорциональна изменению скрытой поверхности по отношению к U-состоянию. Механизм кинетического сворачивания, иллюстрирующий поток развернутого белка в нативную конформацию, показан под диаграммой координат реакции.
Координатная диаграмма реакции для SsIGPS при pH 7,8 и 25 ° C. Реакция рефолдинга начинается в развернутом состоянии U, первоначально неправильно свертывается в промежуточное состояние I BP, частично разворачивается для достижения промежуточного состояния I A, преобразование которого в последующее I Промежуточное состояние B ограничивает скорость. Конечным этапом является преобразование I B в нативное состояние N. Кинетические промежуточные соединения I A и I B соответствуют промежуточному соединению, наблюдаемому при равновесном разворачивании. исследования. Ордината представляет свободную энергию каждого состояния в механизме реакции сворачивания в ккал / моль. Абсцисса представляет собой зависимость разницы в свободной энергии между двумя состояниями от концентрации денатуранта и пропорциональна изменению скрытой поверхности по отношению к U-состоянию. Механизм кинетического сворачивания, иллюстрирующий поток развернутого белка в нативную конформацию, показан под диаграммой координат реакции.  Экспериментально полученные ландшафты приспособленности, картированные на основе точечных мутаций, представляют отдельные шаги из последовательности WT. Несмотря на значительное расхождение WT в пространстве последовательностей, ландшафты приспособленности ортологов IGPS остаются коррелированными (пунктирные линии). В отличие от традиционных двумерных тепловых карт, значения пригодности отображаются на трехмерной вертушке, выделяя широкий спектр возможных эффектов пригодности для одного шага последовательности. Профили вертушек похожи, что указывает на корреляцию ландшафтов пригодности, даже если последовательности WT (центры колес) идентичны и сильно разнесены только на 40%. Анализ главных компонентов демонстрирует корреляцию между экспериментальными ландшафтами приспособленности и аминокислотными предпочтениями в эволюционировавших последовательностях.
Экспериментально полученные ландшафты приспособленности, картированные на основе точечных мутаций, представляют отдельные шаги из последовательности WT. Несмотря на значительное расхождение WT в пространстве последовательностей, ландшафты приспособленности ортологов IGPS остаются коррелированными (пунктирные линии). В отличие от традиционных двумерных тепловых карт, значения пригодности отображаются на трехмерной вертушке, выделяя широкий спектр возможных эффектов пригодности для одного шага последовательности. Профили вертушек похожи, что указывает на корреляцию ландшафтов пригодности, даже если последовательности WT (центры колес) идентичны и сильно разнесены только на 40%. Анализ главных компонентов демонстрирует корреляцию между экспериментальными ландшафтами приспособленности и аминокислотными предпочтениями в эволюционировавших последовательностях. Преобладающая теория эволюции ствола TIM включает дупликацию и слияние генов, начиная с полубочки, которая в конечном итоге формирует полный ствол TIM. Множественные исследования подтверждают теорию дивергентной эволюции от одного предка и обсуждаются ниже.
В начале 1990-х годов было отмечено, что все решенные в то время бочкообразные структуры TIM были ферментами, что указывает на отклонение от общего предка. Кроме того, все цилиндры TIM обладают активными сайтами на С-конце β-цилиндров. предположили, что общий сайт связывания фосфата, образованный маленькой α-спиралью и цилиндрическими петлями TIM-7/8, сильно указывает на дивергентную эволюцию. Дальнейшие исследования этих фосфатных групп привели к заключению, что 12 из 23 семейств стволов SCOP TIM произошли от общего предка. Точно так же были намеки на общее происхождение 17 из 21 семейства стволов CATH TIM. На основании этих сообщений считается правдоподобным, что большинство стволовых белков TIM произошли от общего предка.
 Модель эволюции стволов TIM посредством дупликации генов и слияния доменов, предложенная Lang et al. Эта модель описывает эволюцию ферментов HisA и HisF пути биосинтеза гистидина. Предполагается, что произошло два этапа дупликации гена. Первая дупликация гена привела к образованию двух полубаррелей, которые позже слились и превратились в предковую бочку ТИМ. Второе событие дупликации генов привело к диверсификации и эволюции различных бочкообразных ферментов TIM, катализирующих различные реакции.
Модель эволюции стволов TIM посредством дупликации генов и слияния доменов, предложенная Lang et al. Эта модель описывает эволюцию ферментов HisA и HisF пути биосинтеза гистидина. Предполагается, что произошло два этапа дупликации гена. Первая дупликация гена привела к образованию двух полубаррелей, которые позже слились и превратились в предковую бочку ТИМ. Второе событие дупликации генов привело к диверсификации и эволюции различных бочкообразных ферментов TIM, катализирующих различные реакции. Многие бочкообразные белки TIM обладают 2-кратной, 4-кратной или 8-кратной внутренней симметрией, что позволяет предположить, что стволы TIM произошли от предков (βα) 4, (βα) 2 или βα мотивы посредством дупликации гена и слияния доменов. Хороший пример 2-кратной внутренней симметрии наблюдается у ферментов ProFAR-изомераза (HisA) и имидазолглицеринфосфатсинтаза (HisF) пути биосинтеза гистидина Thermotoga maritima. Они катализируют 2 последовательные реакции в пути, обладают 25% -ной гомологией последовательностей и обладают среднеквадратичными отклонениями (RMSD) в пределах 1,5-2 Å, что свидетельствует о расхождении от общего предка. Что еще интереснее, петли на С-концевых концах HisA и HisF обнаруживают двойной повторяющийся паттерн, указывая тем самым, что их общий предок также обладал 2-кратной внутренней симметрией. На основе этих наблюдений была построена модель эволюции стволов TIM. У предкового полубочки произошла бы дупликация и слияние генов, что привело бы к единственному белку, содержащему два полубочковых домена. Структурные адаптации могли бы произойти, приводя к слиянию этих доменов с образованием закрытого β-ствола и формированию предкового ствола TIM. Функциональные адаптации также должны были произойти, что привело бы к развитию новой каталитической активности на С-конце β-цилиндра. На этом этапе общий предок HisA и HisF претерпел бы второе событие дупликации гена. Дивергентная эволюция дуплицированных генов предкового ствола TIM могла бы привести к образованию HisA и HisF.
Интересно, что эта эволюционная модель была экспериментально подтверждена с использованием рационального дизайна белка и направленной эволюции. Höcker et al. сначала слили две С-концевые половины HisF, получив HisF-CC. Затем эта конструкция была стабилизирована путем вставки внутреннего солевого мостика, что дало HisF-C * C. Дальнейшая ступенчатая стабилизация и солюбилизация HisF-C * C была достигнута за счет оптимизации границы раздела полубарабана, генерируя HisF-C ** C и HisF-C *** C, соответственно. Кристаллическая структура HisF-C *** C выявила 2-кратно симметричный цилиндр ТИМ, что подтверждает возможность слияния естественных доменов. Более того, Höcker создал первые химерные стволы HisAF и HisFA TIM, используя полубочки HisA и HisF. Эти эксперименты привели к предложению нового средства диверсификации и эволюции ферментов TIM-бочки за счет обмена (βα) 4 полубаррочных доменов среди уже существующих TIM-бочек. В соответствии с этой идеей установлена высокая каталитическая активность конструкции HisAF. Точно так же были созданы химерные βα 5 -флаводоксин-подобные стволы (CheY) / HisF TIM-стволы и идеально 2-кратно симметричные TIM-стволы на основе HisF.
Существование 4/8-кратной внутренней симметрии было предположено на основании вычислительного анализа последовательностей стволов TIM. Например, предполагается, что Escherichia coli KDPG альдолаза (PDB : 1FQ0 ) обладает четкой 4-кратной симметрией с заметной 8-кратной симметрией. Конструкция ствола с 4-кратной симметрией TIM подтвердила возможность более высоких порядков внутренней симметрии в естественных стволах TIM и будет подробно обсуждена в следующем разделе. На сегодняшний день не поступало никаких экспериментальных доказательств существования 8-кратно симметричных стволов TIM.
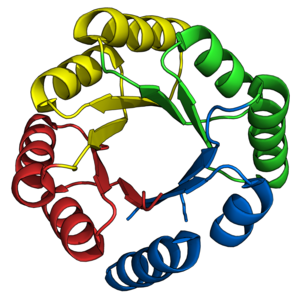 sTIM-11, первая успешная конструкция ствола TIM de novo. Асимметричные (αβ) 2 элементы четко окрашены, подчеркивая внутреннее 4-кратная симметрия.
sTIM-11, первая успешная конструкция ствола TIM de novo. Асимметричные (αβ) 2 элементы четко окрашены, подчеркивая внутреннее 4-кратная симметрия. Бочкообразная складка TIM была давней мишенью для de novo разработчиков белков. Как описано ранее, многочисленные стволы TIM были успешно спроектированы на основе уже существующих естественных полубочков. Напротив, разработка цилиндров TIM de novo происходила постепенно в течение 28 лет.
Серия белков октареллина (Octarellin I → VI) была первой попыткой создания цилиндров de novo TIM. Поскольку область дизайна белков все еще находилась в зачаточном состоянии, эти попытки дизайна имели лишь ограниченный успех. Хотя они демонстрировали спектры кругового дихроизма, согласующиеся с белками αβ и некоторыми характеристиками кооперативного фолдинга, все пептиды серии Octarellin были нерастворимы, и их нужно было реолюбилизировать из телец включения для дальнейшей характеристики. Интересно, что Octarellin V.1 демонстрирует Rossmann -подобную складку в условиях сокристалла.
Серия белков симметрина (Симметрин-1 → 4) показала более благоприятные биофизические характеристики. Симметрин-1 был легко растворим, демонстрировал спектр кругового дихроизма, согласующийся с αβ белками, и демонстрировал превосходные характеристики кооперативного разворачивания и рефолдинга. Несмотря на эти достижения, все белки в этом семействе показали характеристики расплава при анализе с использованием ЯМР (ядерный магнитный резонанс ), и дальнейшая работа по выяснению их структур не могла быть продолжена.
Протеины серии sTIM представляют собой первую удачную конструкцию ствола TIM de novo. sTIM-11 (PDB : 5BVL ) был разработан с внутренней 4-кратной симметрией, чтобы упростить вычислительный дизайн с использованием программного пакета Rosetta. Полученные ранее первые принципы были использованы для определения топологии и длины вторичной структуры. sTIM-11 оказался очень термостабильным, совместно складывающейся конструкцией, которая приняла его предполагаемую структуру.
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Дипеш Нагараджан; Неха Нанаджкар (2020), «Ствол TIM» (PDF), WikiJournal of Science, 3 (1): 4, doi : 10.15347 / WJS / 2020.004, Wikidata Q87400003
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Дипеш Нагараджан; Неха Нанаджкар (2020), «Ствол TIM» (PDF), WikiJournal of Science, 3 (1): 4, doi : 10.15347 / WJS / 2020.004, Wikidata Q87400003