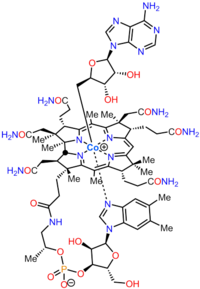
 Аденозилкобаламин
Аденозилкобаламин  Метилкобаламин, еще одна биологически активная форма. Темно-красные кристаллы растворяются в воде, образуя растворы вишневого цвета.
Метилкобаламин, еще одна биологически активная форма. Темно-красные кристаллы растворяются в воде, образуя растворы вишневого цвета. Биосинтез кобаламина - это процесс, с помощью которого бактерии и археи производят кобаламин, витамин B 12. В процессе преобразования аминолевулиновой кислоты через уропорфириноген III и аденозилкобировой кислоты в конечные формы, в которых она используется ферментами как в организмах-продуцентах, так и в других виды, в том числе люди, которые получают его с пищей.
Кобаламин (витамин B 12) - самый крупный и структурно сложный витамин. Он состоит из модифицированного тетрапиррола, коррина, с центрально хелатированным кобальтом и обычно находится в одной из двух биологически активных форм. : метилкобаламин и аденозилкобаламин. Большинство прокариот, а также животных, имеют кобаламин-зависимые ферменты, которые используют его в качестве кофактора, тогда как растения и грибы не имеют используй это. У бактерий и архей эти ферменты включают метионинсинтазу, рибонуклеотидредуктазу, глутамат и мутазы метилмалонил-КоА, этаноламин-аммиак-лиаза и диол дегидратаза. У некоторых млекопитающих кобаламин получают с пищей и требуется для метионинсинтазы и метилмалонил-КоА мутазы. У людей он играет важную роль в метаболизме фолиевой кислоты и в синтезе промежуточного звена цикла лимонной кислоты, сукцинил-КоА.
Существует как минимум два различных пути биосинтеза кобаламина в бактериях :
 Пути биосинтеза витамина B12 из аминолевулиновой кислоты (ALA) у бактерий и архей Пути биосинтеза витамина B12 из аминолевулиновой кислоты (ALA) у бактерий и архей | 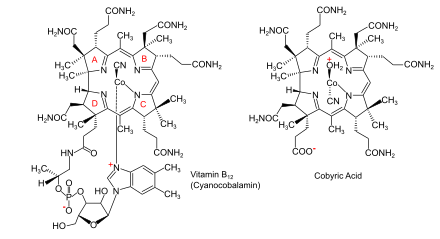 Витамин B12 (как цианокобаламин) и его родительская кобировая кислота Витамин B12 (как цианокобаламин) и его родительская кобировая кислота |
Любой путь можно разделить на две части:
Другой тип синтеза происходит через путь спасения, где внешние корриноиды абсорбируются с образованием B 12. Известно, что виды из следующих родов и следующих отдельных видов синтезируют кобаламин: Propionibacterium shermanii, Pseudomonas denitrificans, Streptomyces griseus, Acetobacterium, Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Lactobacillus, Micromonospora, Mycobacterium, Nocardia, Proteus, Rhizobium, Salmonella, Serratia, Streptococcus и Xanthomonas.
На ранних стадиях биосинтеза тетрапирроловый структурный каркас создается ферментами дезаминаза и косинтетаза которые превращают аминолевулиновую кислоту через порфобилиноген и гидроксиметилбилан в уропорфири Ноген III. Последний является первым макроциклическим промежуточным соединением, общим для гема, хлорофилла, сирохема и самого кобаламина.
Биосинтез кобаламина отличается от биосинтеза гема и хлорофилла у уропорфриногена III: его трансформация включает последовательное добавление метила (CH 3) групп для получения промежуточных продуктов, которым были даны тривиальные названия в соответствии с количеством этих групп, которые были включены. Следовательно, первым промежуточным продуктом является прекоррин-1, следующим - прекоррин-2 и так далее. Включение всех восьми дополнительных метильных групп, которые встречаются в кобировой кислоте, исследовали с использованием меченного C метилом S-аденозилметионина. Так было до тех пор, пока ученые из Rhône-Poulenc Rorer не использовали генно-инженерный штамм Pseudomonas denitrificans, в котором восемь генов cob участвуют в биосинтезе витамин был сверхэкспрессирован, поэтому можно было определить полную последовательность метилирования и других стадий, таким образом полностью установив все промежуточные соединения в этом пути.
Фермент CobA катализирует две химические реакции EC 2.1.1.107
 продукт прекоррин-2 двух метилирования реакции
продукт прекоррин-2 двух метилирования реакции  прекоррин-1 + S-аденозил-L-гомоцистеин
прекоррин-1 + S-аденозил-L-гомоцистеин  прекоррин-2 + S-аденозил-L-гомоцистеин
прекоррин-2 + S-аденозил-L-гомоцистеинФермент CobI катализирует реакцию EC 2.1.1.130
 прекоррин-3A + S-аденозил-L-гомоцистеин
прекоррин-3A + S-аденозил-L-гомоцистеинФермент CobG катализирует реакцию EC 1.14.13.83
 прекоррин-3B + NAD + H 2O
прекоррин-3B + NAD + H 2OЭтот фермент представляет собой оксидоредуктазу, которой требуется кислород, и поэтому реакция может протекать только в аэробных условиях. Обозначение этих прекорринов как 3A и 3B отражает тот факт, что каждая из них содержит на три метильных группы больше, чем уропорфириноген III, но с другой структурой: в частности, прекоррин-3B имеет внутреннее γ-лактонное кольцо, образованное из кольца. Боковая цепь уксусной кислоты замыкается обратно на макроцикл.
Фермент CobJ продолжает тему внедрения метильной группы, катализируя реакцию EC 2.1.1.131
 прекоррин-4 + S-аденозил-L-гомоцистеин
прекоррин-4 + S-аденозил-L-гомоцистеин Превращение прекоррина-3B в прекоррин-4 катализируется фермент CobJ в Pseudomonas denitrificans
Превращение прекоррина-3B в прекоррин-4 катализируется фермент CobJ в Pseudomonas denitrificans . Важно отметить, что на этом этапе макроцикл кольцо сжимается, так что продукт впервые содержит ядро коррина, характеризует кобаламин.
Вставки метильных групп продолжаются, когда фермент CobM катализирует реакцию EC 2.1.1.133
 прекоррин-5 + S-аденозил-L-гомоцистеин
прекоррин-5 + S-аденозил-L-гомоцистеинВновь вставленная метильная группа присоединяется к кольцу C у углерода, присоединенного к метиленовый (CH 282>2) мостик с кольцом B. Это не его окончательное расположение на кобаламине, поскольку более поздняя стадия включает его перегруппировку в соседний углерод кольца.
Фермент CobF катализирует реакцию EC 2.1.1.152
 прекоррин-6A + S-аденозил-L-гомоцистеин + ацетат
прекоррин-6A + S-аденозил-L-гомоцистеин + ацетат  Превращение прекоррина-5 в прекоррин-6A катализируется фермент CobF в Pseudomonas denitrificans
Превращение прекоррина-5 в прекоррин-6A катализируется фермент CobF в Pseudomonas denitrificans Это преобразование удаляет ацетильную группу, расположенную в положении 1 кольцевой системы прекоррина-4, и заменяет ее вновь введенной метильной группой. Название продукта, прекоррин-6A, отражает тот факт, что к этому моменту к уропорфириногену III было добавлено всего шесть метильных групп. Однако, поскольку один из них был экструдирован с ацетатной группой, структура прекоррина-6A содержит только оставшиеся пять.
Фермент CobK теперь восстанавливает двойную связь в кольце D, катализируя реакцию EC 1.3.1.54
 прекоррин-6B + NADP
прекоррин-6B + NADPТаким образом, прекоррин-6B отличается по структуре от прекоррина-6A только с двумя лишними атомами водорода.
Фермент CobL имеет два активных центра, один катализирует присоединение двух метильных групп, а другой декарбоксилирование группы CH 2 COOH на кольце D, так что этот заместитель становится простой метильной группой EC 2.1.1.132
 прекоррин-8X + 2 S-аденозил-L-гомоцистеин + CO 2
прекоррин-8X + 2 S-аденозил-L-гомоцистеин + CO 2 Превращение прекоррина-6B в прекоррин-8 катализируется ферментом CobL в Pseudomonas denitrificans
Превращение прекоррина-6B в прекоррин-8 катализируется ферментом CobL в Pseudomonas denitrificans Фермент CobH катализирует реакцию перегруппировки EC 5.4.99.61
 гидробириновая кислота
гидробириновая кислотаРезультатом является то, что метильная группа, которая была добавлена к кольцу C, изомеризуется до своего конечного местоположения, пример внутримолекулярного переноса.
Не Фермент xt в пути, CobB, превращает две из восьми групп карбоновой кислоты в их первичные амиды в реакции EC 6.3.5.9
 a, c-диамид гидробириновой кислоты + 2 ADP + 2 фосфат + 2 глутаминовая кислота
a, c-диамид гидробириновой кислоты + 2 ADP + 2 фосфат + 2 глутаминовая кислота Включение кобальта (II) в макроцикл катализируется ферментом хелатазой кобальта (CobNST) в реакции EC 6.6.1.2
 cob (II) ириновая кислота a, c-диамид + АДФ + фосфат + H
cob (II) ириновая кислота a, c-диамид + АДФ + фосфат + HИменно на этой стадии аэробный путь и анаэробный путь сливаются, причем более поздние стадии химически идентичны.
Многие из стадий, выходящих за рамки уропорфириногена III у анаэробных организмов, таких как Bacillus megaterium, связаны с химически сходными но генетически отличные от трансформаций аэробного пути.
Ключевое различие в путях состоит в том, что кобальт внедряется в анаэробные организмы на ранней стадии путем первого окисления прекоррина -2 до его полностью ароматизированной формы сирогидрохлорина, а затем до комплекса кобальта (II) этого соединения. Реакции катализируются CysG EC 1.3.1.76 и Sirohydrochlorincobaltochelatase EC 4.99.1.3.
As in В аэробном пути третья метильная группа вводится ферментом метилтрансферазой, CbiL в реакции EC 2.1.1.151
 фактор кобальта III + S-аденозил-L-гомоцистеин
фактор кобальта III + S-аденозил-L-гомоцистеинПроисходит метилирование и сокращение кольца с образованием макроцикла коррина следующая EC 2.1.1.272, катализируемая ферментом Метилтрансфераза фактора кобальта III (CbiH)
 кобальт-прекоррин-4 + S-аденозил-L-гомоцистеин
кобальт-прекоррин-4 + S-аденозил-L-гомоцистеин Превращение кобальт-фактора III в кобальт-прекоррин-4 катализируется ферментом CbiH.
Превращение кобальт-фактора III в кобальт-прекоррин-4 катализируется ферментом CbiH. Таким образом, полученный материал содержит δ -лактон, а шестичленное кольцо, а не γ-лактон (пятичленное кольцо) прекоррина-3B.
Введение метильной группы в C-11 на следующей стадии катализируется кобальт-прекоррин-4-метилтрансферазой (CbiF) в реакции EC 2.1.1.271
 кобальт-прекоррин-5 + S-аденозил-L- гомоцистеин
кобальт-прекоррин-5 + S-аденозил-L- гомоцистеинТеперь все готово для экструзии двухуглеродного фрагмента, соответствующего ацетату, высвобождающемуся при образовании прекоррина-6A в аэробный путь. В этом случае высвобождаемый фрагмент представляет собой ацетальдегид, и это катализируется CbiG в реакции EC 3.7.1.12
 кобальт-прекоррин-5B + ацетальдегид + 2 H
кобальт-прекоррин-5B + ацетальдегид + 2 HЭтапы от кобальт-прекоррина-5B до cob (II) ириновой кислоты a, c-диамид в анаэробном пути по существу химически идентичны таковым в аэробной последовательности. Промежуточные продукты называются кобальт-прекоррин-6A, кобальт-прекоррин-6B, кобальт-прекоррин-8 и кобириновая кислота, а участвующие ферменты / реакции - Кобальт-прекоррин-5B (C1) -метилтрансфераза (CbiD / EC 2.1.1.195 ); Кобальт-прекоррин-6А редуктаза (CbiJ / EC 1.3.1.106 ); Кобальт-прекоррин-7 (C15) -метилтрансфераза (декарбоксилирование) (CbiET / EC 2.1.1.196 ), Кобальт-прекоррин-8-метилмутаза (CbiC / EC 5.4.99.60 ) и CbiA / EC 6.3.5.11. Конечный фермент образует a, c-диамид коб (II) ириновой кислоты по мере схождения двух путей.
Аэробные и анаэробные организмы разделяют тот же химический путь, что и a, c-диамид ириновой кислоты cob (II), и это показано для продуктов гена cob.
Кобальт (II) восстанавливается до кобальта (I) ферментом ириновой кислоты Cob (II) кислота a, c-диамидредуктаза (CobR, реакция EC 1.16.8.1 ), а затем фермент Cob (I) ириновая кислота a, c-диамид-аденозилтрансфераза (CobO) присоединяется аденозильный лиганд металла в реакции EC 2.5.1.17. Затем фермент CobQ (реакция EC 6.3.5.10 ) превращает все карбоновые кислоты, кроме пропионовой кислоты в кольце D, в их первичные амиды.
В аэробных организмах фермент CobCD (реакция EC 6.3.1.10 ) теперь присоединяется к (R) - 1-амино-2-пропанол (производное от треонина ) до пропионовой кислоты с образованием аденозилкобинамида и фермента CobU (реакция EC 2.7.1.156 ) фосфорилирует концевую гидроксигруппу с образованием аденозилкобинамидфосфата. Тот же конечный продукт образуется в анаэробных организмах в результате прямой реакции аденозилкобирной кислоты с (R) -1-амино-2-пропанол O-2-фосфатом (полученным из треонин-O-фосфата ферментом CobD в реакции EC 4.1.1.81 ), катализируемой ферментом CbiB.
В отдельной ветви пути 5,6-диметилбензимидазол биосинтезируется из флавинмононуклеотида ферментом 5,6-диметилбензимидазолсинтазой (реакция EC 1.13.11.79 ) и превращается с помощью CobT в реакции EC 2.4.2.21 с образованием альфа-рибазол-5 'фосфата. Затем фермент CobU (реакция EC 2.7.7.62 ) активирует аденозилкобинамидфосфат путем образования аденозилкобинамида-GDP и CobV (реакция EC 2.7.8.26 ) связывает два субстрата с образованием аденозилкобаламин-5'-фосфата. На последней стадии кофермента CobC удаляет 5'-фосфатную группу в реакции EC 3.1.3.73
 аденозилкобаламин + фосфат
аденозилкобаламин + фосфатПолный путь биосинтеза включает длинный линейный путь, который требует около 25 участвующих ферментов.
Многие виды прокариот не могут биосинтезировать аденозилкобаламин, но могут производить его из кобаламина. Эти организмы способны транспортировать кобаламин в клетку и превращать его в необходимую форму кофермента. Даже такие организмы, как Salmonella typhimurium, которые могут вырабатывать кобаламин, также усваивают его из внешних источников, если они доступны. Поглощению в клетки способствуют переносчики ABC, которые поглощают кобаламин через клеточную мембрану.
У людей пищевые источники кобаламина связываются после приема внутрь как транскобаламины. Затем они превращаются в формы кофермента, в которых они используются. Метилмалоновая ацидурия и гомоцистинурия белок типа C представляет собой фермент, который катализирует децианирование цианокобаламина, а также деалкилирование алкилкобаламинов, включая метилкобаламин и аденозилкобаламин.