 | |
 | |
| Имена | |
|---|---|
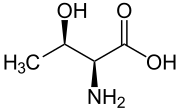
| Название IUPAC Треонин | |
| Другие названия 2-амино-3-гидроксибутановая кислота | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpide r | |
| DrugBank | |
| ECHA InfoCard | 100.000.704 |
| Номер EC |
|
| IUPHAR / BPS | |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) |
|
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C4H9NO3 |
| Молярная масса | 119,120 г · моль |
| Растворимость в воде | (H2O, г / дл) 10,6 (30 °), 14,1 (52 °), 19,0 (61 °) |
| Кислотность (pK a) | 2,63 (карбоксил), 10,43 (амино) |
| Страница дополнительных данных | |
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr) и т. Д. |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ |
| Спектральные данные | UV, IR, ЯМР, MS |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в информационном окне | |
Треонин (символ Thr или T ) является аминокислотой который используется в биосинтезе белков. Он содержит α-аминогруппу (которая находится в протонированной форме -NH. 3в биологических условиях), карбоксильную группу (которая находится в депротонированной форме -COO в биологических условиях). условий), и боковая цепь, содержащая гидроксильную группу, что делает ее полярной незаряженной аминокислотой. Он необходим для человека, то есть организм не может его синтезировать: он должен быть получен с пищей. Треонин синтезируется из аспартата в таких бактериях, как E. coli. Он кодируется всеми кодонами , начинающими AC (ACU, ACC, ACA и ACG).
Боковые цепи треонина часто связаны водородными связями; наиболее часто образующиеся небольшие мотивы основаны на взаимодействиях с серином : ST-повороты, ST-мотивы (часто в начале альфа-спиралей) и ST скобы (обычно в середине альфа-спиралей).
Остаток треонина подвержен многочисленным посттрансляционным модификациям. гидроксил боковая цепь может подвергаться O-связанному гликозилированию. Кроме того, остатки треонина подвергаются фосфорилированию под действием треонин киназы. В своей фосфорилированной форме он может обозначаться как фосфотреонин. Фосфотреонин имеет три потенциальных координационных центра (карбоксильная, аминная и фосфатная группа), и определение способа координации между фосфорилированными лигандами и ионами металлов, происходящих в организме, важно для объяснения функции фосфотреонина в биологических процессах.
Он является предшественником глицина и может использоваться в качестве пролекарства для надежного повышения уровней глицина в мозге.
Треонин был последней из 20 общих протеиногенных аминокислот, которые были обнаружены. Он был открыт в 1936 году Уильямом Каммингом Роуз в сотрудничестве с Кертисом Мейером. Аминокислота была названа треонином, потому что она была подобна по структуре треоновой кислоте, четырехуглеродному моносахариду с молекулярной формулой C4H8O5
  . . |
| L-реонин (2S, 3R) и D -реонин (2R, 3S). |
  . . |
| L-аллотреонин (2S, 3S) и D -аллотреонин (2R, 3R) |
Треонин является одной из двух протеиногенных аминокислот с двумя хиральными центрами, другим является изолейцин. Треонин может существовать в четырех возможных стереоизомерах со следующими конфигурациями: (2S, 3R), (2R, 3S), (2S, 3S) и (2R, 3R). Однако название L -реонин используется для одного единственного диастереомера, (2S, 3R) -2-амино-3-гидроксибутановой кислоты. Второй стереоизомер (2S, 3S), который редко присутствует в природе, называется L -аллотреонином. Два стереоизомера (2R, 3S) - и (2R, 3R) -2-амино-3-гидроксибутановая кислота не имеют большого значения.
Как незаменимая аминокислота треонин не синтезируется в организме человека и должен присутствовать в белках с пищей. Взрослым людям требуется около 20 мг / кг массы тела в день. У растений и микроорганизмов треонин синтезируется из аспарагиновой кислоты через α-аспартил-полуальдегид и гомосерин. Гомосерин подвергается О-фосфорилированию; этот фосфатный сложный эфир подвергается гидролизу одновременно с перемещением группы ОН. Ферменты, участвующие в типичном биосинтезе треонина, включают:
 биосинтез треонина
биосинтез треонина Продукты с высоким содержанием треонина включают творог, домашнюю птицу, рыба, мясо, чечевица, черная черепаха и семена кунжута.
Рацемический треонин может быть получен из кротоновой кислоты путем альфа-функционализации с использованием ацетата ртути (II).