A вспомогательный хиральный элемент - это стереогенная группа или единица, временно включенные в органический соединение, чтобы контролировать стереохимический результат синтеза. хиральность, присутствующая во вспомогательном веществе, может смещать стереоселективность одной или нескольких последующих реакций. Вспомогательное вещество затем обычно может быть восстановлено для использования в будущем.

.
Общая схема использования хирального вспомогательного вещества в асимметричном синтезеБольшинство биологических молекул и фармацевтических мишеней существуют в виде одного из двух возможных энантиомеров ; следовательно, химический синтез натуральных продуктов и фармацевтических агентов часто предназначен для получения мишени в энантиомерно чистой форме. Хиральные вспомогательные вещества являются одной из многих стратегий, доступных химикам-синтетикам для селективного получения желаемого стереоизомера данного соединения.
Хиральные вспомогательные вещества были введены Элиасом Джеймсом Кори в 1975 году с хиральным 8-фенилментолом и Автор Барри Трост в 1980 г. с хиральной миндальной кислотой. Соединение ментола сложно получить, и в качестве альтернативы транс-2-фенил-1-циклогексанол был введен Дж. К. Уайтселлом в 1985 году.
Хиральные вспомогательные вещества включаются в пути синтеза, чтобы контролировать абсолютную конфигурацию стереогенных центров. Синтез макролида цитоварицина Дэвидом А. Эвансом, который считается классическим, использует хиральные вспомогательные вещества оксазолидинон для одной реакции асимметричного алкилирования и четырех асимметричных альдольных реакций, устанавливая абсолютную стереохимию девяти стереоцентров.
 Цитоварицин, синтезированный Д.А. Эвансом в 1990 году. Синие и красные связи указывают на стереоцентры, установленные с использованием хиральных вспомогательных веществ.
Цитоварицин, синтезированный Д.А. Эвансом в 1990 году. Синие и красные связи указывают на стереоцентры, установленные с использованием хиральных вспомогательных веществ. Типичное стереоселективное преобразование, управляемое вспомогательными веществами, включает три этапа: во-первых, вспомогательное соединение ковалентно связано к субстрату; во-вторых, полученное соединение претерпевает одно или несколько диастереоселективных превращений; и, наконец, вспомогательное вещество удаляют в условиях, которые не вызывают рацемизацию желаемых продуктов. Стоимость использования стехиометрического вспомогательного средства и необходимость проводить синтетические этапы добавления и удаления вспомогательного средства делают этот подход неэффективным. Однако для многих преобразований единственная доступная стереоселективная методология полагается на хиральные вспомогательные вещества. Кроме того, превращения с хиральными вспомогательными веществами имеют тенденцию быть универсальными и очень хорошо изученными, обеспечивая наиболее эффективный по времени доступ к энантиомерно чистым продуктам.
Кроме того, продуктами реакций, направленных на вспомогательные вещества, являются диастереомеры, что позволяет легко разделить их такими методами, как колоночная хроматография или кристаллизация.
В раннем примере использования хирального вспомогательного вещества в асимметричном синтезе Э. Дж. Кори и его коллеги провели асимметричную реакцию Дильса-Альдера между (-) -8-фенилментол акрилат сложный эфир и 5-бензилоксиметилциклопентадиен. Продукт циклоприсоединения был перенесен в йодолактон, показанный ниже, промежуточное соединение в классическом синтезе Кори простагландинов. Предполагается, что задняя поверхность акрилата блокируется вспомогательным веществом, так что циклоприсоединение происходит на передней поверхности алкена.
 Диастереоселективное циклоприсоединение Дильса-Альдера с хиральным вспомогательным (-) - 8-фенилментолом на пути к простагландинам
Диастереоселективное циклоприсоединение Дильса-Альдера с хиральным вспомогательным (-) - 8-фенилментолом на пути к простагландинам (-) - 8-фенилментол может быть получен из любого энантиомера из пулегон, хотя ни один из маршрутов не очень эффективен. Из-за широкого использования вспомогательного 8-фенилментола были изучены альтернативные соединения, которые легче синтезировать, такие как транс-2-фенил-1-циклогексанол и транс-2- (1-фенил-1-метилэтил) циклогексанол.
1,1'-Бинафтил-2,2'-диол или BINOL, использовался в качестве хирального вспомогательного вещества для асимметричного синтеза с 1983 года.
 (R) -BINOL
(R) -BINOL Хисаши Ямамото впервые использовал (R) -БИНОЛ в качестве хирального вспомогательного вещества в асимметричном синтезе лимонен, который является примером циклических моно- терпенов. Мононериловый эфир (R) -БИНОЛА получали моносилилированием и алкилированием (R) -БИНОЛА в качестве хирального вспомогательного вещества. После восстановления алюминийорганическим реагентом лимонен был синтезирован с низкими выходами (выход 29%) и умеренным энантиомерным избытком до 64% ее.
 Первое использование BINOL в качестве хирального вспомогательного вещества
Первое использование BINOL в качестве хирального вспомогательного вещества Получение различных энантиомерно чистые необычные R-аминокислоты могут быть получены путем алкилирования хиральных производных глицина, обладающих аксиально хиральным BINOL в качестве вспомогательного вещества. Это было изображено Fuji et al. На основании различного электрофила, диастереомерный избыток варьировался от 69% до 86.
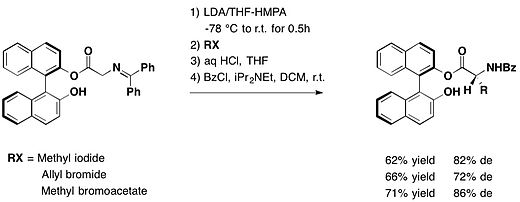 Диастереоселективное добавление между Гриньяром и альдегидом, защищенным BINOL
Диастереоселективное добавление между Гриньяром и альдегидом, защищенным BINOL Защищено альдегидом функционируют с (R) -BINOL, арилглиоксали диастереоселективно реагируют с реагентами Гриньяра, давая защищенный атролактальдегид с умеренным или превосходным диастереомерным избытком и высокими выходами.
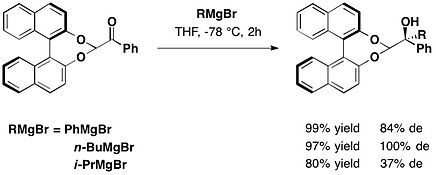 Диастереоселективное добавление между Гриньяром и BINOL-защищенным альдегидом
Диастереоселективное добавление между Гриньяром и BINOL-защищенным альдегидом  Транс-2-фенилциклогексанол
Транс-2-фенилциклогексанол Один тип хирального вспомогательного вещества основан на мотиве транс-2-фенилциклогексанола, представленном Джеймсом К. Уайтселлом с сотрудниками в 1985 году. вспомогательное вещество было использовано в еновых реакциях производного сложного эфира глиоксиловой кислоты;.
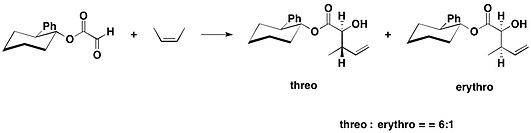 транс-2-фенилциклогексанол использовали в еновой реакции в качестве хирального вспомогательного вещества.
транс-2-фенилциклогексанол использовали в еновой реакции в качестве хирального вспомогательного вещества. общий синтез (-) - гептемерона B и (-) - гуанакастепена E, связанных с транс-2-фенилом 1циклогексанол, глиоксилат взаимодействует с 2,4-диметил-пент-2-еном в присутствии хлорида олова (IV), давая желаемый антиаддукт в качестве основного продукта вместе с небольшим количеством его син-изомер с соотношением диастереомеров 10: 1 .
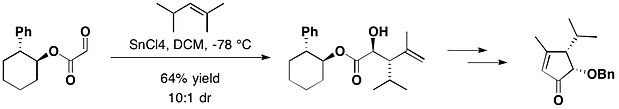 Глиоксилат реагировал с 2,4-диметил-2-пентаном с транс-2-фенилциклогексанолом в качестве хирального вспомогательного вещества
Глиоксилат реагировал с 2,4-диметил-2-пентаном с транс-2-фенилциклогексанолом в качестве хирального вспомогательного вещества Для еще большего контроля конформации, переключение с фенил в группу тритил дает (ТТС). В 2015 году группа Brown опубликовала эффективную хиральную перманганат -опосредованную окислительную циклизацию с TTC.
 транс-2-тритилциклогексанол использовался в асимметричной перманганат-опосредованной окислительной циклизации.
транс-2-тритилциклогексанол использовался в асимметричной перманганат-опосредованной окислительной циклизации. Оксазолидинон вспомогательные вещества, популяризированные Дэвидом А. Эвансом, применялись для многих стереоселективных превращений, включая альдольные реакции, реакции алкилирования и реакции Дильса. -Старшие реакции. Оксазолидиноны замещены в положениях 4 и 5. За счет стерических затруднений заместители определяют направление замещения различных групп. Вспомогательное оборудование впоследствии удаляется, например, посредством гидролиза.
Оксазолидиноны можно получить из аминокислот или легко доступных аминоспиртов. Большое количество оксазолидинонов коммерчески доступно, в том числе четыре ниже.
 Некоторые из имеющихся в продаже хиральных вспомогательных веществ оксазолидинона
Некоторые из имеющихся в продаже хиральных вспомогательных веществ оксазолидинона Ацилирование оксазолидинона достигается депротонированием н-бутиллитием и гашением ацилхлоридом.
 ацилированием a хиральный оксазолидинон с пропаноилхлоридом
ацилированием a хиральный оксазолидинон с пропаноилхлоридом Депротонирование по α-углероду оксазолидинона имида сильным основанием, таким как диизопропиламид лития селективно дает (Z) - енолят, который может подвергаться стереоселективному алкилированию.
 Алкилирование оксазолидинонимида бензилбромидом
Алкилирование оксазолидинонимида бензилбромидом Активированные электрофилы, такие как аллильные или бензиловые галогениды, являются очень хорошими субстратами.
Хиральные оксазолидиноны наиболее широко используются в стереоселективных альдольных реакциях.
Мягкая енолизация с помощью кислоты Льюиса трифлат дибутилбора и основания диизопропилэтиламин дает (Z) -енолат, который претерпевает диастереоселективную альдольную реакцию с альдегидным субстратом. Преобразование особенно мощно, потому что оно устанавливает два смежных стереоцентра одновременно.
Модель наблюдаемой стереоселективности может быть найдена ниже. Синстереорреляция между метильной группой и новым вторичным спиртом является результатом переходного состояния Циммермана-Тракслера с шестичленным кольцом, в котором енолятный кислород и альдгейдный кислород координируют бор. Альдегид ориентирован таким образом, что водород находится в псевдоаксиальной ориентации, чтобы минимизировать 1,3-диаксиальные взаимодействия. Абсолютная стереохимия двух стереоцентров контролируется хиральностью вспомогательного. В переходной структуре вспомогательный карбонил ориентирован от енолятного кислорода, чтобы минимизировать суммарный диполь молекулы; одна сторона енолята заблокирована заместителем на хиральном вспомогательном элементе.

.
Модель стереоселективности альдольной реакции ЭвансаДля облегчения удаления оксазолидинонового вспомогательного вещества с образованием различных синтетически полезных функциональных групп.
 Превращение имида оксазолидинона в различные функциональные группы
Превращение имида оксазолидинона в различные функциональные группы Камфорсултам, или сультам Оппольцера, является классическим хиральным вспомогательным средством.
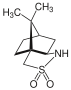 Камфорсультам
Камфорсультам В полном синтезе манзацидина B группа Ohfune использовала камфорсультам для асимметричного конструирования основного оксазолинового кольца. По сравнению с оксазолидиноном в качестве хирального вспомогательного вещества, камфорсультам обладал значительной (2S, 3R) -селективностью.
 Было обнаружено, что хиральный камфорсультам является лучшим хиральным вспомогательным средством по сравнению с оксазолидиноном с учетом единственной асимметричной индукции.
Было обнаружено, что хиральный камфорсультам является лучшим хиральным вспомогательным средством по сравнению с оксазолидиноном с учетом единственной асимметричной индукции. Камфорсультам также действует как хиральный помощник в добавлении Майкла. Литиевая основа стимулировала стереоселективное добавление тиолов по Майклу к N-мктакрилоилкамфорсультам, давая соответствующие продукты присоединения с высокой диастереоселективностью.
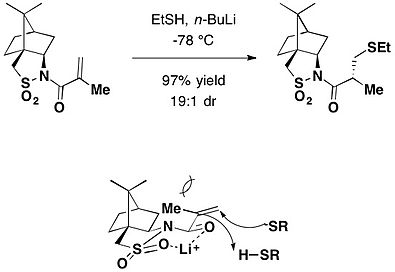 Камфорсультам использовался в качестве хирального вспомогательного вещества при добавлении Майкла.>Перестановка Клейзена. В присутствии бутилированного гидрокситолуола (BHT), используемого в качестве поглотителя радикалов, раствор аддукта гераниола и камфорсултама в толуоле нагревали в запаянной пробирке при температуре 140 ° C, чтобы обеспечить в основном (2R, 3S) -изомер в качестве основного продукта перегруппировки с выходом 72%, защищая два смежных стереоцентра, включая четвертичный углерод.
Камфорсультам использовался в качестве хирального вспомогательного вещества при добавлении Майкла.>Перестановка Клейзена. В присутствии бутилированного гидрокситолуола (BHT), используемого в качестве поглотителя радикалов, раствор аддукта гераниола и камфорсултама в толуоле нагревали в запаянной пробирке при температуре 140 ° C, чтобы обеспечить в основном (2R, 3S) -изомер в качестве основного продукта перегруппировки с выходом 72%, защищая два смежных стереоцентра, включая четвертичный углерод.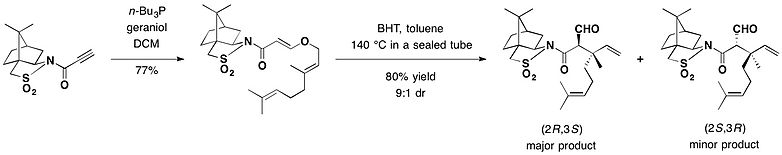 Камфорсультам использовали в качестве хирального вспомогательного вещества в перегруппировке Клайзена. 568>Псевдоэфедрин
Камфорсультам использовали в качестве хирального вспомогательного вещества в перегруппировке Клайзена. 568>ПсевдоэфедринИ (R, R) -, и (S, S) - псевдоэфедрин могут использоваться в качестве хиральных вспомогательных веществ. Псевдоэфедрин реагирует с карбоновой кислотой, ангидридом кислоты или ацилхлоридом с образованием амида псевдоэфедрина.
α-протон карбонильного соединения легко депротонируется ненуклеофильным основанием с образованием енолята, который может далее реагировать. Конфигурация аддитивного соединения, такого как алкилгалогенид, определяется метильной группой. Таким образом, любой продукт присоединения будет синонимом метила и антитела к гидроксильной группе. Хиральный вспомогательный компонент псевдоэфедрина впоследствии удаляют путем расщепления амидной связи подходящим нуклеофилом.
Оба энантиомера псевдоэфедрина коммерчески доступны. Рацемический псевдоэфедрин продается как Sudafed - назальное противозастойное средство. Поскольку псевдоэфедрин может быть использован для незаконного производства метамфетамина, покупка псевдоэфедрина для использования в академических или промышленных исследованиях в значительной степени регулируется. В качестве альтернативы Myers et. соавторы сообщили о применении хиральных вспомогательных веществ псевдоэфенамина в реакциях алкилирования. Хотя псевдоэфенамин недоступен из коммерческих источников, он может быть относительно легко синтезирован из бензила и не может быть использован для производства амфетаминов.
 псевдоэфедрина и хиральных вспомогательных веществ псевдоэфенамина
псевдоэфедрина и хиральных вспомогательных веществ псевдоэфенамина псевдоэфедрина амиды обычно получают ацилированием ацилхлоридом или ангидридом.

.
Ацилирование (S, S) -псуеодфедрина ангидридом кислотыАмиды псевдоэфедрина подвергаются депротонированию посредством сильное основание, такое как диизопропиламид лития (LDA), с получением соответствующих (Z) - енолятов. Алкилирование этих енолятов лития происходит с высокой лицевой селективностью.

.
Диастереоселективное алкилирование амида псевдоэфедринаСчитается, что диастереоселективность является результатом конфигурации, в которой одна сторона енолята лития блокируется вторичным алкоксидом лития и молекулами растворителя, связанными с этим катионом лития. В соответствии с этим предложением было замечено, что диастереоселективность стадии алкилирования сильно зависит от количества присутствующего хлорида лития и от растворителя, тетрагидрофурана (THF). Обычно от 4 до 6 эквивалентов хлорида лития достаточно для насыщения раствора енолята в ТГФ при реакционной молярности.

.
Модель диастереоселективного алкилирования енолята псевдоэфедринамидаОдно из основных преимуществ асимметричного алкилирования амидами псевдоэфедрина состоит в том, что еноляты амида обычно достаточно нуклеофильны, чтобы реагировать с первичными и даже вторичными галогенидами при температурах от - От 78 ° C до 0 ° C. Также возможно создание центров четвертичного углерода путем алкилирования енолятов α-разветвленных амидов, хотя добавление DMPU необходимо для менее реакционноспособных электрофилов.
Условия есть был разработан для превращения амидов псевдоэфедрина в энантиомерно обогащенные карбоновые кислоты, спирты, альдегиды и кетоны.

.
Превращение амидов псевдоэфедрина в синтетические полезные функциональные группыПосле расщепления вспомогательные вещества могут быть восстановлены и использованы повторно.
Этот специфический хиральный вспомогательный агент сульфинамид был первоначально разработан Джонатаном А. Эллманом, и его применение широко исследовалось его группой. Таким образом, его часто называют вспомогательным веществом Эллмана или сульфинамидом Эллмана.
 Два возможных энантиомера трет-бутансульфинамида
Два возможных энантиомера трет-бутансульфинамида Любой энантиомер трет-бутансульфинамида может быть получен из трет-бутилдисульфида в две стадии: каталитическая реакция асимметричного окисления дает дисульфид продукт моноокисления с высоким выходом и энантиомерным избытком. Обработка этого соединения амидом лития в аммиаке дает оптически чистый инвертированный продукт.

.
Синтез трет-бутансульфинамида из легко доступных химикатовКонденсация трет-бутансульфинамида с альдегидом или кетоном протекает с высоким выходом и дает только (E) -изомер соответствующего N-сульфинила. имины.

.
Конденсация трет-бутансульфинамида с альдегидами и кетонамиДобавление реактива Гриньяра к трет-бутансульфинилальдимину или кетимину приводит к асимметричному присоединению с образованием разветвленного сульфинамид. Наблюдаемую стереоселективность можно объяснить шестичленной переходной структурой кольца, в которой и кислород, и азот сульфинилимина координируют магний.

.
Добавление реактива Гриньяра к трет-бутансульфинилальдиминуВспомогательное вещество может быть удалено из желаемого амина обработкой соляной кислотой в протонные растворители.

.
Кислотное расщепление вспомогательного сульфинамидаРеакции алкилирования хирального (S) -1-амино-2-метоксиметилпирролидина (SAMP ) и (R) -1-амино-2-метоксиметилпирролидин (RAMP ) гидразоны были разработаны Dieter Enders и EJ Кори.
SAMP можно получить в шесть стадий из (S) -пролина, а RAMP можно получить в шесть стадий из (R) -глутаминовой кислоты.

.
Получение SAMP и RAMP из коммерчески доступных материалов.Конденсация SAMP или RAMP с альдегидом или кетоном дает (E) -гидразин. Депротонирование диизопропиламидом лития и добавление алкилгалогенида дает алкилированный продукт. Вспомогательное вещество можно удалить с помощью озонолиза или гидролиза.

.
Конденсация, алкилирование и расщепление с использованием хиральных вспомогательных веществ SAMP / RAMPХиральные вспомогательные вещества обычно надежны и универсальны, что позволяет синтезировать большое количество энантиомерно чистых соединений в кратчайшие сроки. Следовательно, хиральные вспомогательные вещества часто являются методом выбора на ранних этапах разработки лекарств.
Ингибитор протеазы ВИЧ Типранавир продается для лечения СПИДа. Первый путь энантиоселективной медицинской химии к типранавиру включал конъюгатное добавление органокупратного реагента к хиральному акцептору Михаэля. Хиральный оксазолидинон в акцепторе Михаэля контролирует стереохимию одного из двух стереоцентров в молекуле. Последний коммерческий маршрут до Типранавира не имеет хирального вспомогательного вещества; вместо этого этот стереоцентр задается реакцией асимметричного гидрирования.
 Синтетические стратегии для установки ключевого стереоцентра в типранавире
Синтетические стратегии для установки ключевого стереоцентра в типранавире Кальциевая соль аторвастатин продается под торговой маркой Lipitor для снижения уровня холестерина в крови. Первый путь энантиоселективной медицинской химии к аторвастатину основывался на диастереоселективной альдольной реакции с хиральным сложным эфиром для установления одного из двух стереоцентров спирта. В коммерческом пути к аторвастатину этот стереоцентр переносится из легко доступной изоаскорбиновой кислоты.
 Синтетические стратегии для установки ключевого стереоцентра в аторвастатине
Синтетические стратегии для установки ключевого стереоцентра в аторвастатине