Асимметричное гидрирование - это химическая реакция, которая добавляет два атома водорода предпочтительно к одной из двух сторон ненасыщенной молекулы субстрата, такой как алкен или кетон. Селективность обусловлена тем, как субстрат связывается с хиральными катализаторами. На жаргоне это связывание передает пространственную информацию (то, что химики называют хиральностью ) от катализатора к мишени, отдавая предпочтение продукту как единственному энантиомеру. Эта ферментативная -подобная селективность особенно применяется к биоактивным продуктам, таким как фармацевтические агенты и агрохимикаты.

.
Общее асимметричное гидрирование N-ацетилдегидроаминокислотВ 1956 году было показано, что гетерогенный катализатор из палладия, нанесенный на шелк, вызывает асимметричное гидрирование. Позднее, в 1968 году, группы Уильям Ноулз и Леопольд Хорнер независимо опубликовали примеры асимметричного гидрирования с использованием гомогенных катализаторов. Хотя эти ранние реакции демонстрируют лишь скромные избытки энантиомеров, они продемонстрировали осуществимость. К 1972 году был достигнут 90% энантиомерный избыток, и с использованием этой технологии был начат первый промышленный синтез препарата Паркинсона L-DOPA.
 L-DOPA
L-DOPA В области асимметричного гидрирования продолжался ряд заметных достижений. Анри Каган разработал ДИОП, легко получаемый С 2 -симметричный дифосфин, который давал высокие эи в некоторых реакциях. Рёдзи Нойори представил катализаторы на основе рутения для асимметричных гидрированных полярных субстратов, таких как кетоны и альдегиды. Введение P, N-лигандов затем еще больше расширило сферу применения C 2 -симметричных лигандов, хотя они принципиально не превосходят хиральные лиганды, лишенные ротационной симметрии. Сегодня асимметричное гидрирование является рутинной методологией в лабораторной и промышленной органической химии.
Важность асимметричного гидрирования была признана Нобелевской премией по химии 2001 года, присужденной Уильяму Стэндишу Ноулзу и Рёдзи Нойори.
Для каталитического гидрирования с комплексами родия были предложены два основных механизма : ненасыщенный механизм и дигидридный механизм . Хотя различить эти два механизма сложно, различие между ними для асимметричного гидрирования относительно неважно, поскольку оба сходятся к общему промежуточному продукту до того, как какая-либо стереохимическая информация передается в молекулу продукта.
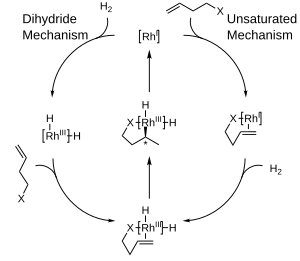
.
Предлагаемые механизмы асимметричного гидрирования. предпочтение получения одного энантиомера вместо другого в этих реакциях часто объясняется стерическими взаимодействиями между лигандом и прохиральным субстратом. Рассмотрение этих взаимодействий привело к разработке квадрантных диаграмм, где «заблокированные» области обозначены заштрихованной рамкой, а «открытые» области оставлены незаполненными. В смоделированной реакции большие группы на входящем олефине будут стремиться ориентироваться, чтобы заполнить открытые области диаграммы, в то время как меньшие группы будут направлены в заблокированные области, и тогда доставка водорода будет происходить на заднюю поверхность. олефина, фиксируя стереохимию. Обратите внимание, что для ясности показана только часть хирального фосфинового лиганда.

.
Квадрантная модель для асимметричного гидрированияРодий, первый металл, который будет использоваться в гомогенном асимметричном гидрировании, по-прежнему широко используется. Мишени для асимметричного гидрирования с родием обычно требуют наличия координирующей группы, близкой к олефину. Хотя это требование является ограничением, многие классы субстратов обладают такой функционализацией, например ненасыщенные амиды.
Асимметричное гидрирование Нойори основано на рутении. Последующая работа расширила исходную матрицу катализатора Нойори, что привело к включению традиционно сложных субстратов, таких как трет-бутилкетоны и 1-тетралоны, в качестве жизнеспособных субстратов для гидрирования с рутениевыми катализаторами. Гидрирование с переносом на основе Ru и Ts DPEN также имело коммерческий успех.
Иридиевые катализаторы полезны для ряда «нетрадиционных» субстратов, для которых не было найдено хороших катализаторов с Ru и Rh. Нефункциональные олефины являются типичным случаем, но существуют и другие примеры, включая кетоны. Общей проблемой катализаторов на основе иридия является их склонность к тримеризации в растворе. Использование некоординирующего аниона BAr. 4 оказалось наиболее широко применимым решением проблемы агрегации. Другие стратегии повышения стабильности катализатора включают добавление дополнительной координирующей ветви к хиральному лиганду, увеличение стерической массы лиганда, использование дендримерного лиганда, увеличение жесткости лиганда, иммобилизация лиганда и с использованием гетеробиметаллических систем (с иридием в качестве одного из металлов).
Железо - популярный объект исследований для многих каталитических процессов, в основном из-за его низкой стоимости и низкой токсичности по сравнению с другими переходные металлы. Реализованы методы асимметричного гидрирования с использованием железа, хотя по скорости и селективности они уступают катализаторам на основе драгоценных металлов. В некоторых случаях структурно плохо определенные наночастицы оказались активными частицами in situ, и наблюдаемая умеренная селективность может быть результатом их неконтролируемой геометрии.
Хиральные фосфиновые лиганды, особенно C2-симметричные лиганды, являются источником хиральности в большинстве асимметричных катализаторов гидрирования. Из них лиганд BINAP хорошо известен в результате его применения, удостоенного Нобелевской премии, в асимметричном гидрировании по Нойори.
Хиральные фосфиновые лиганды обычно можно классифицировать как моно- или двузубый. Их можно дополнительно классифицировать по расположению стереогенного центра - фосфор по сравнению с органическими заместителями. Лиганды с элементом симметрии C 2 были особенно популярны, отчасти потому, что присутствие такого элемента резко снижает возможные конформации связывания субстрата с комплексом металл-лиганд (часто приводя к исключительной энантиоселективности).
Лиганды монофосфинового типа были одними из первых, которые появились при асимметричном гидрировании, например, лиганд CAMP. В ходе продолжающихся исследований этих типов лигандов были изучены лиганды, связанные как с P-алкилом, так и с P-гетероатомом, при этом лиганды с P-гетероатомом, такие как фосфиты и фосфорамидиты, в целом достигли более впечатляющих результатов. Структурные классы лигандов, которые оказались успешными, включают те, которые основаны на бинафтильной структуре MonoPHOS или спиро-кольцевой системе SiPHOS. Примечательно, что эти монодентатные лиганды можно использовать в комбинации друг с другом для достижения синергетического улучшения энантиоселективности; то, что невозможно с дифосфиновыми лигандами.
 A ферроценовыми производными
A ферроценовыми производными  CAMP-лигандами
CAMP-лигандами  A BINOL производными
A BINOL производными дифосфиновые лиганды имеют получили значительно больше внимания, чем монофосфины, и, возможно, как следствие, имеют гораздо более длинный список достижений. Этот класс включает первый лиганд для достижения высокой селективности (DIOP ), первый лиганд, который будет использоваться в промышленном асимметричном синтезе (DIPAMP ), и, вероятно, наиболее известный хиральный лиганд (BINAP). Хиральные дифосфиновые лиганды теперь повсеместно используются при асимметричном гидрировании.

.
Исторически важные дифосфиновые лиганды Общая архитектура лиганда PHOX
Общая архитектура лиганда PHOX  Эффективный лиганд для различных процессов асимметричного гидрирования
Эффективный лиганд для различных процессов асимметричного гидрирования Использование лигандов P, N в асимметричное гидрирование можно проследить до C 2 симметричного бисоксазолинового лиганда. Однако эти симметричные лиганды вскоре были заменены моно оксазолиновыми лигандами, отсутствие симметрии C 2 никоим образом не ограничивает их эффективность в асимметричном катализе. Такие лиганды обычно состоят из ахирального азотсодержащего гетероцикла, который функционализирован боковым фосфорсодержащим плечом, хотя как точная природа гетероцикла, так и фосфорный центр химического окружения широко варьировались. Ни одна из структур не оказалась неизменно эффективной с широким диапазоном субстратов, хотя были установлены определенные привилегированные структуры (такие как архитектура фосфин-оксазолин или PHOX ). Более того, в рамках узко определенного класса субстратов характеристики металлических комплексов с хиральными лигандами P, N могут близко приблизиться к идеальному превращению и селективности в системах, которые иначе очень трудно достичь. Некоторые комплексы, полученные из хелатирующих лигандов PO, показали многообещающие результаты в гидрировании α, β-ненасыщенных кетонов и сложных эфиров.
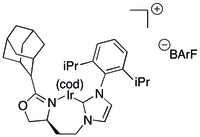 Катализатор, разработанный Burgess для асимметричного гидрирования
Катализатор, разработанный Burgess для асимметричного гидрирования Простые лиганды на основе N-гетероциклического карбена (NHC) оказались непрактичными для асимметричного гидрирования.
Некоторые лиганды C, N объединяют NHC с хиральным оксазолином с образованием хелатирующего лиганда. Лиганды на основе NHC первого типа были созданы в виде больших библиотек в результате реакции меньших библиотек индивидуальных NHC и оксазолинов. Катализаторы на основе NHC, содержащие объемный семичленный металлоцикл на иридии, применялись для каталитического гидрирования нефункционализированных олефинов и спиртов винил простых эфиров с конверсиями и ее значениями в высоких 80-90 или 90-х годах. Та же самая система была применена к синтезу ряда альдольных, вицинальных диметиловых и дезоксиполикетидных мотивов, а также к самим дезоксиполикетидам.
C2-симметричные NHC оказались очень полезными лигандами для асимметричного гидрирования.
Ациклические ненасыщенные субстраты (олефины, кетоны, енамины имины ) представляют собой наиболее распространенные прохиральные субстраты. Субстраты, которые особенно поддаются асимметричному гидрированию, часто имеют полярную функциональную группу, прилегающую к сайту, который необходимо гидрировать. В отсутствие этой функциональной группы катализ часто приводит к снижению ее. Для нефункционализированных олефинов иридий с лигандами на основе P, N) оказались успешными катализаторами. Использование катализатора в этой категории необычно узко; следовательно, возникло множество различных категорий решенных и нерешенных каталитических проблем. 1,1-дизамещенные, 1,2-диарилтризамещенные, 1,1,2-триалкил- и тетразамещенные олефины представляют классы, которые были исследованы отдельно, и даже в пределах этих классов могут существовать вариации, которые делают различные решения оптимальными.

.
асимметричное гидрирование нефункционализированных олефинов.
 Хиральные фосфорамидитные и фосфонитные лиганды, используемые в асимметричном гидрировании енаминов.
Хиральные фосфорамидитные и фосфонитные лиганды, используемые в асимметричном гидрировании енаминов. В отличие от олефинов, асимметричное гидрирование енаминов имеет предпочтение лигандам дифосфинового типа; отличные результаты были достигнуты с системами на основе как иридия, так и родия. Однако даже самые лучшие системы часто страдают от низкого ее и отсутствия универсальности. Некоторые енамины ароматических кетонов, производные пирролидина, поддаются асимметричному гидрированию с помощью катионных систем фосфонита родия (I), а I 2 и система уксусной кислоты со значениями э.и. обычно выше 90% и потенциально достигает 99,9%. Аналогичная система с использованием иридия (I) и очень близкого родственного фосфорамидитного лиганда эффективна для асимметричного гидрирования енаминов пирролидинового типа, где двойная связь находится внутри кольца: другими словами, дигидропирролов. В обоих случаях энантиоселективность существенно снижалась при увеличении размера кольца с пяти до шести.
 Катализатор Нойори для асимметричного гидрирования кетонов.
Катализатор Нойори для асимметричного гидрирования кетонов. Кетоны и имины являются родственными функциональными группами, и эффективными технологиями асимметричного гидрирования каждой из них являются также тесно связаны. Из них система рутений-хиральный дифосфин-диамин Нойори, пожалуй, одна из самых известных. Его можно использовать в сочетании с широким спектром фосфинов и аминов (где амин может быть, но не обязательно, хиральным) и его можно легко отрегулировать для оптимального соответствия с целевым субстратом, обычно достигая энантиомерных избытков (ee's) более 90%.
Для карбонильных и иминных субстратов, концевая координация η может конкурировать с η-модой. Для η-связанных субстратов водород-акцепторный углерод удаляется из катализатора и сопротивляется гидрированию.
Системы на основе иридия / P, N-лиганда также обычно используются для асимметричного гидрирования кетонов и иминов. Например, последовательная система для бензиловых арилиминов использует P, N-лиганд SIPHOX в сочетании с иридием (I) в катионном комплексе для достижения асимметричного гидрирования с ее>90%. Один из наиболее эффективных и действенных катализаторов, когда-либо разработанных для асимметричного гидрирования кетонов, с числом оборотов (TON) до 4550000 и ее до 99,9%, использует другую систему иридия (I) с близким родственный тридентатный лиганд.

.
Высокоэффективная система для асимметричного гидрирования кетоновНесмотря на их сходство, две функциональные группы не идентичны; есть много областей, где они значительно расходятся. Одним из них является асимметричное гидрирование N-нефункционализированных иминов с образованием первичных аминов. Избирательное восстановление таких частиц может быть затруднено, поскольку они склонны существовать в сложных равновесных состояниях имин- и енаминовых таутомеров, а также (E) и (Z) изомеров. Один из подходов к этой проблеме заключался в использовании кетиминов в качестве их гидрохлоридной соли и в зависимости от стерических свойств соседних алкильных или арильных групп, чтобы катализатор мог различать две энантиотопные грани кетимина.
Асимметричное гидрирование ароматических (особенно гетероароматических ) субстратов очень активное поле текущих исследований. Катализаторы в этой области должны бороться с рядом осложняющих факторов, включая тенденцию высокостабильных ароматических соединений сопротивляться гидрированию, потенциальную координирующую (и, следовательно, отравляющую катализатор) способность как субстрата, так и продукта, а также большое разнообразие моделей замещения, которые может присутствовать в любом ароматическом кольце. Из этих субстратов наиболее устойчивый успех был замечен с азотсодержащими гетероциклами, где ароматическое кольцо часто активируется либо протонированием, либо дальнейшей функционализацией азота (обычно электроноакцепторной защитной группой). Такие стратегии менее применимы к кислород- и серосодержащим гетероциклам, поскольку они и менее основные, и менее нуклеофильные; эта дополнительная трудность может помочь объяснить, почему существует мало эффективных методов их асимметричного гидрирования.
Существуют две системы для асимметричного гидрирования 2-замещенных хинолинов с изолированными выходами, как правило, более 80% и значениями ее, как правило, более 90 %. Первая представляет собой систему иридий (I) / хиральный фосфин / I 2, о которой впервые сообщили Zhou et al. В то время как первым хиральным фосфином, использованным в этой системе, был MeOBiPhep, более новые итерации были сосредоточены на улучшении характеристик этого лиганда. С этой целью в системах используются фосфины (или родственные лиганды) с повышенной стабильностью на воздухе, возможностью повторного использования, простотой приготовления, более низкой загрузкой катализатора и потенциальной ролью ахиральных фосфиновых добавок. По состоянию на октябрь 2012 года, похоже, не было предложено никакого механизма, хотя как необходимость I 2 или заменителя галогена, так и возможная роль гетероароматического азота в содействии реакционной способности были задокументированы.
Вторая представляет собой органокаталитическую систему гидрирования с переносом на основе сложных эфиров Ганча и хиральной кислоты Бренстеда. В этом случае авторы предполагают механизм, при котором изохинолин попеременно протонируется на стадии активации, а затем восстанавливается путем сопряженного добавления гидрида из эфира Ганча.
 .
.
Большая часть химии асимметричного гидрирования хиноксалинов тесно связан со структурно аналогичными хинолинами. Эффективные (и действенные) результаты могут быть получены с системой Ir (I) / фосфинит / I 2 и органокаталитической системой на основе эфира Ганца, обе из которых аналогичны системам, обсуждавшимся ранее в отношении хинолины.
Пиридины представляют собой субстраты с высокой вариабельностью для асимметричного восстановления (даже по сравнению с другими гетероароматическими соединениями) в том смысле, что пять углеродных центров доступны для дифференциального замещения в начальном кольце. По состоянию на октябрь 2012 года, похоже, не существует метода, который мог бы контролировать все пять, хотя существует по крайней мере один разумно общий метод.
Наиболее общий метод асимметричного гидрирования пиридина на самом деле является гетерогенным методом, в котором асимметрия создается за счет хирального оксазолидинона, связанного с положением C2 пиридина. Гидрирование таких функционализированных пиридинов на ряде различных гетерогенных металлических катализаторов дает соответствующий пиперидин с заместителями в положениях C3, C4 и C5 в полностью цис-геометрии, с высоким выходом и превосходной энантиоселективностью. Вспомогательный оксазолидинон также легко расщепляется в условиях гидрирования.

.
Асимметричное гидрирование пиридинов с гетерогенным катализаторомСпособы, разработанные специально для гидрирования 2-замещенного пиридина, могут включать асимметричные системы, разработанные для родственных субстратов, таких как 2-замещенные хинолины и хиноксалины. Например, система иридий (I) \ хиральный фосфин \ I 2 эффективна в асимметричном гидрировании активированных (алкилированных) 2-пиридиний или некоторых пиридинов, конденсированных с циклогексаноном. Аналогичным образом, хиральный катализ кислотой Бренстеда со сложным эфиром Ганца в качестве источника гидрида эффективен для некоторых 2-алкилпиридинов с дополнительным активирующим замещением.
Асимметричное гидрирование индолы первоначально были сосредоточены на N-защищенных индолах, где защитная группа могла служить как для активации гетероцикла для гидрирования, так и в качестве вторичного координационного центра для металла. Более поздние работы позволили нацелить незащищенные индолы посредством активации индола кислотой Бренстеда.
В первоначальном отчете об асимметричном гидрировании индола N-ацетил-2-замещенные индолы могли быть защищены с высокими выходами и ее э.и. 87-95%. 3-замещенные индолы были менее успешными, с гидролизом защитной группы, превосходящим гидрирование индола. Переключение на N-тозильную защитную группу ингибировало реакцию гидролиза и позволяло как 2-, так и 3-замещенные индолы гидрироваться с высоким выходом и ее э.и. Однако проблема с обоими методами состоит в том, что N-ацетильная и N-тозильная группы требуют жестких условий расщепления, которые могут быть несовместимы со сложными субстратами. Использование легко отщепляемой N-Boc-группы могло бы решить эту проблему, и вскоре были разработаны высокоэффективные методы асимметричного гидрирования таких индолов (как 2-, так и 3-замещенных).

.
Метод асимметричного гидрирования Boc-защищенных индоловНесмотря на эти успехи в асимметричном гидрировании защищенных индолов, можно добиться значительной простоты работы, если полностью удалить защитную группу. Это было достигнуто с помощью каталитических систем, использующих кислоты Бренстеда для активации индола. В исходной системе использовалась система Pd (TFA) 2 / H8-BINAP для достижения энантиоселективного цис-гидрирования 2,3- и 2-замещенных индолов с высоким выходом и отличным э.и. Подобный процесс, в котором последовательное алкилирование Фриделя-Крафтса и асимметричное гидрирование происходят в одном сосуде, позволяет селективно получать асимметричные 2,3-замещенные индолины из 2-замещенных индолов с одинаково высокими выходами и ее.

.
Последовательное алкилирование и асимметричное гидрирование 2-замещенных индоловМногообещающий органокаталитический метод асимметричного гидрирования 2,3-замещенных индолов с использованием хирального основания Льюиса также существует, хотя наблюдаемые ee's не совсем эквивалентны гидрированиям на основе металлов.
Достижение полного превращения пирролов в пирролидины путем асимметричного гидрирования имеет следующее Это оказалось трудным, поскольку часто наблюдаются продукты частичного гидрирования. Возможно полное энантиоселективное восстановление, при этом результат зависит как от исходного субстрата, так и от метода.
Асимметричное гидрирование 2,3,5-замещенных пирролов было достигнуто путем признания того, что такие субстраты имеют тот же образец замещения, что и 2-замещенные индолы, и системы асимметричного гидрирования, которая эффективна для одного из этих субстратов. может быть эффективным для обоих. Такой анализ привел к разработке основной системы рутений (I) / фосфин / амин для 2,3,5-замещенных N-Boc пирролов, которые могут давать либо дигидро, либо тетрагидропирролы (пирролидины), в зависимости от природы пиррольных заместителей.. Схема замещения полностью фенилом приводит к дигидропирролам с очень высоким выходом (>96%) и практически идеальной энантиоселективностью. Доступ к полностью гидрогенизированному полностью цис-дигидропирролу может быть осуществлен посредством диастереоселективного гетерогенного гидрирования. Алкильное замещение может привести либо к дигидро, либо к тетрагидропирролу, хотя выходы (>70%) и энантиоселективность (часто>90%) обычно остаются высокими. региоселективность в обоих случаях, по-видимому, определяется стерическими факторами, причем менее замещенный двойной предпочтительно гидрируется.

.
Асимметричное гидрирование 2,3,5-замещенных N-Boc пирроловНезащищенные 2,5-пирролы также могут быть асимметрично гидрированы с помощью метода, катализируемого кислотой Бренстеда / Pd (II) / хиральным фосфином, с получением соответствующих 2,5-дизамещенных 1- пирролинов примерно в 70 -80% выход и 80-90% ее.
Асимметричное гидрирование фуранов и бензофуранов до сих пор доказано испытывающий. Некоторые комплексы Ru-NHC катализируют асимметричное гидрирование бензофуранов и фуранов. с высоким уровнем энантиоиндукции.
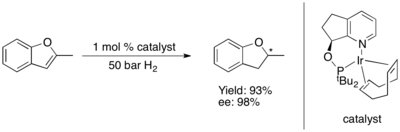
.
Асимметричное гидрирование фуранов и бензофурановКак и в случае с кислородсодержащими гетероциклами, асимметричное гидрирование соединений, в которых сера является частью исходных ненасыщенных система пи-связывания, по-видимому, до сих пор ограничивается тиофенами и бензотиофенами. Ключевой подход к асимметричному гидрированию этих гетероциклов включает катализатор рутений (II) и хиральный C 2 симметричный N-гетероциклический карбен (NHC). Эта система, по-видимому, обладает превосходной селективностью (ее>90%) и прекрасной диастереоселективностью (все цис), если субстрат имеет конденсированное (или непосредственно связанное) фенильное кольцо, но дает только рацемический продукт во всех других испытанных случаях.

.
Асимметричное гидрирование тиофенов и бензотиофеновГетерогенный катализатор для асимметричного гидрирования не был коммерциализирован.
Первое асимметричное гидрирование было сосредоточено на палладии, нанесенном на шелковую основу. Хина алкалоиды использовались в качестве хиральных модификаторов для энантиоселективного гидрирования.
 Цинхонидин, один из алкалоидов хинного дерева
Цинхонидин, один из алкалоидов хинного дерева Альтернативный метод, позволяющий лучше контролировать структурными и электронными свойствами активных каталитических центров является иммобилизация катализаторов, которые были разработаны для гомогенного катализа на гетерогенном носителе. Ковалентное связывание катализатора с полимером или другим твердым носителем, вероятно, является наиболее распространенным, хотя иммобилизация катализатора также может быть достигнута посредством адсорбции на поверхности, ионного обмена или даже физического инкапсуляция. Одним из недостатков этого подхода является возможность близости носителя к изменению поведения катализатора, понижая энантиоселективность реакции. Чтобы избежать этого, катализатор часто связывается с носителем с помощью длинного линкера, хотя известны случаи, когда близость носителя может фактически улучшить характеристики катализатора.
Окончательный подход включает в себя создание MOF, которые включают хиральные реакционные центры из ряда различных компонентов, потенциально включая хиральные и ахиральные органические лиганды, структурные ионы металлов, каталитически активные ионы металлов и / или предварительно собранные каталитически активные металлоорганические ядра. Один из них включает катализаторы на основе рутения. Всего 0,005 мол.% Таких катализаторов оказалось достаточным для достижения асимметричного гидрирования арилкетонов, хотя обычные условия содержали 0,1 мол.% Катализатора и приводили к энантиомерному избытку в размере 90,6–99,2%.

.
Активный центр гетерогенного катализатора на основе фосфоната циркония для асимметричного гидрирования (S, S) -Ro 67-8867
(S, S) -Ro 67-8867 Исследования компании Knowles по асимметричному гидрированию и его применению в промышленных масштабах Синтез L-допа дал асимметричное гидрирование сильное начало в промышленном мире. Обзор 2001 года показал, что на асимметричное гидрирование приходилось 50% производственных масштабов, 90% пилотных масштабов и 74% лабораторных каталитических энантиоселективных процессов в промышленности, с оговоркой, что асимметричные каталитические методы в целом еще не получили широкого распространения. 201>
Успех асимметричного гидрирования в промышленности можно увидеть в ряде конкретных случаев, когда замена методов, основанных на кинетическом разрешении, привела к существенному повышению эффективности процесса. Например, Catalysis Group компании Roche удалось добиться синтеза (S, S) -Ro 67-8867 с общим выходом 53%, что значительно превышает 3,5%, которые были достигнуты при синтезе на основе разрешения. Синтез мибефрадила компанией «Рош» также был улучшен за счет замены разрешения асимметричным гидрированием, уменьшения количества шагов на три и увеличения выхода ключевого промежуточного продукта с исходных 70% до 80%.
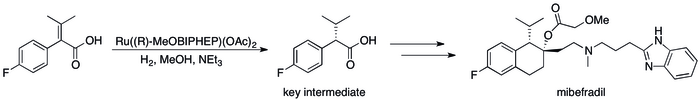
.
Асимметричное гидрирование в промышленный синтез мибефрадила