| Имена | |
|---|---|
| Название IUPAC Ацетат алюминия | |
| Другие имена Ацетат алюминия (III) | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.004.868 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
SMILES
| |
| Свойства | |
| Химическая формула | C6H9AlO 6 |
| Молярная масса | 204,114 г · моль |
| Внешний вид | белое твердое вещество |
| Растворимость в воде | растворимый |
| Родственные соединения | |
| Родственные соединения | Основное диацетат алюминия (диацетат гидроксиалюминия), CAS RN 142-03-0, HOAl (CH. 3CO. 2). 2. двухосновный моноацетат алюминия (ацетат дигидроксиалюминия), CAS RN 7360- 44-3, (HO). 2AlCH. 3CO. 2 |
| Если не указано иное, данные для материалов приведены в их стандарте состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Триацетат алюминия, формально называемый ацетат алюминия, является химическим веществом соединение с составом Al (CH. 3CO. 2). 3. В стандартных условиях он выглядит как белое водорастворимое твердое вещество, которое разлагается при нагревании примерно до 200 ° C. Триацетат гидролизуется до смеси основных гидроксид / ацетат солей, и несколько разновидностей сосуществуют в химическом равновесии, особенно в водном растворы ацетат-иона; для этой смешанной системы обычно используется название ацетат алюминия.
Он имеет терапевтическое применение благодаря своим противозудным, вяжущим и антисептическим свойствам, а также в качестве препарата, отпускаемого без рецепта как и раствор Буроу, он используется для лечения ушных инфекций. Препараты раствора Буроу были разбавлены и модифицированы аминокислотами, чтобы сделать их более вкусными для использования в качестве полосканий при таких состояниях, как афтозные язвы рот. В ветеринарии вяжущее свойство триацетата алюминия используется для лечения болезни Мортелларо у копытных животных, например крупного рогатого скота.
Триацетат алюминия используется в качестве протравы агент с красителями, такими как ализарин, как по отдельности, так и в комбинации. Вместе с диацетатом алюминия или с сульфататом алюминия он используется с хлопком, другими целлюлозными волокнами и шелком. Он также был объединен с ацетатом железа для получения различных цветов.
Согласно формальным правилам наименования неорганических соединений, название для Al (CH. 3CO. 2). 3- ацетат алюминия, хотя допустимы более формальные названия, такие как ацетат алюминия (III) и этаноат алюминия. Использование префикса «три» в названии триацетата алюминия, хотя технически не требуется, но регулярно используется, чтобы избежать возможной путаницы с родственными соединениями с гидроксолигандами. Основной диацетат алюминия, формально диацетат гидроксиалюминия (CAS RN 142-03-0), имеет состав HOAl (CH. 3CO. 2). 2с одним гидроксолигандом вместо ацетатного лиганда, и двухосновный моноацетат алюминия, формально ацетат дигидроксиалюминия (CAS RN 7360-44-3), имеет Положение (HO). 2AlCH. 3CO. 2только с одним ацетатным лигандом. Эти три соединения различаются в твердой фазе, но обычно рассматриваются как группа и вместе описываются как ацетат алюминия в растворе, поскольку триацетат гидролизуется до смеси, которая включает две другие формы. Аббревиатура AlAc вместе с вариантами, такими как AlAc. и AlAc. 2, иногда используется в дисциплине геохимия, хотя они несовместимы со стандартной практикой в основной химии.
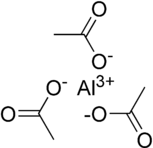
 Представления Al (CH. 3CO. 2). 3с ионными (слева) и ковалентными молекулярными (справа) мотивами
Представления Al (CH. 3CO. 2). 3с ионными (слева) и ковалентными молекулярными (справа) мотивами Формула Al (CH. 3CO. 2). 3указывает на присутствие металлических центров алюминия в группах степени окисления +3 и ацетат в соотношении 1: 3. Изображения, используемые для представления этого вещества, такие как те, что показаны слева, представляют два сильно чрезмерно упрощенные приближения твердотельной структуры: первая представляет собой чисто ионную соль с единственным катионом алюминия (III) (Al), окруженным и связанным электростатически с тремя ацетат-анионами (CH. 3CO. 2), но это не должно использоваться для передачи информации о кристаллической структуре. Например, хлорид натрия (NaCl) имеет катион- к-анион сто ichiometry 1: 1, но он имеет кубическую структуру, где каждый ион окружен октаэдрически шестью ионами с противоположным зарядом.
Другое изображение молекулярная форма с тремя ацетатными группами , ковалентно связанными с металлическим центром в тригональной планарной геометрии и межмолекулярными взаимодействиями, удерживающими молекулы вместе друг с другом в кристаллической структуре. Весьма вероятно, что структура твердого тела более сложная и включает как ковалентные, так и ионные характеристики, и возможно, что могут присутствовать несколько центров алюминия и / или мостиковых ацетатных групп - оба из них были описаны в раствор ацетата алюминия и хлорид алюминия известны как димер Al. 2Cl. 6.
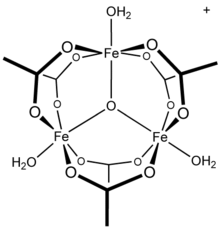 [Fe 3(μ3–O) (OAc) 6(H2O)3], катион обнаруженный в ацетате железа (III)
[Fe 3(μ3–O) (OAc) 6(H2O)3], катион обнаруженный в ацетате железа (III) ЯМР исследования водной системы алюминий (III) / ацетат показывают присутствие алюминия в виде гексааква комплекса, [Al (H. 2O). 6]., а также мононуклеарные частицы с различными заменами.Кроме того, исследования показывают, что существенной частью фазы раствора является Al. 13тридекамер, фрагмент, о котором сообщается в конфликтующих механизмах гидролиза и полимеризация растворов алюминия. Известно, что другие катионы трехвалентных металлов образуют полиядерные частицы: ацетат железа (III), например, образует трехъядерную структуру с трехмостиковым оксоцентром с катионом [Fe 3(μ 3–O) (OAc) 6(H2O)3]. Соединение гидроксид ацетата хрома, Cr 3 (OH) 2 (OAc) 7 также описано как изоструктурное. Известны аналогичные соединения рутения (III), ванадия (III), родия (III) и иридия (III) с трехъядерным строением. Ацетат меди (II) и хром (II)) ацетат оба имеют двухъядерные дигидратные структуры, M 2 (OAc) 4(H2O)2, как и ацетат родия (II) ; каждый демонстрирует значительные взаимодействия металл-металл.
Согласно CRC Handbook of Inorganic Compounds, триацетат алюминия представляет собой белое водорастворимое твердое вещество и обычно получают из хлорида алюминия или непосредственно из алюминия путем нагревания в растворе уксусной кислоты с уксусным ангидридом.
Теоретически весь алюминий / ацетат / гидроксид соли могут быть получены из гидроксида алюминия или алюмината натрия и уксусной кислоты, но образование триацетата происходит только в отсутствие воды. В растворах диацетат образуется основной продукт, который также образуется при обработке хлорида алюминия раствором ацетата натрия в основных условиях. Уравнения для этих процессов следующие:
Был запатентован улучшенный процесс с использованием комбинации хлорида алюминия и алюмината натрия с ацетатом натрия in situ :
протравы триацетат алюминия и сульфацетат алюминия могут быть приготовленным из сульфата алюминия, при этом образовавшийся продукт определяется количеством использованного ацетата свинца (II) :
) При нагревании триацетат алюминия разлагается выше 200 ° C по процессу, аналогичному процессу формиата алюминия. Процесс начинается с потери уксусного ангидрида (Ac. 2O) при температуре от 120 до 140 ° C с образованием смеси ацетатов основных оксидов, таких как Al. 2O (CH. 3CO. 2). 4и Al. 3O ( CH. 3CO. 2). 7, которые в конечном итоге превращаются в Al. 2O. 3(оксид алюминия ), сначала в виде аморфного безводного твердого вещества, а затем через другие твердые фазы (γ-, δ- и θ- формы кристаллов ), чтобы в конечном итоге стать полиморфным α-Al. 2O. 3:
Гидролиз триацетата алюминия с образованием как моно-, так и диосновного гидроксида ацетата в растворе или с помощью гигроскопии :
По данным Национального института рака, ацетаты алюминия используются местно в люди как антисептики, что также вызывает сокращение тканей тела. Его терпкость также используется для лечения болезни Мортелларо у копытных, таких как крупный рогатый скот. Ацетат алюминия способствует заживлению инфицированной кожи, а также помогает при воспалении, зуде и покалывании. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило его использование для «временного облегчения незначительных раздражений кожи, вызванных...» ядовитым плющом, «ядовитым дубом», ядом. сумах, «укусы насекомых», стопа спортсмена или «сыпь, вызванная мылом, моющими средствами, косметикой или ювелирными изделиями». Для этих применений без рецепта препараты, такие как раствор Бурова, обычно используются, а разбавленные формы используются в качестве полосканий при таких состояниях, как афтозные язвы ротовой полости, в том числе с аминокислотные добавки для улучшения вкусовых качеств и вкуса. Чаще всего раствор Бурова используется для лечения ушных инфекций, включая отомикоз, хотя он обычно не так эффективен, как клотримазол при этих грибковых инфекциях. Вяжущий порошок для местного применения Domeboro содержит тетрадекагидрат сульфата алюминия, [Al (H. 2O). 6]. 2(SO. 4). 3• 2H. 2O и моногидрат ацетата кальция, Ca (CH <294)>O, и при растворении образует раствор ацетата алюминия, аналогичный раствору Буроу. Растворы Домборо в теплой воде можно использовать в случаях вросших ногтей на ногах, чтобы уменьшить раздражение и сдержать любую инфекцию, которая может присутствовать.
 Структура Киля и Хертьеса для аниона Ca [Al (H. 2O) (OH) Az. 2] • 2H. 2O, который ализарин формы с алюминиевой протравой
Структура Киля и Хертьеса для аниона Ca [Al (H. 2O) (OH) Az. 2] • 2H. 2O, который ализарин формы с алюминиевой протравой Протрава - это вещество, используемое для закрепления красителей на тканях или срезах тканей путем образования координационного комплекса с красителем, который впоследствии прикрепляется к ткани или Протрава часто содержит поливалентный ион металла, обычно алюминия или железа, как в случае со смесями триацетата алюминия с сульфацетатом алюминия или с основным диацетатом алюминия. Протравочный материал на основе триацетата алюминия s использовались с хлопком, другими волокнами на основе целлюлозы и шелком. Они также были объединены с ацетатом железа для получения различных цветов.
 Структура Вундерлиха и Бергерхоффа для ализарина, связанного с алюминиевой протравой в виде CaAz. 2Al (μ-OH). 2AlAz. 2Ca
Структура Вундерлиха и Бергерхоффа для ализарина, связанного с алюминиевой протравой в виде CaAz. 2Al (μ-OH). 2AlAz. 2CaВ случае красителя ализарин (1,2-дигидрокси антрахинон, H. 2Az) предполагалось, что протравливание включает образование дианион ализарина. При этом образуется пятикоординатный алюминиевый комплекс CaAl (OH) Az. 2, который может поглощать воду с образованием гидрата с шестикоординированным алюминиевоцентрированным дианионом Ca [Al (H. 2O) (OH) Az. 2] • 2H. 2O. Предложение было основано на данных инфракрасной спектроскопии и впоследствии было оспорено работой, предполагающей структуру с двумя мостиковыми гидроксильными лигандами, соединяющими биядерное ядро, Az. 2Al (μ-OH). 2AlAz. 2, с двумя ализариновыми фрагментами, каждый хелатирует с каждым алюминиевым центром. Структура была предложена Soubayrol et al. на основе данных спектроскопии ЯМР Al и ионизации электрораспылением масс-спектрометрии. Они сообщили, что степень гидратации зависит от идентичности противоиона, при этом натриевая соль представляет собой стабильный тетрагидрат, а моногидрат образуется из гидроксида калия. Они были различимы по их химическим сдвигам, что позволяет предположить, что воды связаны с алюминиевыми центрами или ализариновыми фрагментами и не ведут себя, как типично для кристаллизационных вод.
Связанная структура с кальцием В 1994 г. сообщалось, что ализарины хелатируют с ионами кальция, образуя мосты AzCaAz между алюминиевыми центрами (которые также соединены гидроксогруппами), и алюминиевые центры впоследствии связываются с депротонированными фенольными остатками красителя; в модели Soubayrol каждый ализарин связан с одним катионом алюминия. Как и в случае с самой структурой ацетата алюминия, формы, которые он принимает в приложениях, не решены.
Этот «Ас» не относится к элементу актиний. Используемое таким образом соглашение в органической химии означает, что Ac относится к ацетильной группе, радикальной формой которой является CH. 3CO, и OAc или AcO могут использоваться для ацетатного радикала, CH. 3CO. 2, иногда также называемого «ацетокси». Тогда ацетат-ион будет AcO, CH364>, а уксусная кислота будет AcOH или HOAc. Согласно этому соглашению триацетат алюминия будет представлять собой Al (OAc) 3. Публикации в геохимии, однако, используют Ac для обозначения ацетата, а не ацетила, и поэтому AlAc. 2в геохимии будет записываться в соответствии с более обычными химическими соглашениями как [Al (OAc). 2]. или [Al (CH. 3CO. 2). 2]..
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be (OAc) 2. BeAcOH | AcOAc. ROAc | NH4OAc | AcOOH | FAc | Ne | |||||||||||||
| NaOAc | Mg (OAc) 2 | Al (OAc) 3. ALSOL. Al (OAc) 2OH. Al2SO4(OAc) 4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc) 2 | Cr (OAc) 2. Cr (OAc) 3 | Mn (OAc) 2. Mn (OAc) 3 | Fe (OAc) 2. Fe (OAc) 3 | Co (OAc) 2,. | Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ge | Se | BrAc | Kr | |||||||
| Y (OAc) 3 | Nb | Mo (OAc) 2 | Tc | .. | Rdiv class="ht"(OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | In | . | Sb (OAc) 3 | Te | IAc | Xe | |||||
| CsOAc | Ba (OAc) 2 | Hf | Ta | W | Re | Os | Ir | Pt (OAc) 2 | Au | ,. Hg (OAc) 2 | TlOAc. | Pb ( OAc) 2. Pb (OAc) 4 | Bi (OAc) 3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Pr | Nd | Pm | Tb | Er | Tm | ||||||||||||||
| Ac | Th | Па | UO2(OAc) 2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | № | Lr | |||||