Войти
 | |
 . Кристаллы ацетата кальция . Кристаллы ацетата кальция | |
| Имена | |
|---|---|
| Название IUPAC Ацетат кальция | |
| Другие названия Ацетат извести. Этаноат кальция. Диацетат кальция | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Аббревиатуры | Ca (OAc) 2 |
| Ссылка Beilstein | 3692527 |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.492 |
| Номер EC |
|
| Номер E | E263 (консерванты) |
| Ссылка на Гмелин | 22320 |
| KEGG | |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБАЕТСЯ
| |
| Свойства | |
| Химическая формула | C4H6CaO 4 |
| Молярная масса | 158,166 г · моль |
| Внешний вид | Белое твердое вещество. гигроскопично |
| Запах | слабый уксусная кислота запах |
| Плотность | 1,509 г / см |
| Температура плавления | 160 ° C (320 ° F; 433 K) разложение до CaCO 3 + ацетон |
| Растворимость в воде | 37,4 г / 100 мл (0 ° C). 34,7 г / 100 мл (20 ° C). 29,7 г / 100 мл (100 ° C) |
| Растворимость | мало растворим в метаноле, гидразин. нерастворим в ацетоне, этанол и бензол |
| Кислотность (pK a) | около 0,7 |
| Магнитная восприимчивость (χ) | -70,7 · 10 см / моль |
| преломляющая способность индекс (nD) | 1,55 |
| Фармакология | |
| Код АТС | V03AE07 (ВОЗ ) |
| Опасности | |
| NFPA 704 (огненный ромб) |  1 1 0 1 1 0 |
| Самовоспламенение. температура | от 680 до 730 ° C (от 1256 до 1346 ° F; от 953 до 1003 K) |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 4280 мг / кг (перорально, крыса) |
| Родственные соединения | |
| Другие катионы | Ацетат магния |
| Если не указано иное, данные приводятся для материалов в их стандартном состоянии (при 25 ° C [ 77 ° F], 100 кПа). | |
| Ссылки в ink | |
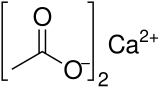
Ацетат кальция - это химическое соединение, которое i s кальциевая соль и уксусная кислота. Он имеет формулу Ca (C 2H3O2)2. Стандартное название - ацетат кальция, систематическое название - этаноат кальция . Старое название - ацетат извести . безводная форма очень гигроскопична ; поэтому моно гидрат (Ca (CH 3 COO) 2•H2O) является обычной формой.
Ацетат кальция можно получить путем вымачивания карбоната кальция (содержится в яичной скорлупе или в обычных карбонатных породах, таких как известняк или мрамор ) или гашеная известь в уксусе:
Поскольку оба реагента были доступны доисторически, тогда химическое вещество можно было бы наблюдать в виде кристаллов.
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be (OAc) 2. BeAcOH | AcOAc. ROAc | NH4OAc | AcOOH | FAc | Ne | |||||||||||||
| NaOAc | Mg (OAc) 2 | Al (OAc) 3. ALSOL. Al (OAc) 2OH. Al2SO4(OAc) 4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc) 2 | Cr (OAc) 2. Cr (OAc) 3 | Mn (OAc) 2. Mn (OAc) 3 | Fe (OAc) 2. Fe ( OAc) 3 | Co (OAc) 2,. | Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ge | Se | BrAc | Kr | |||||||
| Y (OAc) 3 | Nb | Mo (OAc) 2 | Tc | .. | Rdiv class="ht"(OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | In | . | Sb (OAc) 3 | Te | IAc | Xe | |||||
| CsOAc | Ba (OAc) 2 | Hf | Ta | W | Re | Os | Ir | Pt (OAc) 2 | Au | ,. Hg (OAc) 2 | TlOAc. | Pb (OAc) 2. Pb (OAc) 4 | Bi (OAc) 3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | DS | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Pr | Nd | Pm | Tb | Er | Tm | ||||||||||||||
| Ac | Th | Па | UO2(OAc) 2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | № | Lr | |||||