 | |
| Названия | |
|---|---|
| Систематическое название IUPAC Гексакис (μ-ацетат) -μ (sup 4) -oxotetraberyllium | |
| Другие названия Оксиацетат бериллия. Ацетат оксида бериллия | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.038. 881 |
| Номер EC |
|
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
УЛЫБАЕТСЯ
| |
| Свойства | |
| Химическая формула | C. 12H. 18Be. 4O. 13 |
| Молярная масса | 406,3122 г / моль |
| Внешний вид | бесцветный |
| Точка плавления | 285 ° C (545 ° F; 558 K) |
| Точка кипения | 330 ° C (626 ° F; 603 K) |
| Растворимость в хлороформе | растворим |
| Опасности | |
| Основные опасности | высокотоксичный |
| NIOSH (пределы воздействия на здоровье США): | |
| PEL (допустимый) | TWA 0,002 мг / м. C 0,005 мг / м (30 минут) с максимальным пиком 0,025 мг / м (как Be) |
| REL (рекомендуется) | Ca C 0,0005 мг / м (как Be) |
| IDLH (непосредственная опасность) | Ca [4 мг / м (в виде Be)] |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа | |
| Ссылки в информационном окне | |
Основной ацетат бериллия - это химическое соединение с формулой Be 4 O (O 2 CCH 3)6. Это соединение имеет отличительную структуру, но не имеет применения и мало изучено. Это бесцветное твердое вещество, которое растворимо в органических растворителях.
Его можно получить путем обработки основного карбоната бериллия горячей уксусной кислотой.
Основной ацетат бериллия нерастворим в воде, но растворим в хлороформе, что согласуется с его неполярностью. Он плавится и сублимируется в вакууме без разложения.
«Основные ацетаты » состоят из ансамбля металлических центров, связанных с центральным оксидным ионом, и набора ацетатных лигандов. Основной ацетат бериллия имеет тетраэдрическое ядро Be 4 O с ацетатами (CH 3CO2), охватывающими каждую из пар Be-центров. Он состоит из сцепленных шестичленных колец Be 2O3C. Структура имеет отношение к его значительной стабильности (соединение перегоняется при 330 ° C).
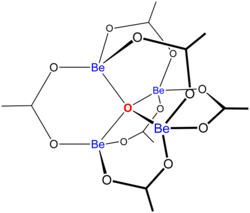
Растворимость соли в органических растворителях (хлороформе) полезна для экстракции и очистки фракций, богатых бериллием, для многих целей. Монокристаллы основного ацетата бериллия можно легко выращивать, они полезны для юстировки рентгеновских дифрактометров, а также в качестве эталона в кристаллографии белков.
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be (OAc) 2. BeAcOH | AcOAc. ROAc | NH4OAc | AcOOH | FAc | Ne | |||||||||||||
| NaOAc | Mg (OAc) 2 | Al (OAc) 3. ALSOL. Al (OAc) 2OH. Al2SO4(OAc) 4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc) 2 | Cr (OAc) 2. Cr (OAc) 3 | Mn (OAc) 2. Mn (OAc) 3 | Fe (OAc) 2. Fe (OAc) 3 | Co (OAc) 2,. | Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ge | Se | BrAc | Kr | |||||||
| Y (OAc) 3 | Nb | Mo (OAc) 2 | Tc | .. | Rdiv class="ht"(OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | In | . | Sb (OAc) 3 | Te | IAc | Xe | |||||
| CsOAc | Ba (OAc) 2 | Hf | Ta | W | Re | Os | Ir | Pt (OAc) 2 | Au | ,. Hg (OAc) 2 | TlOAc. | Pb (OAc) 2. Pb (OAc) 4 | Bi (OAc) 3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Pr | Nd | Pm | Tb | Er | Tm | ||||||||||||||
| Ac | Th | Па | UO2(OAc) 2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | Нет | Lr | |||||