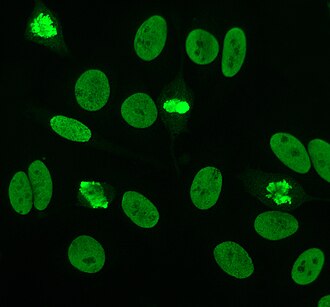
 Гомогенное иммунофлуоресцентное окрашивание, двухцепочечный ДНК-антитела к клеткам HEp-20-10. Интерфазные клетки показывают гомогенное ядерное окрашивание, в то время как митотические клетки показывают окрашивание областей конденсированных хромосом.
Гомогенное иммунофлуоресцентное окрашивание, двухцепочечный ДНК-антитела к клеткам HEp-20-10. Интерфазные клетки показывают гомогенное ядерное окрашивание, в то время как митотические клетки показывают окрашивание областей конденсированных хромосом. Антинуклеарные антитела (ANA, также известные как антинуклеарный фактор или ANF ) представляют собой аутоантитела, которые связываются с содержимым ядра клетки. У нормальных людей иммунная система вырабатывает антитела к чужеродным белкам (антигенам ), но не к человеческим белкам (аутоантигенам ). У некоторых людей вырабатываются антитела к человеческим антигенам.
Существует много подтипов ANA, таких как анти-Ro-антитела, анти-La-антитела, антитела против Sm, антитела против нРНП, антитела против Scl-70, антитела против дцДНК, антитела против гистонов, антитела к комплексам ядерных пор, антицентромерные антитела и анти-sp100 антитела. Каждый из этих подтипов антител связывается с различными белками или белковыми комплексами в ядре. Они обнаруживаются при многих заболеваниях, включая аутоиммунитет, рак и инфекцию, с различной распространенностью антител в зависимости от состояния. Это позволяет использовать АНА для диагностики некоторых аутоиммунных заболеваний, включая системную красную волчанку, синдром Шегрена, склеродермию, смешанное заболевание соединительной ткани, полимиозит, дерматомиозит, аутоиммунный гепатит и волчанка, вызванная лекарствами.
Тест ANA выявляет аутоантитела, присутствующие в сыворотка крови. Обычными тестами, используемыми для обнаружения и количественного определения ANA, являются непрямая иммунофлуоресценция и твердофазный иммуноферментный анализ (ELISA). При иммунофлуоресценции уровень аутоантител указывается как титр. Это самое высокое разведение сыворотки, при котором аутоантитела еще обнаруживаются. Положительные титры аутоантител при разведении, равном или превышающем 1: 160, обычно считаются клинически значимыми. Положительные титры менее 1: 160 присутствуют у 20% здорового населения, особенно у пожилых людей. Хотя положительные титры 1: 160 или выше сильно связаны с аутоиммунными нарушениями, они также обнаруживаются у 5% здоровых людей. Скрининг на аутоантитела полезен при диагностике аутоиммунных заболеваний, а мониторинг уровней помогает предсказать прогрессирование заболевания. Положительный тест на ANA редко бывает полезным, если отсутствуют другие клинические или лабораторные данные, подтверждающие диагноз.
Человеческое тело имеет множество защитных механизмов против патогенов, одним из которых является гуморальный иммунитет. Этот защитный механизм вырабатывает антитела (большие гликопротеины ) в ответ на иммунный стимул. Для этого процесса требуется множество клеток иммунной системы, включая лимфоциты (Т-клетки и В-клетки ) и антигенпрезентирующие клетки <55.>. Эти клетки координируют иммунный ответ при обнаружении чужеродных белков (антигены ), продуцируя антитела, которые связываются с этими антигенами. В нормальной физиологии лимфоциты, распознающие человеческие белки (аутоантигены ), либо подвергаются запрограммированной гибели клеток (апоптоз ), либо становятся нефункциональными. Эта самотолерантность означает, что лимфоциты не должны вызывать иммунный ответ против клеточных антигенов человека. Однако иногда этот процесс нарушается и вырабатываются антитела против человеческих антигенов, что может привести к аутоиммунному заболеванию.
ANA обнаруживаются при многих заболеваниях, а также у некоторых здоровых людей. К этим заболеваниям относятся: системная красная волчанка (СКВ), ревматоидный артрит, синдром Шегрена, склеродермия, полимиозит, дерматомиозит, первичный билиарный цирроз, лекарственная волчанка, аутоиммунный гепатит, рассеянный склероз, дискоидная волчанка, заболевание щитовидной железы, антифосфолипидный синдром, ювенильный идиопатический артрит, псориатический артрит, ювенильный дерматомиозит, идиопатическая тромбоцитопеническая пурпура, инфекция и рак. Эти антитела можно подразделить в соответствии с их специфичностью, и каждая подгруппа имеет различную предрасположенность к конкретным нарушениям.
Экстрагируемые ядерные антигены (ENA) представляют собой группу аутоантигенов, которые изначально были определены как мишени для антител у людей с аутоиммунными заболеваниями. Их называют ENA, потому что они могут быть извлечены из ядра клетки с помощью физиологического раствора. ENA состоят из рибонуклеопротеинов и не гистонов белков, названных либо по имени донора, который предоставил прототип сыворотки (Sm, Ro, La, Jo), либо по имени условия заболевания, при котором были обнаружены антитела (SS-A, SS-B, Scl-70).
 Speckled Иммунофлуоресценция картина окрашивания антиядерных антител на клетках HEp-20-10. Этот образец окрашивания наблюдается с антителами против Ro и против La.
Speckled Иммунофлуоресценция картина окрашивания антиядерных антител на клетках HEp-20-10. Этот образец окрашивания наблюдается с антителами против Ro и против La. Антитела против Ro и против La, также известные как SS-A и SS-B, соответственно, являются обычно встречается при первичном синдроме Шегрена, аутоиммунном заболевании, которое поражает экзокринные железы. Присутствие обоих антител обнаруживается при 30–60% синдрома Шегрена, только анти-Ro антитела обнаруживаются при 50–70% синдрома Шегрена и 30% СКВ с поражением кожи, а антитела против La редко встречаются изолированно.. Антитела против La также обнаруживаются при СКВ; однако синдром Шегрена обычно также присутствует. Антитела Anti-Ro также реже обнаруживаются при других заболеваниях, включая аутоиммунные заболевания печени, целиакию, аутоиммунные ревматические заболевания, сердечную неонатальную красную волчанку и полимиозит. Во время беременности анти-Ro-антитела могут проникать через плаценту и вызывать блокаду сердца и неонатальную волчанку у младенцев. При синдроме Шегрена анти-Ro и анти-La антитела коррелируют с ранним началом, увеличением продолжительности заболевания, увеличением околоушной железы, поражением вне желез и инфильтрацией желез лимфоцитами. Антитела Anti-Ro специфичны для компонентов комплекса Ro-RNP, включающего белки 45 кДа, 52 кДа, 54 кДа и 60 кДа и РНК. Связывающий белок 60 кДа ДНК / РНК и регуляторный белок 52 кДа Т-клеток являются наиболее охарактеризованными антигенами анти-Ro-антител. В совокупности эти белки являются частью комплекса рибонуклеопротеина (RNP), который связывается с гиРНК, hY1-hY5. Антиген La представляет собой фактор терминации транскрипции 48 кДа РНК-полимеразы III, который связывается с комплексом Ro-RNP.
Механизм продукции антител при синдроме Шегрена следующий. не до конца изучен, но апоптоз (запрограммированная гибель клеток) и молекулярная мимикрия могут иметь значение. Антигены Ro и La экспрессируются на поверхности клеток, подвергающихся апоптозу, и могут вызывать воспаление в слюнной железе путем взаимодействия с клетками иммунной системы. Антитела также могут быть получены с помощью молекулярной мимикрии, когда перекрестно реактивные антитела связываются как с вирусными, так и с человеческими белками. Это может происходить с одним из антигенов, Ro или La, и впоследствии может продуцироваться антитела к другим белкам посредством процесса, известного как распространение эпитопа. Ретровирусный белок gag проявляет сходство с белком La и предлагается в качестве возможного примера молекулярной мимикрии при синдроме Шегрена.
Anti-Smith (Anti-Sm) антитела представляют собой очень специфический маркер для СКВ. Приблизительно 99% людей без СКВ не имеют антител к Sm, но только 20% людей с СКВ имеют антитела. Они связаны с поражением центральной нервной системы, заболеванием почек, фиброзом легких и перикардитом при СКВ, но не связаны с заболеванием деятельность. Антигены антител против Sm являются основными единицами малых ядерных рибонуклеопротеинов (snRNP), обозначенных от A до G, и будут связываться с snRNP U1, U2, U4, U5 и U6. Чаще всего антитела специфичны для единиц B, B 'и D. Молекулярные и эпидемиологические исследования показывают, что антитела против Sm могут быть индуцированы молекулярной мимикрией, поскольку белок демонстрирует некоторое сходство с белками вируса Эпштейна-Барра.
Антитела против ядерного рибонуклеопротеина (анти-нРНП), также известные как антитела против U1-RNP, обнаруживаются в 30–40% случаев СКВ. Они часто обнаруживаются с антителами против Sm, но могут быть связаны с различными клиническими ассоциациями. Помимо СКВ, эти антитела сильно связаны с смешанным заболеванием соединительной ткани. Антитела против nRNP распознают ядерные единицы A и C snRNP, и поэтому они в первую очередь связываются с U1-snRNP. Иммунный ответ на РНП может быть вызван представлением ядерных компонентов на клеточной мембране в виде апоптических пузырьков. Молекулярная мимикрия также была предложена в качестве возможного механизма продукции антител к этим белкам из-за сходства полипептидов U1-RNP и полипептидов вируса Эпштейна-Барра.
Антитела против Scl-70 связаны с склеродермией. Чувствительность антител к склеродермии составляет примерно 34%, но выше для случаев с диффузным поражением кожи (40%) и ниже для ограниченного поражения кожи (10%). Специфичность антител составляет 98% и 99,6% при других ревматических заболеваниях и у здоровых людей соответственно. Помимо склеродермии, эти антитела обнаруживаются примерно у 5% людей с СКВ. Антигенной мишенью антител против Scl-70 является топоизомераза I.
Хотя анти-Jo-1 антитела часто входят в состав ANA, на самом деле они являются антителами к цитоплазматической белок, гистидил-тРНК-синтетаза - аминоацил-тРНК-синтетаза, необходимая для синтеза тРНК, нагруженной гистидином. Они тесно связаны с полимиозитом и дерматомиозитом и редко встречаются при других заболеваниях соединительной ткани. Около 20–40% случаев полимиозита являются положительными на антитела к Jo-1, и у большинства из них имеется интерстициальное заболевание легких, маркеры HLA-DR3 и HLA-DRw52 человеческий лейкоцитарный антиген (HLA); под общим названием синдром Jo-1.
 антитело к дцДНК. Вариабельные области (желтый) комплементарны цепям дцДНК. Эти антитела обычно обнаруживаются в сыворотке крови людей с СКВ.
антитело к дцДНК. Вариабельные области (желтый) комплементарны цепям дцДНК. Эти антитела обычно обнаруживаются в сыворотке крови людей с СКВ. Антитела против двухцепочечной ДНК (анти-дцДНК) сильно связаны с СКВ. Они являются очень специфическим маркером заболевания, при этом в некоторых исследованиях цитируется почти 100%. Данные по чувствительности колеблются в пределах 25–85%. Уровни антител против дцДНК, известные как титры, коррелируют с активностью заболевания при СКВ; высокие уровни указывают на более активную волчанку. Наличие антител против дцДНК также связано с волчаночным нефритом, и есть доказательства, что они являются причиной. Некоторые антитела против дцДНК обладают перекрестной реактивностью с другими антигенами, обнаруженными на базальной мембране клубочка (GBM) почек, такими как гепарансульфат, коллаген IV, фибронектин и ламинин. Связывание с этими антигенами в почках может вызвать воспаление и фиксацию комплемента, что приведет к повреждению почек. Было показано, что наличие высокого связывания с ДНК и низких уровней C3 имеет чрезвычайно высокую прогностическую ценность (94%) для диагностики СКВ. Также возможно, что антитела против дцДНК интернализуются клетками, когда они связываются с мембранными антигенами, а затем отображаются на поверхности клетки. Это может способствовать воспалительной реакции со стороны Т-клеток в почках. Важно отметить, что не все антитела против дцДНК связаны с волчаночным нефритом и что другие факторы могут вызывать этот симптом в их отсутствие. Антигеном антител к дцДНК является двухцепочечная ДНК.
Антигистоновые антитела обнаруживаются в сыворотке до 75–95% людей, принимающих препарат. индуцированная волчанка и 75% идиопатической СКВ. В отличие от антител против дцДНК при СКВ эти антитела не фиксируют комплемент. Хотя они чаще всего встречаются при лекарственной волчанке, они также обнаруживаются в некоторых случаях СКВ, склеродермии, ревматоидного артрита и недифференцированного заболевания соединительной ткани. Известно, что многие лекарства вызывают лекарственную волчанку, и они производят различные антигенные мишени в нуклеосоме, которые часто перекрестно реагируют с несколькими гистоновыми белками и ДНК. Прокаинамид вызывает лекарственную волчанку, которая продуцирует антитела к гистоновым комплексам H2A и H2B.
Оба анти -гликопротеин-210 (анти-gp210) и антитела против нуклеопорина 62 (анти-p62) представляют собой антитела к компонентам ядерной мембраны и обнаруживаются при первичном билиарном циррозе (КПБ). Каждое антитело присутствует примерно в 25–30% ПБЦ. Антигены обоих антител являются составными частями ядерной мембраны. gp210 представляет собой белок 200 кДа, участвующий в закреплении компонентов ядерной поры на ядерной мембране. Антиген p62 представляет собой комплекс ядерных пор 60 кДа.
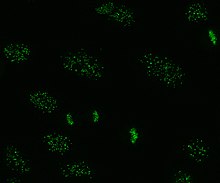 Иммунофлуоресценция образец окрашивания антицентромерных антител на клетках HEp-20-10.
Иммунофлуоресценция образец окрашивания антицентромерных антител на клетках HEp-20-10. Антицентромерные антитела связаны с ограниченным кожным системным склерозом, также известным как синдром CREST, первичным билиарным циррозом и проксимальной склеродермией. Известно шесть антигенов, которые все связаны с центромерой ; CENP-A в CENP-F. CENP-A представляет собой белок, подобный гистону H3 размером 17 кДа . CENP-B представляет собой ДНК-связывающий белок массой 80 кДа, участвующий в сворачивании гетерохроматина. CENP-C представляет собой белок 140 кДа, участвующий в сборке кинетохоры. CENP-D представляет собой белок 50 кДа неизвестной функции, но может быть гомологичным другому белку, участвующему в конденсации хроматина, RCC1. CENP-E представляет собой белок 312 кДа из семейства моторных белков кинезин. CENP-F представляет собой белок 367 кДа из ядерного матрикса, который связывается с кинетохорой в поздней фазе G2 во время митоза. Антитела CENP-A, B и C встречаются наиболее часто (16–42% системного склероза) и связаны с феноменом Рейно, телеангиэктазиями, поражением легких и ранним началом системного склероза.
Антитела против sp100 обнаруживаются примерно в 20–30% случаев первичного билиарного цирроза (ПБЦ). Они обнаруживаются у немногих людей без ПБЦ и поэтому являются очень специфическим маркером болезни. Антиген sp100 находится внутри ядерных тел; большие белковые комплексы в ядре, которые могут играть роль в росте и дифференцировке клеток.
Anti-PM-Scl антитела обнаруживаются почти в 50% из синдром перекрытия полимиозит / системный склероз (PM / SSc). Около 80% людей с антителами, присутствующими в сыворотке крови, страдают этим заболеванием. Наличие антител связано с ограниченным поражением кожи синдромом перекрытия PM / SSc. Антигенные мишени антител являются компонентами РНК -процессирующего экзосомного комплекса в ядрышке. В этом комплексе десять белков, и антитела к восьми из них обнаруживаются с разной частотой; PM / Scl-100 (70–80%), PM / Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) и hRrp40 (7%).
Антитела против DFS70 образуют плотный мелкий пятнистый узор при непрямой иммунофлуоресценции и обнаруживаются у нормальных людей и в различных условиях, но не связаны с системной аутоиммунной патологией. Следовательно, их можно использовать, чтобы исключить такие состояния у людей с положительной анальгетической активностью. У значительного числа пациентов диагностируется системная красная волчанка или недифференцированное заболевание соединительной ткани, в основном на основании положительного результата ANA. В случае, если не могут быть обнаружены определенные аутоантитела (например, антитела против ENA), рекомендуется тестирование антител против DFS70 для подтверждения диагноза. Тесты на антитела к DFS70 доступны как тесты с маркировкой CE. До настоящего времени не существует одобренного FDA анализа.
 Набор для проведения теста на антинуклеарные антитела
Набор для проведения теста на антинуклеарные антитела  Этапы иммунофлуоресценции для обнаружения антинуклеарных антител. Клетки HEp-2 проницаемы (1), а затем инкубируются с сывороткой крови человека (2). Если сыворотка содержит антитела, они будут связываться с антигенами в ядре клетки HEp-2. Эти антитела можно визуализировать путем последующей инкубации с антителами против человека, конъюгированными с флуоресцентной молекулой (3).
Этапы иммунофлуоресценции для обнаружения антинуклеарных антител. Клетки HEp-2 проницаемы (1), а затем инкубируются с сывороткой крови человека (2). Если сыворотка содержит антитела, они будут связываться с антигенами в ядре клетки HEp-2. Эти антитела можно визуализировать путем последующей инкубации с антителами против человека, конъюгированными с флуоресцентной молекулой (3). Присутствие ANA в крови можно подтвердить с помощью скринингового теста. Хотя существует множество тестов для обнаружения ANA, наиболее распространенными тестами, используемыми для скрининга, являются непрямая иммунофлуоресценция и иммуноферментный анализ (ELISA). После обнаружения ANA определяются различные подтипы.
Непрямая иммунофлуоресценция является одним из наиболее часто используемых тестов для ANA. Обычно клетки HEp-2 используются в качестве субстрата для обнаружения антител в сыворотке крови человека. Предметные стекла микроскопа покрыты клетками HEp-2, и сыворотка инкубируется с клетками. Если указанные и целевые антитела присутствуют, то они будут связываться с антигенами на клетках; в случае ANA антитела связываются с ядром. Их можно визуализировать, добавляя флуоресцентно меченные (обычно FITC или родопсин B) антитела против человека, которые связываются с этими антителами. Молекула будет флуоресцировать, когда на нее будет попадать свет определенной длины волны, что можно увидеть под микроскопом. В зависимости от антитела, присутствующего в сыворотке крови человека, и локализации антигена в клетке, на клетках HEp-2 будут видны различные модели флуоресценции. Уровни антител анализируют, выполняя разведения сыворотки крови. Тест ANA считается положительным, если флуоресценция наблюдается при титре 1: 40/1: 80. Более высокие титры более клинически значимы, поскольку низкие положительные результаты (≤1: 160) обнаруживаются почти у 20% здоровых людей, особенно у пожилых людей. Только около 5% здорового населения имеют титры ANA 1: 160 или выше.
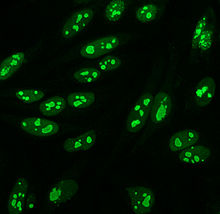 Характер ядерных окрашиваний ANA.
Характер ядерных окрашиваний ANA. Примерно до 1975 года, когда были введены клетки HEp-2 В качестве стандартного субстрата для иммунофлуоресценции использовали животную ткань. Клетки HEp-2 в настоящее время являются одним из наиболее распространенных субстратов для обнаружения ANA с помощью иммунофлуоресценции.
Первоначально возник штамм карциномы гортани, клеточная линия была загрязнена и замещена клетками HeLa и имеет теперь идентифицированы как фактически клетки HeLa.
Они превосходят ранее использовавшиеся ткани животных из-за их большого размера и высокой скорости митоза (деления клетки) в клетке строка. Это позволяет обнаруживать антитела к митоз-специфическим антигенам, например, центромерным антителам. Они также позволяют идентифицировать антитела против Ro, поскольку ацетон используется для фиксации клеток (другие фиксаторы могут вымывать антиген).
Их много. Паттерны окрашивания ядер, наблюдаемые на клетках HEp-2: гомогенные, пятнистые, ядрышковые, ядерно-мембранозные, центромерные, ядерные точки и плеоморфные. Гомогенная картина наблюдается при окрашивании конденсированных хромосом и интерфазного хроматина. Этот образец связан с антителами против дцДНК, антителами к нуклеосомным компонентам и антигистоновыми антителами. Есть два пестрых рисунка: мелкий и грубый. Мелкий крапчатый узор имеет тонкое ядерное окрашивание с неокрашенным метафазным хроматином, который связан с антителами против Ro и против La. Картина грубого окрашивания имеет грубое зернистое окрашивание ядер, вызванное антителами против U1-RNP и против Sm. Картина окрашивания ядрышек связана со многими антителами, включая анти-Scl-70, анти-PM-Scl, анти-фибрилларин и анти-Th / To. Окрашивание ядерной мембраны проявляется в виде флуоресцентного кольца вокруг ядра клетки и вырабатывается антителами против gp210 и p62. Паттерн центромеры показывает множественные ядерные точки в интерфазных и митотических клетках, что соответствует количеству хромосом в клетке. Структура ядерных точек составляет от 13 до 25 ядерных точек в интерфазных клетках и продуцируется анти- sp100 антителами. Плеоморфный паттерн вызывается антителами к ядерному антигену пролиферирующих клеток. Было показано, что непрямая иммунофлуоресценция несколько превосходит ELISA в обнаружении ANA из клеток HEp-2.
 Иммунофлуоресцентный образец окрашивания антител против дцДНК на субстрате C. luciliaes. Кинетопласт, расположенный около жгутика, окрашен, что указывает на присутствие антител против дцДНК у человека с системной красной волчанкой.
Иммунофлуоресцентный образец окрашивания антител против дцДНК на субстрате C. luciliaes. Кинетопласт, расположенный около жгутика, окрашен, что указывает на присутствие антител против дцДНК у человека с системной красной волчанкой. Crithidia luciliae являются гемофлаггелатом одноклеточными протисты. Они используются в качестве субстрата в иммунофлуоресценции для обнаружения антител против дцДНК. Они обладают органеллой, известной как кинетопласт, которая представляет собой большую митохондрию с сетью взаимосвязанных кольцевых молекул дцДНК. После инкубации с сывороткой, содержащей антитела против дцДНК и флуоресцентно меченые антитела против человека, кинетопласт будет флуоресцировать. Отсутствие других ядерных антигенов в этой органелле означает, что использование C.luciliae в качестве субстрата позволяет проводить специфическое обнаружение антител против дцДНК.
Иммуноферментный анализ (ELISA) использует покрытые антигеном микротитровальные планшеты для обнаружения ANA. Каждая лунка микротитровального планшета покрыта либо одним антигеном, либо несколькими антигенами для обнаружения специфических антител или для скрининга ANA соответственно. Антигены либо из клеточных экстрактов, либо из рекомбинантных. Сыворотка крови инкубируется в лунках планшета и промывается. Если присутствуют антитела, связывающиеся с антигеном, они останутся после промывки. Добавляют вторичное антитело против человека, конъюгированное с ферментом, таким как пероксидаза хрена. Ферментативная реакция приведет к изменению цвета раствора, которое пропорционально количеству антитела, связанного с антигеном. Существуют значительные различия в обнаружении ANA с помощью иммунофлуоресценции и различных наборов ELISA, и между ними существует лишь незначительное согласие. Врач должен быть знаком с различиями, чтобы оценивать результаты различных анализов.
В следующей таблице перечислены чувствительность различных типов ANA для разные болезни.
| Тип ANA | Целевой антиген | Чувствительность (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| СКВ | ЛВ, вызванная лекарствами | Диффузный системный склероз | Ограниченная системная склеродермия | Синдром Шегрена | Воспалительная миопатия | MCTD | ||
| Все ANA. (косвенно IF ) | Различный | 95 | 100 | 80 | 80 | 70 | 40–60 | 95 |
| Анти-дцДНК | ДНК | 60 | – | – | – | 30 | – | - |
| Анти-Sm | Основные белки snRNPs | 40 | – | – | – | – | – | - |
| Антигистон | Гистоны | 60 | 90 | – | – | – | – | - |
| Анти Scl-70 | Топоизомераза I типа | – | – | 20 | 10 | – | – | - |
| Антицентромера | Центромерные белки | – | – | 30 | 80 | – | – | - |
| SS- A (Ro) | RNPs | 40 | – | – | – | 50 | 10 | - |
| SS-B (La) | RNPs | 10–15 | – | – | – | 60–90 | – | |
| - = чувствительность менее 5% | ||||||||
Некоторые ANA появляются при нескольких типах заболеваний, что приводит к более низкой специфичности теста. Например, было показано, что IgM- ревматоидный фактор (IgM-RF) перекрестно реагирует с ANA, дающим ложноположительную иммунофлуоресценцию. Положительные ANA, а также антитела против ДНК были зарегистрированы у пациентов с аутоиммунным заболеванием щитовидной железы. ANA может иметь положительный результат теста в 45% случаев людей с аутои заболевания щитовидной железы или ревматоидный артрит и до 15% людей с ВИЧ или гепатитом C. Согласно Lupus Foundation of America, «около 5% населения в целом будут иметь положительный результат ANA. Однако по крайней мере 95% людей с положительным результатом ANA не страдают волчанкой. Положительный тест на ANA. иногда может передаваться по наследству, даже если у членов семьи нет признаков волчанки ". С другой стороны, говорят они, хотя 95% пациентов, у которых на самом деле тест на волчанку положительный на ANA, «только небольшой процент имеет отрицательный результат ANA, и многие из них имеют другие антитела (например, антифосфолипидные антитела, анти-Ro, анти-SSA) или их ANA, преобразованные из положительного в отрицательный из стероидов, цитотоксических препаратов или уремии (почечная недостаточность). "
 LE-клетка
LE-клетка LE-клетка была обнаружена в костном мозге в 1948 году Hargraves et al. В 1957 году Холбороу и др. впервые продемонстрировал ANA с помощью непрямой иммунофлуоресценции. Это было первым признаком того, что процессы, влияющие на ядро клетки, ответственны за СКВ. В 1959 году было обнаружено, что сыворотка от людей с СКВ содержала антитела, которые осаждались солевыми экстрактами ядер, известные как экстрагируемые ядерные антигены (ENA). Это привело к характеристике антигенов ENA и их соответствующих антител. Таким образом, антитела против Sm и против РНП были открыты в 1966 и 1971 годах соответственно. В 1970-х годах были открыты антитела против Ro / анти-SS-A и анти-La / анти-SS-B. Антитело Scl-70 было известно как специфическое антитело к склеродермии в 1979 году, однако антиген (топоизомераза-I) не был охарактеризован до 1986 года. Антиген и антитело Jo-1 были охарактеризованы в 1980 году.