| Тромботическая тромбоцитопеническая пурпура | |
|---|---|
| Другие названия | Синдром Московица, идиопатическая тромботическая тромбоцитопеническая пурпура |
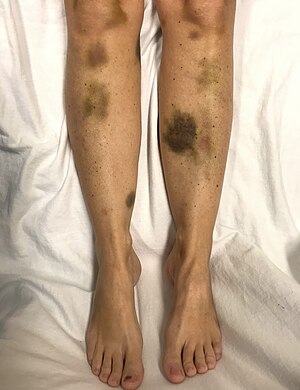 | |
| у женщины с критически низким уровнем тромбоцитов | |
| Специальность | Гематология |
| Симптомы | Большие синяки, лихорадка, слабость, одышка, спутанность сознания, головная боль |
| Обычное начало | Взрослый |
| Причины | Неизвестно, бактериальные инфекции, некоторые лекарства, аутоиммунные заболевания, беременность |
| Метод диагностики | На основании симптомов и анализов крови |
| Дифференциальный диагноз | Гемолитико-уремический синдром (HUS), атипичный гемолитико-уремический синдром (aHUS) |
| Лечение | Плазмообмен, иммунодепрессанты |
| Прогноз | < 20% risk of death |
| Частота | 1 на 100000 человек |
Тромботическая тромбоцитопеническая пурпура (ТТП ) - это заболевание крови, которое приводит к образованию тромбов образуются в мелких кровеносных сосудах по всему телу. Это приводит к низкому количеству тромбоцитов, низкому уровню эритроцитов из-за их распада и часто почек, сердце и мозг дисфункция. Симптомы могут включать большие синяки, лихорадку, слабость, одышку, спутанность сознания и головную боль. Возможны повторные эпизоды.
Примерно в половине случаев триггер идентифицируется, а в остальных причина остается неизвестной. Известные триггеры включают бактериальные инфекции, некоторые лекарства, аутоиммунные заболевания, такие как волчанка и беременность. Основной механизм обычно включает антитела, ингибирующие фермент ADAMTS13. Это приводит к уменьшению разрушения больших мультимеров из фактора Виллебранда (vWF) на более мелкие единицы. Реже ТТП известен как синдром Апшоу – Шульман, когда дисфункция ADAMTS13 присутствует с рождения. Диагноз обычно основывается на симптомах и анализах крови. Это может быть подтверждено измерением активности или антител против ADAMTS13.
Благодаря плазмообмену риск смерти снизился с более чем 90% до менее чем 20%. Иммунодепрессанты, такие как глюкокортикоиды и ритуксимаб, также могут использоваться. Переливания тромбоцитов обычно не рекомендуются.
Примерно 1 на 100 000 человек находятся под влиянием. Начало обычно происходит в зрелом возрасте, и чаще страдают женщины. Около 10% случаев начинаются в детстве. Состояние было впервые описано Эли Московиц в 1924 году. Основной механизм был определен в 1980-х и 1990-х.
Признаки и симптомы ВДП могут сначала быть незаметными и неспецифическими. Многие люди испытывают гриппоподобное или диарейное заболевание до развития ТТП. Неврологические симптомы очень распространены и сильно различаются по степени тяжести. Часто сообщаемые симптомы включают чувство сильной усталости, спутанность сознания и головные боли. Судороги и симптомы, аналогичные симптомам инсульта тоже видно. Другие симптомы включают, помимо прочего, желтуху или бледность кожи, учащенное сердцебиение или одышку, а также мелкие фиолетовые или красноватые точки на коже, известные как петехии.
По мере прогрессирования ВДП, сгустки крови образуются в мелких кровеносных сосудах (микрососуды), а тромбоциты (тромбоциты) потребляются. В результате могут появиться синяки, а в редких случаях - кровотечения. Синяк часто принимает форму пурпуры, а наиболее частым местом кровотечения, если оно происходит, является нос или десны. Могут развиться и более крупные синяки (экхимозы ). Классическое проявление ВДП, которое встречается менее чем у 10% людей, включает пять медицинских признаков. Это:
Высокое кровяное давление (гипертония ) может быть обнаружен при осмотре.
ТТП, как и другие микроангиопатические гемолитические анемии (MAHA), вызывается спонтанной агрегацией тромбоцитов и активацией коагуляции в мелких кровеносных сосудах. Тромбоциты потребляются в процессе агрегации и связывают vWF. Эти комплексы тромбоцитов-vWF образуют небольшие сгустки крови, которые циркулируют в кровеносных сосудах и вызывают сдвиг эритроцитов, что приводит к их разрыв и образование шистоцитов. Две наиболее известные причины ТТП связаны с аутоиммунитетом и наследственной недостаточностью ADAMTS13 (известной как синдром Апшоу-Шюльмана). остальные случаи вторичны по отношению к другим факторам.
ВПТ неизвестной причины долгое время была известна как идиопатический ТТП, но в 1998 году было показано, что большинство случаев вызвано ингибированием фермента ADAMTS13 с помощью антител. Связь уменьшенного ADAMTS13 с патогенезом ТТП известна как гипотеза Фурлан-Цай, по названию двух независимых групп исследователей, опубликовавших свои исследования в том же выпуске Медицинского журнала Новой Англии.. Эти случаи теперь классифицируются как аутоиммунное заболевание и известны как аутоиммунная ТТП (не путать с иммунной / идиопатической тромбоцитопенической пурпурой ).
ADAMTS13 - металлопротеиназа, ответственная за разрушение фактора фон Виллебранда (vWF), белка, который связывает тромбоциты, тромбы и стенку кровеносных сосудов в процессе свертывания крови. Очень большие мультимеры vWF более подвержены Следовательно, без надлежащего расщепления vWF с помощью ADAMTS13 коагуляция происходит с более высокой скоростью, особенно в микроциркуляторном русле, части системы кровеносных сосудов, где vWF наиболее активен из-за высокого напряжения сдвига. При идиопатической ВДП сильно снижается (<5% of normal) ADAMTS13 activity can be detected in most (80%) people, and inhibitors are often found in this subgroup (44–56%).
 Тромботическая тромбоцитопеническая пурпура наследуется по аутосомно-рецессивному типу
Тромботическая тромбоцитопеническая пурпура наследуется по аутосомно-рецессивному типу Это состояние также может быть врожденным. Такие случаи могут быть вызваны мутациями в гене ADAMTS13. Эта наследственная форма ТТП называется синдром Апшоу – Шульман. Люди с этим наследственным дефицитом ADAMTS13 имеют удивительно мягкий фенотип, но развивают ТТП в клинических ситуациях с повышенными уровнями фактора фон Виллебранда, например инфекция. По имеющимся данным, менее 1% всех случаев ТТП вызваны синдромом Апшоу-Шульман. У людей с этим синдромом обычно 5–10% нормальной активности ADAMTS-13.
Вторичная ВДП диагностируется, когда в анамнезе человека упоминается одна из известных особенностей, связанных с ВДП. На него приходится около 40% всех случаев ТТП. Предрасполагающими факторами являются:
Механизм вторичной ТТП плохо изучен, поскольку активность ADAMTS13 обычно не так подавлена, как при идиопатическом ТТП и ингибиторы не могут быть обнаружены. Вероятная этиология может включать, по крайней мере в некоторых случаях, эндотелиальное повреждение, хотя образование тромбов, приводящее к окклюзии сосудов, может не иметь существенного значения в патогенезе вторичной ТТП. или могут также рассматриваться как форма вторичного аГУС; Следовательно, люди с такими особенностями являются потенциальными кандидатами на антикомплементарную терапию.
Основной механизм обычно включает опосредованное аутоантителами ингибирование фермента ADAMTS13, металлопротеиназы, ответственной за расщепление большие мультимеры фактора фон Виллебранда (vWF) на более мелкие единицы. Увеличение циркулирующих мультимеров vWF увеличивает адгезию тромбоцитов к участкам эндотелиального повреждения, особенно там, где встречаются артериолы и капилляры, что, в свою очередь, приводит к образованию небольших сгустки тромбоцитов, называемые тромбами. Поскольку тромбоциты используются для образования тромбов, это приводит к снижению общего количества циркулирующих тромбоцитов, что может вызвать опасные для жизни кровотечения. Эритроциты, проходящие через микроскопические сгустки, подвергаются напряжению сдвига, которое повреждает их мембраны, что приводит к разрыву эритроцитов внутри кровеносных сосудов, что, в свою очередь, приводит к анемии. и образование шистоцитов. Наличие этих сгустков крови в мелких кровеносных сосудах снижает приток крови к органам, что приводит к повреждению клеток и повреждению конечного органа.
ТТП характеризуется тромботической микроангиопатией (ТМА), образованием сгустков крови в мелких кровеносных сосудах по всему телу, что может привести к микроангиопатической гемолитической анемии и тромбоцитопении. Эта характеристика характерна для двух родственных синдромов: гемолитико-уремического синдрома (HUS) и атипичного гемолитико-уремического синдрома (aHUS). Следовательно, дифференциальная диагностика этих заболеваний, вызывающих ТМА, очень важна. Помимо ТМА, при каждом из этих заболеваний могут присутствовать один или несколько из следующих симптомов: неврологические симптомы (например, спутанность сознания, судороги головного мозга); почечная недостаточность (например, повышенный креатинин, снижение расчетной скорости клубочковой фильтрации [рСКФ], аномальный анализ мочи); и желудочно-кишечные (ЖКТ) симптомы (например, диарея, тошнота / рвота, боль в животе, гастроэнтерит. В отличие от HUS и aHUS, TTP, как известно, вызывается приобретенным дефектом в белке ADAMTS13, поэтому лабораторный тест показывает ≤5% нормальных уровней ADAMTS13 указывает на ТТП. Уровни ADAMTS13 выше 5% в сочетании с положительным тестом на шига-токсин / энтерогеморрагическую кишечную палочку (EHEC) с большей вероятностью указывают на ГУС, тогда как отсутствие шига-токсина / EHEC может подтвердить диагноз аГУС.
Из-за высокой смертности от нелеченой ТТП предполагаемый диагноз ТТП ставится даже тогда, когда наблюдаются только микроангиопатическая гемолитическая анемия и тромбоцитопения и назначается терапия. Переливание крови противопоказано при тромботической ТТП, поскольку оно способствует развитию коагулопатии. С начала 1990-х годов плазмаферез стал методом выбора при ТТП. Это обменное переливание крови, предполагающее удаление от плазмы крови до афереза и замените меня н. с донорской плазмой (свежезамороженная плазма или криосупернатант ); Процедуру необходимо повторять ежедневно, чтобы устранить ингибитор и уменьшить симптомы. Если аферез недоступен, можно ввести свежезамороженную плазму, но объем, который можно вводить безопасно, ограничен из-за опасности перегрузки жидкостью. Сама по себе инфузия плазмы не так эффективна, как плазмаферез. Обычно назначают кортикостероиды (преднизон или преднизолон ). Ритуксимаб, a моноклональное антитело, направленное на молекулу CD20 на B-лимфоцитах, может использоваться при диагностике; считается, что это убивает В-клетки и тем самым снижает выработку ингибитора. Более сильная рекомендация для ритуксимаба существует там, где ТТП не отвечает на кортикостероиды и плазмаферез.
Каплацизумаб является альтернативным вариантом лечения ВДП, поскольку было показано, что он вызывает более быстрое излечение болезни по сравнению с теми людьми, которые принимали плацебо. Однако использование каплацизумаба было связано с увеличением тенденции к кровотечению у исследуемых субъектов.
Люди с рефрактерной или рецидивирующей ТТП могут получать дополнительную иммуносупрессивную терапию, например винкристин, циклофосфамид, циклоспорин A или спленэктомия.
Дети с синдромом Апшоу-Шюльмана получают профилактическую плазму каждые две-три недели; это поддерживает адекватный уровень функционирования ADAMTS13. Некоторые переносят более длительные интервалы между инфузиями плазмы. Дополнительные инфузии плазмы могут потребоваться для запуска событий, таких как хирургическое вмешательство; в качестве альтернативы, количество тромбоцитов можно тщательно контролировать вокруг этих событий с введением плазмы, если количество падает.
Измерения уровней лактатдегидрогеназы, тромбоцитов и шистоцитов в крови используются для мониторинга заболевания прогрессирование или ремиссия. Активность ADAMTS13 и уровни ингибитора могут быть измерены во время последующего наблюдения, но для пациентов без симптомов использование ритуксимаба не рекомендуется.
Уровень смертности составляет около 95% для нелеченых случаев, но прогноз достаточно благоприятный (выживаемость 80–90%) для людей с идиопатической ТТП, у которых диагностирована и начала лечение плазмаферез.
Частота ТТП составляет около 4-5 случаев на миллион человек. в год. Идиопатическая ТТП чаще встречается у женщин и лиц африканского происхождения, а ТТП, вторичная по отношению к аутоиммунным нарушениям, таким как системная красная волчанка, чаще встречается у лиц африканского происхождения, хотя другие вторичные формы не показывают этого распределения. Беременные женщины и женщины в послеродовом периоде составляли значительную часть (12–31%) случаев в некоторых исследованиях; ТТП встречается примерно у одной из 25000 беременностей.
ТТП была первоначально описана Эли Московицем в больнице Бет Исраэль в Нью Йорк Сити в 1925 году. Московиц приписал болезнь (как теперь известно, неверно) токсической причине. Московиц отметил, что у его пациентки, 16-летней девочки, была анемия, маленькие и большие синяки, микроскопическая гематурия, а при вскрытии диссеминированные тромбы микрососудов.. В 1966 году обзор 16 новых случаев и 255 ранее зарегистрированных случаев привел к формулированию классической пентады симптомов и результатов (т. Е. Тромбоцитопении, микроангиопатической гемолитической анемии, неврологических симптомов, почечной недостаточности, лихорадки); в этой серии было установлено, что уровень смертности очень высок (90%).
Хотя реакция на переливание крови отмечалась и раньше, отчет 1978 года и последующие исследования показали, что плазма крови была высокоэффективной для лечения заболевания. процесс. В 1991 году сообщалось, что плазмаферез обеспечивает более высокую скорость ответа по сравнению с инфузией плазмы. В 1982 году болезнь была связана с аномально большими мультимерами фактора фон Виллебранда. Идентификация дефицитной протеазы у людей с ТТП была произведена в 1998 году. Местоположение ADAMTS13 в геноме человека было идентифицировано в 2001 году.
| Классификация | D |
|---|---|
| Внешние ресурсы |