Селеноорганические соединения (или селеноорганические) - это химические соединения, содержащие углерод -к- селен химические связи. Селеноорганическая химия - соответствующая наука, изучающая их свойства и реакционную способность. Селен вместе с кислородом и серой относится к элементам группы 16 или халькогенам, и следует ожидать сходства в химии.
Селен может существовать со степенью окисления -2, +2, +4, +6. Se (II) является доминирующей формой в химии селенорганических соединений. Внизу по столбцу группы 16 сила связи становится все более слабой (234 kJ /моль для связи C-Se и 272 кДж / моль для связи C-S), а длины связей больше (C-Se 198 пм, C-S 181 пм и C-O 141 пм). Соединения селена более нуклеофильны, чем соответствующие соединения серы, а также более кислые. Значения pKa для XH 2 составляют 16 для кислорода, 7 для серы и 3,8 для селена. В отличие от сульфоксидов, соответствующие селеноксиды нестабильны в присутствии β-протонов, и это свойство используется во многих органических реакциях селена, особенно при окислении селеноксида и удалении селеноксида. Селенорганические соединения обнаруживаются в следовых количествах в окружающих водах, почвах и отложениях.
Первым селенорганическим соединением, которое было выделено, был диэтилселенид в 1836 году.
 Структуры некоторых селенорганических соединений
Структуры некоторых селенорганических соединений Селен в форме селенорганических соединений является важным микронутриентом, отсутствие которого в рационе вызывает дисфункцию сердечной мышцы и скелета. Селенорганические соединения необходимы для защиты клеток от окислительного повреждения и для правильного функционирования иммунной системы. Они также могут играть роль в предотвращении преждевременного старения и рака. Источником селена, используемого в биосинтезе, является селенофосфат.
глутатионоксидаза - фермент с селенолом в его активном центре. Селенорганические соединения обнаружены у высших растений. Например, при анализе чеснока с использованием методики высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией с индуктивно связанной плазмой (HPLC-ICP-MS) было обнаружено, что γ-глутамил -Se-метилселеноцистеин был основным Se-содержащим компонентом, наряду с меньшими количествами Se-метилселеноцистеина. Следовые количества диметилселенида и аллилметилселенида обнаруживаются в дыхании человека после употребления сырого чеснока.
Селеноцистеин, называемая двадцать первой аминокислотой, необходим для управляемого рибосомами синтеза белка у некоторых организмов. В настоящее время известно более 25 селенсодержащих белков (селенопротеинов). Большинство селензависимых ферментов содержат селеноцистеин, который родственен аналогу цистеина, но селен замещает серу. Эта аминокислота кодируется особым образом ДНК.
Селенометионин представляет собой селенидсодержащую аминокислоту, которая также встречается в природе, но образуется в результате посттранскрипционной модификации.
Селеноорганические соединения - это специализированный, но полезный набор реагентов, используемых в органическом синтезе, хотя они обычно исключаются из процессов, используемых в фармацевтике, из-за нормативных вопросов. Их полезность зависит от определенных атрибутов, включая (i) слабость связи C-Se и (ii) легкое окисление соединений двухвалентного селена.
Виниловые селениды представляют собой селенорганические соединения, которые играют роль в органическом синтезе, особенно в разработке удобных стереоселективных путей к функционализированным алкенам. Хотя для получения виниловых селенидов упоминаются различные методы, более полезная процедура сосредоточена на нуклеофильном или электрофильном селенорганическом присоединении к концевым или внутренним алкинам. Например, нуклеофильное присоединение селенфенола к алкинам дает, предпочтительно, Z-виниловые селениды после более длительного времени реакции при комнатной температуре. Реакция идет быстрее при высокой температуре; однако смесь Z- и E-виниловых селенидов была получена в соотношении почти 1: 1. С другой стороны, аддукты зависят от природы заместителей при тройной связи. Напротив, виниловые селениды могут быть получены катализируемым палладием гидроселенированием алкинов, чтобы получить марковниковский аддукт с хорошими выходами. Есть некоторые ограничения, связанные с методологиями получения виниловых селенидов, проиллюстрированных выше; В описанных процедурах в качестве исходных материалов используются диорганоилдиселениды или селенфенол, которые являются летучими и нестабильными и имеют неприятный запах. Кроме того, получение этих соединений сложное.
Диоксид селена используется при окислении органических соединений. В частности, SeO 2 будет преобразовывать аллильную метиленовую группу в соответствующий спирт. Эту реакцию вызывает ряд других реагентов.

С точки зрения механизма реакции, SeO 2 и аллильный субстрат реагируют посредством перициклического процесса, начиная с еновой реакции, которая активирует связь C − H. Второй этап представляет собой [2,3] сигматропную реакцию. Окисление с участием диоксида селена часто проводят с каталитическими количествами соединения селена и в присутствии жертвенного катализатора или сооксиданта, такого как пероксид водорода.
SeO 2 -основное окисление иногда дает карбонильные соединения, такие как кетоны, β- пинен и циклогексанон окисление до 1,2-циклогександиона. Окисление кетонов, содержащих α-метиленовые группы, дает дикетоны. Этот тип окисления оксидом селена называется окислением по Райли.
В присутствии β-водорода селенид будет давать реакцию элиминирования после окисления, чтобы оставляют после себя алкен и SeO-селенопероксол. SeO-селенопероксол обладает высокой реакционной способностью и не выделяется как таковой. В реакции элиминирования все пять участвующих реакционных центров являются копланарными и, следовательно, стереохимия реакции син. Используемые окислители: перекись водорода, озон или MCPBA. Этот тип реакции часто используется с кетонами, что приводит к енонам. Примером является отщепление ацетилциклогексанона с помощью и гидрида натрия.
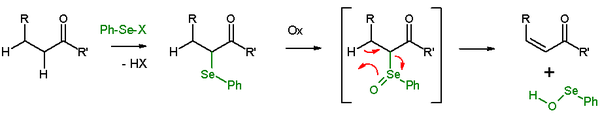
Удаление по Грико представляет собой аналогичное отщепление селеноксида с использованием о-нитрофенилселеноцианата и трибутилфосфина, чтобы вызвать отщепление элементов H 2 О.
В последние два десятилетия особое внимание уделялось функционализации углерод-углеродных двойных связей с добавлением электрофильных селенорганических соединений. Реакция селанилирования инициируется образованием промежуточных соединений иона селенирана из алкенов и селенового электрофила RSeX с последующей нуклеофильной атакой на обратной стороне, приводящей к продукту анти-присоединения. Атака нуклеофила происходит на атоме углерода, который имеет более стабильный положительный заряд, обычно это наиболее замещенный атом углерода. Реакции присоединения различных электрофилов селена к алкенам были подробно изучены с использованием внутренних и внешних нуклеофилов.
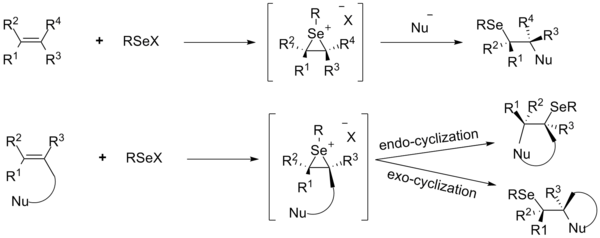
.