 Сканирующий электронный микроскоп изображение пыльцы
Сканирующий электронный микроскоп изображение пыльцы  Микроскопическое исследование в биохимической лаборатории
Микроскопическое исследование в биохимической лаборатории Микроскопия - это техническая область использования микроскопов для просмотра объектов и областей объектов, которые нельзя увидеть невооруженным глазом (объекты, которые находятся за пределами диапазона разрешения обычного глаза). Существует три хорошо известных направления микроскопии: оптическая, электронная и сканирующая зондовая микроскопия, а также развивающаяся область рентгеновской микроскопии..
Оптическая микроскопия и электронная микроскопия включают дифракцию, отражение или преломление электромагнитного излучения / электронных лучей, взаимодействующих с образец, а также сбор рассеянного излучения или другого сигнала для создания изображения. Этот процесс может быть выполнен путем облучения образца в широком поле (например, стандартная световая микроскопия и просвечивающая электронная микроскопия ) или сканированием тонкого луча по образцу (например, конфокальная лазерная сканирующая микроскопия и растровая электронная микроскопия ). Сканирующая зондовая микроскопия включает взаимодействие сканирующего зонда с поверхностью интересующего объекта. Развитие микроскопии произвело революцию в биологии, дало начало области гистологии и поэтому остается важным методом в жизни и физических науках. Рентгеновская микроскопия является трехмерной и неразрушающей, что позволяет повторно визуализировать один и тот же образец для in situ или 4D исследований и дает возможность «заглянуть внутрь» исследуемого образца, прежде чем жертвовать им к методам более высокого разрешения. В трехмерном рентгеновском микроскопе используется техника компьютерной томографии (микроКТ), при которой образец вращается на 360 градусов и восстанавливаются изображения. КТ обычно выполняется с помощью плоского дисплея. В трехмерном рентгеновском микроскопе используется ряд объективов, например, от 4X до 40X, а также он может включать плоскую панель.
 Часто считается первым признанным микроскопистом и микробиолог, Антони ван Левенгук наиболее известен своей новаторской работой в области микроскопии и своим вкладом в становление микробиологии как научной дисциплины.
Часто считается первым признанным микроскопистом и микробиолог, Антони ван Левенгук наиболее известен своей новаторской работой в области микроскопии и своим вкладом в становление микробиологии как научной дисциплины. Область микроскопии (оптическая микроскопия ) восходит как минимум к 17 веку. Более ранние микроскопы, одинарные линзы лупы с ограниченным увеличением, появились, по крайней мере, еще со времен широкого использования линз в очках в 13 веке, но больше Усовершенствованные составные микроскопы впервые появились в Европе около 1620 г. Среди первых практиков микроскопии Галилео Галилей, обнаруживший в 1610 г., что он может сфокусировать свой телескоп на близком расстоянии для просмотра мелких объектов вблизи и Корнелис Дреббел, который, возможно, изобрел составной микроскоп около 1620 года Антони ван Левенгук разработал простой микроскоп с очень большим увеличением в 1670-х годах и часто считается первым признанным микроскопистом и микробиолог.
 Стереомикроскоп
Стереомикроскоп Оптическая или световая микроскопия включает прохождение видимого света, проходящего через образец или отраженного от образца через одну линзу или несколько линз для увеличения изображения образца. Полученное изображение может быть обнаружено непосредственно глазом, отображено на фотопластинке или захвачено в цифровом виде. Одиночная линза с ее насадками или система линз и оборудование для визуализации вместе с соответствующим осветительным оборудованием, предметным столиком и опорой составляют базовый световой микроскоп. Самой последней разработкой является цифровой микроскоп , в котором используется камера CCD для фокусировки на интересующем экспонате. Изображение выводится на экран компьютера, поэтому окуляры не нужны.
Ограничения стандартной оптической микроскопии (светлопольной микроскопии ) лежат в трех областях;
Живые клетки, в частности, обычно не имеют достаточного контраста для успешного изучения, поскольку внутренние структуры клетки бесцветны и прозрачны. Наиболее распространенный способ увеличения контрастности - окрашивание различных структур селективными красителями, но это часто включает уничтожение и фиксацию образца. Окрашивание может также привести к появлению артефактов, которые являются очевидными структурными деталями, вызванными обработкой образца и, следовательно, не являются законными характеристиками образца. В целом эти методы используют различия в показателе преломления клеточных структур. Светопольная микроскопия сравнима с просмотром через стеклянное окно: человек видит не стекло, а просто грязь на стекле. Есть разница, так как стекло является более плотным материалом, и это создает разницу в фазе проходящего через него света. Человеческий глаз не чувствителен к этой разности фаз, но были разработаны умные оптические решения, позволяющие преобразовать эту разность фаз в разность амплитуды (интенсивности света).
Чтобы улучшить контраст образца или выделить определенные структуры в образце, необходимо использовать специальные методы. Доступен огромный выбор методов микроскопии для увеличения контрастности или маркировки образца.

Яркое поле Освещение, контраст образца зависит от поглощения света в образце.

Кросс-поляризованный свет освещение, контраст образца достигается за счет вращения поляризованного света через образец.

Темное поле освещение, контраст образца исходит из света , рассеянного образцом.

Фазовый контраст освещение, контраст образца возникает из-за интерференции различных длин пути света через образец.
Светлопольная микроскопия - самый простой из всех методов световой микроскопии. Освещение образца осуществляется посредством белого проходящего света, то есть освещается снизу и наблюдается сверху. Ограничения включают низкий контраст большинства биологических образцов и низкое видимое разрешение из-за размытия не в фокусе материала. Простота методики и минимальная необходимая подготовка образца являются значительными преимуществами.
Использование наклонного (сбоку) освещения придает изображению трехмерный (3D) вид и может выделить невидимые в противном случае детали. Более поздней техникой, основанной на этом методе, является модулирующий контраст Хоффмана, система, используемая в инвертированных микроскопах для использования в культуре клеток. Косое освещение страдает теми же ограничениями, что и светлопольная микроскопия (низкий контраст многих биологических образцов; низкое видимое разрешение из-за объектов, находящихся вне фокуса).
Микроскопия темного поля - это метод улучшения контраста неокрашенных прозрачных образцов. В освещении темного поля используется тщательно выровненный источник света, чтобы минимизировать количество непосредственно проходящего (нерассеянного) света, попадающего в плоскость изображения, собирая только свет, рассеянный образцом. Темное поле может значительно улучшить контраст изображения, особенно прозрачных объектов, при этом не требуя настройки оборудования или подготовки образца. Однако этот метод страдает от низкой интенсивности света на конечном изображении многих биологических образцов и продолжает зависеть от низкого видимого разрешения.
 A диатом при освещении Рейнберга
A диатом при освещении Рейнберга Освещение Рейнберга - это особый вариант освещения темного поля, в котором прозрачные цветные фильтры вставляются непосредственно перед конденсором, так что световые лучи на большой диафрагме выглядят иначе. окрашены, чем при низкой диафрагме (т. е. фон образца может быть синим, в то время как объект кажется самосветящимся красным). Возможны и другие цветовые комбинации, но их эффективность весьма различна.
Дисперсионное окрашивание - это оптический метод, позволяющий получить цветное изображение бесцветного объекта. Это метод оптического окрашивания, который не требует окрашивания или красителя для создания цветового эффекта. Существует пять различных конфигураций микроскопов, используемых в более широкой технике дисперсионного окрашивания. К ним относятся светлопольное окрашивание по линии Беке, наклонное, темнопольное, фазово-контрастное и дисперсионное окрашивание объектива.
 Фазовый контраст световая микрофотография некальцифицированного гиалинового хряща, показывающая хондроциты и органеллы, лакуны и внеклеточный матрикс.
Фазовый контраст световая микрофотография некальцифицированного гиалинового хряща, показывающая хондроциты и органеллы, лакуны и внеклеточный матрикс.Более сложные методы покажут пропорциональные различия в оптической плотности. Фазовый контраст - широко используемый метод, который показывает различия в показателе преломления как разницу в контрасте. Он был разработан голландским физиком Фрицем Зернике в 1930-х годах (за что он был удостоен Нобелевской премии в 1953 году). Например, ядро клетки будет темным на фоне окружающей цитоплазмы. Контраст отличный; однако он не предназначен для работы с толстыми предметами. Часто даже вокруг небольших объектов образуется ореол, скрывающий детали. Система состоит из кольцевого кольца в конденсаторе, которое производит световой конус. Этот конус накладывается на кольцо аналогичного размера внутри фазового объектива. У каждой цели есть кольцо разного размера, поэтому для каждой цели нужно выбирать другую настройку конденсатора. Кольцо в объективе обладает особыми оптическими свойствами: оно, прежде всего, уменьшает интенсивность прямого света, но, что более важно, оно создает искусственную разность фаз примерно на четверть длины волны. Поскольку физические свойства этого прямого света изменились, возникает интерференция с дифрагированным светом, что приводит к фазово-контрастному изображению. Одним из недостатков фазово-контрастной микроскопии является образование ореола (светового кольца ореола).
Лучшим и гораздо более дорогим является использование интерференционного контраста . Различия в оптической плотности проявляются в различиях рельефа. Ядро внутри клетки будет фактически отображаться в виде глобулы в наиболее часто используемой системе дифференциального интерференционного контраста в соответствии с Жоржем Номарски. Однако следует иметь в виду, что это оптический эффект, и рельеф не обязательно соответствует истинной форме. Контраст очень хороший, и апертуру конденсора можно использовать полностью открытой, тем самым уменьшая глубину резкости и увеличивая разрешение.
Система состоит из специальной призмы (призма Номарского, призма Волластона ) в конденсаторе, которая разделяет свет на обычный и необычный луч. Пространственная разница между двумя лучами минимальна (меньше максимального разрешения объектива). После прохождения через образец лучи воссоединяются с помощью аналогичной призмы в объективе.
В однородном образце нет разницы между двумя лучами и не создается контраст. Однако вблизи преломляющей границы (скажем, ядра в цитоплазме) разница между обычным и необычным лучом создаст рельеф на изображении. Для работы дифференциального интерференционного контраста требуется источник поляризованного света ; На пути света должны быть установлены два поляризационных фильтра: один под конденсатором (поляризатором), а другой над объективом (анализатор).
Примечание: в тех случаях, когда оптическая конструкция микроскопа обеспечивает заметное боковое разделение двух лучей, мы имеем дело с классической интерференционной микроскопией, которая не дает рельефных изображений, но тем не менее, может использоваться для количественного определения толщины микроскопических объектов.
Дополнительным методом, использующим интерференцию, является интерференционная отражательная микроскопия (также известная как отраженный интерференционный контраст или RIC). Он основан на прилипании клеток к слайду для создания интерференционного сигнала. Если к стеклу не прикреплена ячейка, интерференции не будет.
Интерференционная отражательная микроскопия может быть получена с использованием тех же элементов, что и DIC, но без призм. Кроме того, обнаруживаемый свет отражается, а не передается, как при использовании DIC.
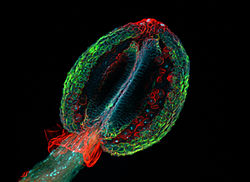 Изображения могут также содержать артефакты. Это конфокальное лазерное сканирование флуоресценция микрофотография пыльника кресс-салата (часть тычинки ). На снимке, среди прочего, изображена красивая красная плавная структура в виде воротника прямо под пыльником. Однако у неповрежденной тычинки кресс-салата нет такого воротничка, это артефакт фиксации: тычинка была разрезана под рамкой рисунка, и эпидермис (верхний слой клеток) стебля тычинки отслоился, формируя нехарактерную структуру. Фото: Хейти Павес из Таллиннского технологического университета.
Изображения могут также содержать артефакты. Это конфокальное лазерное сканирование флуоресценция микрофотография пыльника кресс-салата (часть тычинки ). На снимке, среди прочего, изображена красивая красная плавная структура в виде воротника прямо под пыльником. Однако у неповрежденной тычинки кресс-салата нет такого воротничка, это артефакт фиксации: тычинка была разрезана под рамкой рисунка, и эпидермис (верхний слой клеток) стебля тычинки отслоился, формируя нехарактерную структуру. Фото: Хейти Павес из Таллиннского технологического университета.Когда некоторые соединения освещаются светом высокой энергии, они излучают свет более низкой частоты. Этот эффект известен как флуоресценция. Часто образцы демонстрируют характерное автофлуоресцентное изображение, основанное на их химическом составе.
Этот метод имеет решающее значение в современной науке о жизни, поскольку он может быть чрезвычайно чувствительным, позволяя обнаруживать отдельные молекулы. Многие различные флуоресцентные красители можно использовать для окрашивания различных структур или химических соединений. Одним из особенно эффективных методов является комбинация антител, связанных с флуорофором, как в иммуноокрашивании. Примерами обычно используемых флуорофоров являются флуоресцеин или родамин.
. Антитела могут быть адаптированы для химического соединения. Например, одна из часто используемых стратегий - это искусственное производство белков на основе генетического кода (ДНК). Эти белки затем можно использовать для иммунизации кроликов с образованием антител, которые связываются с белком. Затем антитела химически связываются с флуорофором и используются для отслеживания белков в исследуемых клетках.
Высокоэффективные флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP), были разработаны с использованием метода молекулярной биологии гена . fusion, процесс, который связывает экспрессию флуоресцентного соединения с экспрессией целевого белка. Этот комбинированный флуоресцентный белок, как правило, не токсичен для организма и редко влияет на функцию исследуемого белка. Генетически модифицированные клетки или организмы непосредственно экспрессируют флуоресцентно меченые белки, что позволяет изучать функцию исходного белка in vivo.
Рост кристаллов белка приводит как к кристаллам белка, так и к кристаллам соли. Оба бесцветны и микроскопичны. Извлечение кристаллов протеина требует визуализации, которая может быть сделана по собственной флуоресценции протеина или с помощью просвечивающей микроскопии. Оба метода требуют ультрафиолетового микроскопа, поскольку белок поглощает свет с длиной волны 280 нм. Белок также будет флуоресцировать примерно на 353 нм при возбуждении светом 280 нм.
Поскольку флуоресцентное излучение отличается длиной волны (цвет) от возбуждающего света, идеальный флуоресцентный изображение показывает только интересующую структуру, которая была помечена флуоресцентным красителем. Эта высокая специфичность привела к широкому использованию флуоресцентной световой микроскопии в биомедицинских исследованиях. Различные флуоресцентные красители могут использоваться для окрашивания различных биологических структур, которые затем могут быть обнаружены одновременно, но при этом остаются специфическими из-за индивидуального цвета красителя.
Чтобы не допустить попадания возбуждающего света на наблюдателя или детектор, необходимы наборы фильтров высокого качества. Обычно они состоят из фильтра возбуждения , выбирающего диапазон возбуждающих длин волн, дихроичного зеркала и фильтра излучения, блокирующего возбуждающий свет.. Большинство флуоресцентных микроскопов работают в режиме Epi-освещения (освещение и обнаружение с одной стороны образца) для дальнейшего уменьшения количества возбуждающего света, попадающего в детектор.
См. Также: флуоресцентный микроскоп полного внутреннего отражения Neuroscience
Конфокальная лазерная сканирующая микроскопия использует сфокусированный лазерный луч ( например, 488 нм), который сканируется по образцу, чтобы возбуждать флуоресценцию поэтапно. Излучаемый свет направляется через точечное отверстие для предотвращения попадания расфокусированного света на детектор, обычно на фотоумножитель . Изображение строится в компьютере, на котором отображаются измеренные интенсивности флуоресценции в зависимости от положения возбуждающего лазера. По сравнению с полным освещением образца конфокальная микроскопия дает немного более высокое разрешение по горизонтали и значительно улучшает оптическое сечение (осевое разрешение). Поэтому конфокальная микроскопия обычно используется там, где важна трехмерная структура.
Подкласс конфокальных микроскопов - это микроскопы с вращающимся диском, которые могут сканировать несколько точек одновременно по образцу. Соответствующий диск с отверстиями отклоняет расфокусированный свет. Детектором света в микроскопе с вращающимся диском является цифровая камера, обычно EM-CCD или sCMOS.
Двухфотонный микроскоп является также лазерным. -сканирующий микроскоп, но вместо УФ, возбуждения используется импульсный инфракрасный лазер . Только в крошечном фокусе лазера интенсивность достаточно высока для генерации флуоресценции за счет двухфотонного возбуждения, что означает, что не требуется расфокусированной флуоресценции и не требуется точечное отверстие для очистки. Это позволяет получать изображения в рассеивающей ткани, где конфокальный микроскоп не способен эффективно собирать фотоны. Двухфотонные микроскопы с широким полем часто используются для функциональной визуализации, например визуализация кальция в тканях мозга. Некоторые компании продают их как многофотонные микроскопы, хотя преимущества использования трехфотонного излучения вместо двухфотонного возбуждения незначительны.
Использование плоскости света, образованной фокусировкой света через линзу под узким углом или сканированием линии света в плоскости, перпендикулярной По оси объектива можно снимать оптические срезы высокого разрешение. Одноплоскостное освещение, или освещение световым листом, также достигается использование методов формирования луча , включающих в себя расширители луча с использованием призмами. Изображения захватываются ПЗС-матрицами. Эти варианты обеспечивают очень быстрый просмотр с высоким отношением сигнал / шум.
Под многофотонной микроскопией с широким полем понимается метод оптического нелинейного изображения, при котором большая площадь объекта освещается и отображается без необходимости сканирования. Высокие интенсивности требуются, чтобы вызвать нелинейные оптические процессы, такие двухфотонная флуоресценция или генерация второй гармоники. В сканирующих многофотонных микроскопах высокая интенсивность достигается за счет жесткой фокусировки света, изображение путем сканирования луча. В многофотонной микроскопии с широким полем высокие интенсивности лучше всего достигаются при использовании импульсного лазерного источника с оптическим усилением для получения большого поля зрения (~ 100 мкм). Изображение в этом случае получается в виде одного кадра с помощью камеры CCD без необходимости сканирования, что делает метод особенно полезного для визуализации динамических процессов одновременно по интересующему объекту. С помощью широкоугольной многофотонной микроскопии частота кадров может быть увеличена до 1000 раз по сравнению с многофотонной сканирующей микроскопией. Плохое качество изображения плохого качества изображения.
Флуоресцентная микроскопия - это мощный метод, позволяющий показать специально помеченные структуры в сложной среде и трехмерную информацию о биологических структурах. Однако эта информация размывается из-за того, что при освещении все флуоресцентно меченые структуры излучают свет независимо от того, в фокусе они или нет. Таким образом, изображение этой структуры всегда размывается из-за попадания света от структуры, находящейся в фокусе. Это явление приводит к потере контраста, особенно при использовании объективов с высокой разрешающей способностью, обычно масляных иммерсионных объективов с высокой числовой апертурой.
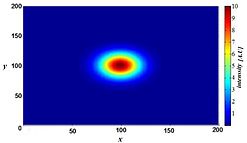 Математически смоделированная функция рассеяния точки импульсной системы формирования изображения терагерцевого лазера.
Математически смоделированная функция рассеяния точки импульсной системы формирования изображения терагерцевого лазера. Однако размытость не вызывается случайными процессами, такими как рассеяние света, но может быть хорошо определена оптическими методами формирования изображения в микроскопе система визуализации. Если рассматривать небольшой флуоресцентный источник света (по нашей сути, яркое пятно), свет, исходящий из этого пятна, распространяется дальше с точки зрения, поскольку пятно становится все более не в фокусе. В идеальных условиях это дает форму «песочных часов» этого точечного источника в третьем (осевом) измерении. Эта форма называется функцией рассеяния точки (PSF) системы визуализации микроскопа. Любое флуоресцентное изображение флуоресцентного света, изображение, называемое «свернутым функцией рассеяния точки». Математически смоделированный PSF системы формирования изображения терагерцового лазера показан справа.
Выходные данные системы визуализации можно описать с помощью уравнений:
Где n- аддитивный шум. Знание этой функции рассеяния точки означает, что можно до некоторой степени обратить этот процесс вспять с помощью компьютерных методов, широко известных как деконволюционная микроскоп. Существуют различные алгоритмы 2D или 3D деконволюции. Их можно условно разделить на безремонтные и реставрационные методы. В то время как нереставрационные методы могут улучшить контраст, удаляя расфокусированный свет из фокальных плоскостей, только реставрационные методы фактически не переназначить свет на его надлежащее место происхождения. Обработка флуоресцентных изображений таким образом может быть преимуществом по сравнению с прямым использованием изображений без расфокусированного света, например изображений из конфокальной микроскопии, поскольку световые сигналы, в случае устранения устраненные, становятся полезной информацией. Для трехмерной деконволюции обычно используется серию изображений, снятых из разных фокальных плоскостей (называемых Z-стеком), плюс знание PSF, которое может быть получено экспериментально или теоретически на основе знания всех параметров микроскопа.
 Пример микроскопии сверхвысокого разрешения. Изображение Her3 и Her2, мишени рака груди препарат трастузумаб, внутри раковой клетки.
Пример микроскопии сверхвысокого разрешения. Изображение Her3 и Her2, мишени рака груди препарат трастузумаб, внутри раковой клетки. Множество супер В последнее время были разработаны методы разрешающей микроскопии, позволяющие обойти дифракционный барьер.
В основном это достигается путем многократного отображения возбуждающего света, либо наблюдения за стохастическими изменениями изображения. Методы деконволюции, описанные в предыдущем разделе, устраняют вызванное PSF размытие и назначают математически «правильное» происхождение света, используются, хотя и с немного пониманием значения пикселя. Предполагаемая, что большая часть времени один-единственный, вносит свой вклад в одну-единственную каплю на одном единственном полученном изображении, капли на изображениях можно заменить их расчетным положением, что улучшает разрешение до уровня значительно ниже дифракционного предела.
Для реализации такого предположения в основе этих методов лежат знания и химический контроль фотофизики флуорофоров, с помощью которых достигается разрешение ~ 20 нанометров.
Усиленная микроскопия с последовательным кодированием во времени (STEAM) - это метод визуализации, который обеспечивает сверхбыструю выдержку и частоту кадров для использования оптического усиления, позволяющего обойти фундаментальный изображения компромисс между чувствительностью и скоростью, и однопиксельной фотодетектор для устранения необходимости в матрице детекторов и ограничений времени считывания. Этот метод как минимум в 1000 раз быстрее, чем современные CCD и CMOS камеры. Следовательно, он полезен для широкого круга научных, промышленных и биомедицинских приложений, которые требуют высокой скорости изображения, включая диагностику в реальном времени и оценку ударных волн, микрофлюидику, MEMS, и лазерная хирургия.
Большинство современных инструментов используют простые решения для электронной микрофотографии и записи изображений. Однако такие возможности не всегда присутствуют, и более опытный микроскопист во многих случаях все же предпочтет нарисованное от руки изображение фотографии. Это потому, что микроскопист, знакомый с предметом, может точно преобразовать трехмерное изображение в точный двухмерный рисунок. Однако на фотографии или другой системе захвата изображения только одна тонкая плоскость всегда находится в хорошем фокусе.
Создание аккуратных и точных микрофотографий требует микроскопической техники с использованием монокулярного окуляра. Важно, чтобы оба глаза были открыты, и чтобы глаз, который не наблюдает в микроскоп, вместо этого был сосредоточен на листе бумаги на столе рядом с микроскопом. С практикой, не двигая головой или глазами, можно точно записывать наблюдаемые детали, обводя наблюдаемые формы, одновременно «видя» острие карандаша на микроскопическом изображении.
Практика этой техники также устанавливает хорошую микроскопическую технику. Всегда менее утомительно наблюдать с микроскопом, сфокусированным так, чтобы изображение было видно на бесконечности и всегда с обоими глазами.
Микроспектроскопия: спектроскопия с помощью микроскопа
Временное разрешение зависит от длины волны света. Электронная микроскопия была ограничена с 1930-х годов, в которой вместо света используются электронные лучи. Из-за размера длины волны электронного луча разрешение намного выше.
Хотя и реже, рентгеновская микроскопия также разрабатывалась с конца 1940-х годов. Разрешение рентгеновской микроскопии находится между разрешающей способностью световой микроскопии и электронной микроскопии.
До изобретения субдифракционной микроскопии длина волны света ограничивала разрешение традиционной микроскопии примерно до 0,2 микрометра. Чтобы получить более высокое разрешение, электронные микроскопах используется пучок электронов с гораздо меньшей длиной волны.
Электронные микроскопы, оборудованные для рентгеновской спектроскопии, могут обеспечить качественный и количественный элементный анализ. Этот тип электронного микроскопа, также известный как аналитический электронный микроскоп, может быть очень мощным инструментом характеристики для исследования наноматериалов.
Это метод субдифракции. Примерами сканирующих зондовых микроскопов являются атомно-силовой микроскоп (AFM), Сканирующий туннельный микроскоп, фотонный силовой микроскоп и повторный трековый микроскоп. Все такие методы используют физический контактного наконечника зонда для поверхности объекта, которая должна быть почти плоской.
Ультразвуковая силовая микроскопия (UFM) была улучшена для улучшения деталей и контрастности изображения на «плоских» областях интереса, где изображения AFM ограничены по контрасту. Комбинация AFM-UFM позволяет сформировать акустическое микроскопическое изображение ближнего поля. Наконечник АСМ использует обнаружение ультразвуковых волн и преодолевает ограничение длины волны, встречается в акустической микроскопии. Используя эластичные изменения под наконечником АСМ, можно получить изображение с большей детализацией, чем топография АСМ.
Ультразвуковая силовая микроскопия позволяет локально отображать эластичность в атомно-силовой микроскопии посредством приложения ультразвуковой вибрации к кантилеверу или образцу. В попытке количественно проанализировать результаты ультразвуковой силовой микроскопии, выполняется измерение кривой силы-расстояния с ультразвуковой вибрацией, приложенной к основанию кантилевера, и результаты сравниваются с моделью динамики кантилевера и взаимодействия зонд-образец. на основе конечно-разностной техники.
Ультрафиолетовые микроскопы имеют две основные цели. Первый заключается в использовании более короткой длины волны ультрафиолетовой электромагнитной энергии для улучшения разрешения изображения, превышающего дифракционный предел стандартных оптических микроскопов. Этот метод используется для неразрушающего контроля устройств с очень мелкими характеристиками, такими как те, которые встречаются в современных полупроводниках. Второе применение ультрафиолетовых микроскопов - это усиление контраста, при котором реакция отдельных образцов увеличивается по сравнению с их окружением из-за взаимодействия света с молекулами внутри самого образца. Одним из примеров является рост кристаллов протеина. Кристаллы белка образуются в солевых растворах. Поскольку в процессе роста образуются и соль, и кристаллы белка, и оба они обычно прозрачны для человеческого глаза, их невозможно различить с помощью стандартного оптического микроскопа. Поскольку триптофан из белка поглощает свет с длиной волны 280 нм, получение изображения с помощью УФ-микроскопа с полосовыми фильтрами 280 нм позволяет легко различать два типа кристаллов. Кристаллы протеина кажутся темными, а кристаллы соли прозрачными.
Термин инфракрасная микроскопия относится к микроскопии, выполняемой на инфракрасных длинах волн. В типичной конфигурации прибора инфракрасный спектрометр с преобразованием Фурье (FTIR) объединен с оптическим микроскопом и инфракрасным детектором . Инфракрасный детектор может быть одноточечным детектором, линейной решеткой или двумерной решеткой в фокальной плоскости. FTIR дает возможность выполнять химический анализ с помощью инфракрасной спектроскопии, а микроскоп и точечный или матричный детектор позволяют проводить этот химический анализ с пространственным разрешением, то есть выполнять в различных областях образца. По существу, этот метод также называется инфракрасной микроскопией. Альтернативная архитектура, называемая Laser Direct Infrared (LDIR) Imaging, включает комбинацию настраиваемого источника инфракрасного света и одноточечного детектора на летающем объекте). Этот метод часто используется для инфракрасной химической визуализации, где контраст изображения определяется реакцией отдельных областей образца на определенные длины волн ИК-излучения, выбранные пользователем, обычно конкретные полосы ИК-поглощения и связанные молекулярные резонансы. Ключевым ограничением традиционной инфракрасной микроскопии является то, что пространственное разрешение ограничено дифракцией. В частности, пространственное разрешение ограничено числом, относящимся к длине волны света. Для практических ИК-микроскопов пространственное разрешение ограничено 1-3-кратной длиной волны, в зависимости от конкретной техники и используемого инструмента. Для длин волн среднего ИК-диапазона это устанавливает практический предел пространственного разрешения ~ 3-30 мкм.
Существуют также ИК-версии субдифракционной микроскопии. К ним относятся ИК сканирующий оптический микроскоп ближнего поля (NSOM), фототермическая микроскопия, нано-FTIR и атомно-силовой микроскоп на основе инфракрасной спектроскопии (AFM- ИК).
 Клетки человека, полученные с помощью фазовой микроскопии DHM (слева) и фазово-контрастной микроскопии (справа).
Клетки человека, полученные с помощью фазовой микроскопии DHM (слева) и фазово-контрастной микроскопии (справа). В цифровой голографической микроскопии (DHM), мешающие волновые фронты от когерентного (монохроматического) источника света регистрируются на датчике. Изображение реконструируется компьютером в цифровой форме из записанной голограммы . Помимо обычного изображения в светлом поле, создается изображение с фазовым сдвигом .
DHM может работать как в режиме отражения, так и в режиме передачи. В режиме отражения изображение с фазовым сдвигом обеспечивает измерение относительного расстояния и, таким образом, представляет карту топографии отражающей поверхности. В режиме пропускания изображение с фазовым сдвигом обеспечивает количественное измерение оптической толщины образца без этикеток. Изображения с фазовым сдвигом биологических клеток очень похожи на изображения окрашенных клеток и были успешно проанализированы с помощью программного обеспечения для анализа высокого содержания.
Уникальной особенностью DHM является возможность регулировки фокуса после записи изображения, поскольку все плоскости фокусировки записываются голограммой одновременно. Эта функция позволяет отображать движущиеся частицы в объеме быстро сканировать поверхность. Еще одна привлекательная особенность DHM - это возможность использовать недорогую оптику для счетной коррекции оптических аберраций.
Цифровая патология - это информационная среда на основе изображений, созданных с помощью компьютерных технологий, которая позволяет управлять, полученной с помощью цифрового слайда. Цифровая патология, которая работает через микроскопию, представляет собой преобразование стеклянных слайдов в цифровые слайды, которые можно просматривать, управлять и анализировать.
Лазерная микроскопия - это быстро развивающаяся область, в которой источники лазерного излучения используются в различных формах микроскопии. Например, в лазерной микроскопии, ориентированы на биологические приложения, используются лазеры с ультракороткими импульсами , в некоторых методах, обозначенных как нелинейная микроскопия, микроскопия насыщения и микроскопия с двухфотонным возбуждением.
Высокоинтенсивная, короткая -импульсные лабораторные рентгеновские лазеры Создаются уже несколько лет. Когда эта технология будет реализована, станет возможным получить увеличенные трехмерные изображения элементарных биологических структур в точно определенном состоянии. Для оптимального контраста между линиями примерно на 0,3 нанометра следует настраивать около азота линии примерно на 0,3 нанометра. Разрешение будет ограничиваться в основном гидродинамическим расширением, которое происходит при регистрации необходимого количества фотонов. Таким образом, хотя образец разрушается в результате воздействия, его конфигурация может быть зафиксирована до того, как он взорвется.
Ученые работали над практическими конструкциями и прототипами для рентгеновских голографических микроскопов, несмотря на длительную разработку соответствующих лазерных.
Метод микроскопии, основанный на фотоакустическом эффекте, то есть генерации (ультра) звука, вызванного поглощением света. Сфокусированный и модулированный по интенсивности лазерный луч сканируется в растровом формате по образцу. Генерируемый (ультразвуковой) звук обнаруживается ультразвуковым преобразователем. Обычно используются пьезоэлектрические ультразвуковые преобразователи.
Контраст изображения связан с коэффициентом поглощения образца 


Здесь 


Без учета нелинейных эффектов, поперечное разрешение dxограничено дифракционным пределом Аббе :
где 
Любительская микроскопия - это исследование и наблюдение биологических и небиологические образцы для развлекательных целей. Коллекционеры минералов, насекомых, ракушек и растений могут использовать микроскопы в качестве инструментов, чтобы выявить полезные особенности они классифицируют собранные ими предметы. Другим любителям может быть интересно понаблюдать за жизнью в пруду и в других образцах. Микроскопы также могут оказаться полезными для оценки качества воды для людей, которые держат. Фотографическое документирование и нанесение микроскопических изображений - дополнительные задачи, расширяющие спектр задач любителя. Есть даже конкурсы на микрофотографию арт. Участники этого времяпрепровождения могут использовать коммерчески подготовленные предметные стекла или заниматься подготовкой образцов.
Хотя микроскопия является центральным инструментом в документации биологических образцов, ее, как правило, недостаточно, чтобы оправдать описание нового вида, основанное только на микроскопических исследованиях. Часто для подтверждения открытия нового вида необходимы генетические и биохимические тесты. лаборатория и доступ к академической литературе - это необходимость, которая носит специализированный характер и, как правило, недоступна для любителей. Однако у любителей есть одно огромное преимущество перед профессионалами: время исследовать свое окружение. Часто опытные любители объединяются с профессионалами, чтобы подтвердить свои выводы и (возможно) описать новые виды.
В конце 1800-х годов любительская микроскопия стала популярным хобби в США и Европе. Некоторым `` профессиональным любителям '' платили филантропы за поездки для отбора проб и микроскопические исследования, чтобы развлечь их в воскресенье днем (например, специалист по диатомовым водорослям А. Грунов, которому (среди прочего) платил бельгийский промышленник). Профессор Джон Фин опубликовал «Практические советы по выбору и использованию микроскопа (второе издание, 1878 г.)», а также был редактором «Американского журнала микроскопии».
Примеры любительских снимков с микроскопии:

«Домашняя пчела» Рот 100X

Стебель риса cs 400X

Яичко кролика 100X

Папоротник Prothallium 400X
Микроскопия имеет множество применений в судебной медицине; он обеспечивает точность, качество, точность и воспроизводимость результатов. Эти приложения практически безграничны. Это связано со способностью микроскопа обнаруживать, распознавать и отображать мельчайшие доказательства, часто без каких-либо изменений или разрушений. Микроскоп используется для идентификации и сравнения волокон, волос, грязи, пыли и т. Д.
Цель любого микроскопа - увеличить изображение или фотографию небольшого объекта и увидеть мелкие детали. В судебной медицине; Тип образца, информация, которую нужно получить от него, и тип микроскопа, выбранного для данной задачи, определяют, требуется ли подготовка образца. Например, чернильные линии, пятна крови или пули, обработка не требуется, и доказательства видны непосредственно с соответствующего микроскопа без какой-либо формы подготовки образца, но для следов определенного вещества подготовка образца должна быть сделана до микроскопического исследования.
В лабораториях судебной экспертизы используются различные микроскопы. Световые микроскопы наиболее широко используются в судебной медицине, и эти микроскопы используют фотоны для формирования изображений. Эти микроскопы, которые наиболее применимы для исследования образцов судебно-медицинской экспертизы, как упоминалось выше, следующие:
1. Составной микроскоп
2. Микроскоп сравнения
3. Стереоскопический микроскоп
4. Поляризационный микроскоп
5. Микроспектрофотометр
Такое разнообразие типов микроскопов, используемых в судебной медицине, в основном обусловлено диапазоном увеличения, который составляет (1-1200X), (50-30,000X) и (500-250,000X) для оптического микроскопия, SEM и TEM соответственно.
| На Wikimedia Commons есть носители, связанные с Microscopy. |