| ланостерин-синтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 5.4.99.7 | ||||||||
| Номер CAS | 9032- 71-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Представление IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология гена | AmiGO / QuickGO | ||||||||
| |||||||||
Ланостеринсинтаза - это оксидосквален циклаза (OSC) фермент, который превращает (S) -2, 3-оксидосквален с катионом протостерина и, наконец, с ланостерином. Ланостерин является ключевым четырехкольцевым промежуточным соединением в биосинтезе холестерина. У людей ланостерин-синтаза кодируется геном LSS .
. У эукариот ланостерин-синтаза представляет собой интегральный монотопный белок, связанный с цитозольной стороной эндоплазматического ретикулума. Некоторые данные свидетельствуют о том, что фермент представляет собой растворимый, не мембраносвязанный белок в немногих прокариотах, которые его продуцируют.
В связи с ролью фермента в биосинтезе холестерина существует интерес к ингибиторам ланостеринсинтазы в качестве потенциальных препаратов, снижающих уровень холестерина, в дополнение к существующим статинам.
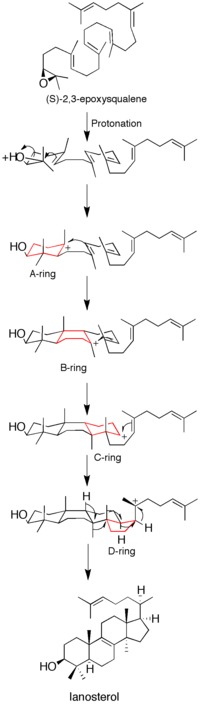 Рисунок 1: Ланостерол синтазный механизм. Дискретные промежуточные соединения карбокатиона демонстрируют несогласованную природу механизма.
Рисунок 1: Ланостерол синтазный механизм. Дискретные промежуточные соединения карбокатиона демонстрируют несогласованную природу механизма. Хотя некоторые данные о механизме были получены с использованием суицидных ингибиторов, исследований мутагенеза и моделирование гомологии, до сих пор не совсем понятно, как фермент катализирует образование ланостерола.
До получения рентгеновскую кристаллическую структуру, сайт-направленный мутагенез белка использовали для определения остатков, определяющих каталитическую активность фермента. Было определено, что остаток аспарагиновой кислоты (D455) и два остатка гистидина (H146 и H234) были важны для функции фермента. Кори и др. предположил, что аспарагиновая кислота действует, протонируя эпоксидное кольцо субстрата, тем самым увеличивая его восприимчивость к внутримолекулярной атаке ближайшей двойной связью, при этом H146, возможно, усиливает протон донорная способность аспарагиновой кислоты через водородную связь. После получения рентгеновской кристаллической структуры фермента роль D455 в качестве донора протонов эпоксида субстрата была подтверждена, хотя было обнаружено, что D455 более вероятно стабилизируется водородными связями из двух остатков цистеина (C456 и C533), чем из ранее предложенного гистидина.
Протонирование эпоксида активирует субстрат, запуская каскад реакций образования кольца. Всего образуются четыре кольца (от A до D), производящие основу холестерина. Хотя идея согласованного образования всех четырех колец высказывалась в прошлом, кинетические исследования с аналогами (S) -2,3-оксидосквалена показали, что образование продукта достигается за счет дискретного карбокатиона промежуточные продукты (см. рис. 1 ). Выделение моноциклических и бициклических продуктов из мутантов ланостеринсинтазы еще больше ослабило гипотезу о согласованном механизме. Однако данные свидетельствуют о том, что раскрытие эпоксидного кольца и образование A-кольца согласованы.
Ланостеринсинтаза представляет собой двухдоменный мономерный белок, состоящий из двух связанных (α / α) бочкообразных доменов и трех меньшие β-структуры. Активный сайт фермента находится в центре белка, закрытого суженным каналом. Прохождение субстрата (S) -2,3-эпоксисквалена через канал требует изменения конформации белка. У эукариот, гидрофобная поверхность (6% от общей площади поверхности фермента) является мембрано-связывающей областью ER (см. Рисунок 2 ).
Фермент содержит пять областей отпечатка пальца, содержащих мотивы Gln - Trp, которые также присутствуют в очень аналогичном бактериальном ферменте сквален-гопенциклаза. Остатки этих областей отпечатка пальца содержат наложенные друг на друга боковые цепи, которые являются считается, что способствует стабильности фермента во время высоко экзергонических реакций циклизации, катализируемых ферментом.
Ланостеринсинтаза катализирует преобразование в ланостерол, ключевой четырехкольцевый промежуточный продукт в биосинтезе холестерина. Таким образом, он, в свою очередь, обеспечивает предшественник эстрогенов, андрогенов, прогестагены, глюкокортикоиды, минералокортикоиды и нейростероиды. У эукариот фермент связан с cy тозольная сторона мембраны эндоплазматического ретикулума. Хотя синтез холестерина в основном связан с эукариотами, было обнаружено, что некоторые прокариоты экспрессируют ланостеринсинтазу; он был обнаружен как растворимый белок в Methylococcus capsulatus.
Ланостеринсинтаза также катализирует циклизацию 2,3; 22,23-диэпоксисквалена до 24 (S), 25 -эпоксиланостерин, который позже превращается в 24 (S), 25-эпоксихолестерин. Поскольку сродство фермента к этому второму элементу больше, чем к моноэпокси (S) -2,3-эпоксисквалену, при частичном ингибировании превращения 2,3; 22,23-диэпоксисквалена в 24 (S) 25-эпоксиланостерин предпочтительнее, чем синтез ланостерина. Это имеет отношение к профилактике и лечению заболеваний (см. Актуальность заболевания ниже).
Возрос интерес к ингибиторам ланостеринсинтазы как к препаратам для снижения холестерина в крови и лечения атеросклероза. Широко популярные препараты статина, используемые в настоящее время для снижения функции холестерина ЛПНП (липопротеинов низкой плотности) путем ингибирования активности HMG-CoA редуктазы. Поскольку этот фермент катализирует образование предшественников намного выше (S) -2,3-эпоксисквалена и холестерина, статины могут отрицательно влиять на количество промежуточных соединений, необходимых для других путей биосинтеза (например, синтеза из изопреноидов, кофермента Q ). Таким образом, ланостерин-синтаза, которая более тесно связана с биосинтезом холестерина, чем HMG-CoA-редуктаза, является привлекательной лекарственной мишенью.
Считается, что ингибиторы ланостеринсинтазы снижают LDL и холестерин VLDL с помощью механизма двойного контроля. Исследования, в которых частично ингибируется ланостеринсинтаза, показали как прямое снижение образования ланостерола, так и снижение активности HMG-CoA редуктазы. оксистерин 24 (S), 25-эпоксиланостерин, который предпочтительно образуется вместо ланостерола во время частичного ингибирования ланостеринсинтазы, как полагают, ответственным за это ингибирование HMG-CoA редуктазы активность.
Считается, что оксидоскваленциклазы (OSC, класс, к которому принадлежит ланостеринциклаза) произошли от бактериальной сквален-гопенциклазы (SHC), которая участвует с образованием гопаноидов. Филогенетические деревья, построенные на основе аминокислотных последовательностей OSC в различных организмах, предполагают единого общего предка и что путь синтеза развивался только один раз. Обнаружение включения холестана в сланцы возрастом 2,7 миллиарда лет из Пилбара Кратон, Австралия, предполагает, что эукариоты с OSC и комплексом стероидные механизмы присутствовали в ранней истории Земли.