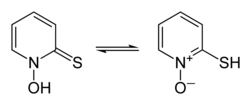
 . Взаимное превращение таутомеров пиритиона. Форма тиона слева, форма тиола справа . Взаимное превращение таутомеров пиритиона. Форма тиона слева, форма тиола справа | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1-гидрокси-2 (1H) -пиридинтион (тион). 2-пиридинтиол-1-оксид (тиол) | |
| Другие названия Омадин. тион : 1-гидроксипиридин-2-тион. N-гидроксипиридин-2-тион. тиол : 2-меркаптопиридин моноксид. 2-меркаптопиридин N-оксид. 2-меркаптопиридин 1 -оксид | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.013.027 |
| PubChem CID | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C5H5NOS |
| Молярная масса | 127,16 г · моль |
| Внешний вид | Бежевый кристаллический порошок |
| Температура плавления | от 70 до 73 ° C (от 158 до 163 ° F; От 343 до 346 K) |
| Растворимость в воде | 2,5 г л при 20 ° C |
| Растворимость | Растворимость : бензол, хлороформ, дихлорметан, диметилформамид, диметилсульфоксид, этилацетат. Малорастворимый : диэтиловый эфир, этанол, метил-трет-бутиловый эфир, тетрагидрофуран |
| Кислотность (pK a) | -1,95, 4,6 |
| Опасности | |
| R-фразы ( устарело) | R20 / 21/22, R36 / 37/38, R63 |
| S-фразы (устаревшие) | S22, S24 / 25, S26, S36 / 37 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на информационные панели | |
Пиритион - это общее название сероорганического соединения с молекулярной формулой C. 5H. 5NOS, выбранное как сокращение от пиридинтион и обнаруженное в персидском языке. лук-шалот. Он существует в виде пары таутомеров, основной формой является тион 1-гидрокси-2 (1H) -пиридинтион и второстепенной формой является тиол N-оксид 2-меркаптопиридина ; он кристаллизуется в форме тиона. Обычно его получают либо из 2-бромпиридина, 2-хлорпиридина, либо, и он коммерчески доступен как в виде нейтрального соединения, так и его натриевой соли. Он используется для приготовления пиритиона цинка, который используется в первую очередь для лечения перхоти и себорейного дерматита в лечебных шампунях, но также является противообрастающий агент в красках.
Приготовление о пиритионе впервые сообщил в 1950 году Шоу, и он был получен реакцией с гидросульфидом натрия с последующим подкислением или совсем недавно с сульфидом натрия. Сам N-оксид 2-хлорпиридина может быть получен из 2-хлорпиридина с использованием перуксусной кислоты. Другой подход включает обработку того же исходного N-оксида тиомочевиной с получением N-оксида пиридил-2-изотиоурония хлорида, который подвергается основному гидролизу до пиритиона. 2-Бромпиридин может быть окислен до его N-оксид с использованием подходящей перкислоты (как для 2-хлорпиридина), причем оба подхода аналогичны описанным в Organic Syntheses для окисления пиридина до его N-оксид. реакция замещения с использованием либо дитионита натрия (Na. 2S. 2O. 4), либо сульфида натрия с гидроксидом натрия позволит заменить бромзаместитель на тиол функциональная группа.
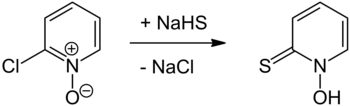
Альтернативная стратегия заключается в образовании меркаптана перед введением N-оксидной составляющей. 2-Меркаптопиридин был первоначально синтезирован в 1931 году путем нагревания 2-хлорпиридина с помощью метода, аналогичного тому, который впервые был использован для получения пиритиона. Аналогичный подход с использованием тиомочевины с использованием соли урония был описан в 1958 году и обеспечивает более удобный способ получения 2-меркаптопиридина. Затем может быть проведено окисление до N-оксида.
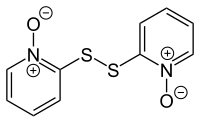 дисульфид дипиритион, 2,2'-дитиобис (пиридин-N-оксид)
дисульфид дипиритион, 2,2'-дитиобис (пиридин-N-оксид) Пиритион обнаружен как натуральный продукт в Allium stipitatum растение, азиатский вид лука, также известный как персидский лук-шалот. Его присутствие было обнаружено с помощью положительной ионной масс-спектрометрии с использованием источника ионов для прямого анализа в реальном времени и дисульфида [de ] (2,2'-дисульфандиилбис (пиридин) -1,1'-диоксид) сообщалось от того же вида. Дипиритион можно получить в лаборатории путем окисления пиритиона хлором в присутствии гидроксида натрия :
Дипиритион используется в качестве фунгицида и бактерицида и, как сообщается, обладает новым цитотоксическая активность за счет индукции апоптоза.
 Таутомеризация натриевой соли пиритиона. (форма тиона слева, форма тиолата справа)
Таутомеризация натриевой соли пиритиона. (форма тиона слева, форма тиолата справа) Пиритион существует в виде пары прототропы, форма таутомерии, при которой быстрое взаимное превращение структурных изомеров включает сдвиг одного протона, в данном случае между атомами серы и кислорода (показано в информационном окне). Соли конъюгированного основания пиритиона также можно рассматривать как проявляющие таутомерию, условно связывая ион натрия с любым гетероатомом, несущим отрицательный заряд аниона (в отличие от fo нормальные заряды, связанные с N-оксидом); однако, рассматривая только анион, это также можно описать как пример резонанса.
Пиритион - слабая кислота со значениями pKa -1,95 и +4,6 (тиоловый протон), но это заметно более сильная кислота. чем любое из его исходных соединений (пиридин-N-оксид и пиридин-2-тиол), оба из которых имеют pK a>8. Он слабо растворим в воде (2,5 г л), но растворим во многих органических растворителях (включая бензол, хлороформ, дихлорметан, диметилформамид, диметилсульфоксид и этилацетат ) и небольшая растворимость в других (диэтиловый эфир, этанол, метил-трет- бутиловый эфир и тетрагидрофуран ).
Пиритион можно использовать в качестве источника гидроксильного радикала в органическом синтезе, так как он фотохимически разлагается на НО и (пиридин-2-ил) сульфанильный радикал.
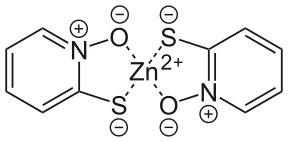
 Структуры 1: 2 комплексов цинка и сопряженного основания пиритиона. Вверху : Структурная формула мономера. Внизу : Шарообразная модель димера
Структуры 1: 2 комплексов цинка и сопряженного основания пиритиона. Вверху : Структурная формула мономера. Внизу : Шарообразная модель димера сопряженное основание пиритиона представляет собой анион, содержащий два донорных атома, атом серы и атом кислорода, каждый несущий отрицательный формальный заряд ; атом азота остается формально положительно ch arged. Тиолат-анион может быть образован реакцией с карбонатом натрия, а пиритион цинка образуется при добавлении хлорида цинка. Анион может действовать как монодентатный или бидентатный лиганд и образует 1: 2 комплекс с металлическим центром цинка (II). Пиритион цинка используется с 1930-х годов, хотя его получение не было раскрыто до британского патента 1955 года, в котором пиритион подвергался непосредственной реакции с гидратированным сульфатом цинка в этаноле. В своей мономерной форме пиритион цинка содержит два аниона , хелатированных с цинковым центром с тетраэдрической геометрией. В твердом состоянии он образует димер, в котором каждый цинковый центр принимает тригонально-бипирамидную геометрию с двумя анионами, действующими как мостиковые лиганды, координированные через кислород атомы в аксиальных позициях. В растворе димеры диссоциируют через разрыв цинк-кислородных связей с каждым мостиковым лигандом. Дальнейшая диссоциация мономера на его составляющие может происходить и нежелательна, поскольку комплекс более эффективен в медицинских применениях; по этой причине в составы можно добавлять карбонат цинка, поскольку он ингибирует диссоциацию мономера.
Пиритион цинка давно используется в лечебных шампунях для лечения перхоть и себорейный дерматит (перхоть может считаться легкой формой себорейного дерматита). Он проявляет как противогрибковые, так и антимикробные свойства, ингибируя дрожжи Malassezia, которые способствуют возникновению этих состояний кожи головы. Механизмы, с помощью которых работает эта работа, являются предметом постоянного изучения. Его можно использовать в качестве антибактериального агента против инфекций Staphylococcus и Streptococcus при таких состояниях, как микоз стопы, экзема, псориаз и стригущий лишай. Известно, что он цитотоксичен против Pityrosporum ovale, особенно в комбинации с кетоконазолом, который является предпочтительным препаратом для лечения себорейного дерматита. Сам по себе пиритион подавляет процессы мембранного транспорта у грибов.
Краски, используемые во внешней среде, иногда содержат пиритион цинка в качестве профилактического средства против водорослей и плесени.