Сероорганические соединения - это органические соединения, содержащие серу. Они часто связаны с неприятным запахом, но многие из самых сладких известных соединений являются производными серы, например, сахарин. Природа изобилует сероорганическими соединениями - сера необходима для жизни. Из 20 распространенных аминокислот две (цистеин и метионин ) представляют собой сероорганические соединения, а антибиотики пенициллин и сера препараты оба содержат серу. В то время как серосодержащие антибиотики спасают множество жизней, серный иприт является смертельным боевым химическим веществом. Ископаемые виды топлива, уголь, нефть и природный газ, которые получены из древних организмов, обязательно содержат сероорганические соединения, удаление который является основным направлением нефтеперерабатывающих заводов.
Сера разделяет группу халькогенов с кислородом, селеном и теллур, и ожидается, что сероорганические соединения имеют сходство с соединениями углерод-кислород, углерод-селен и углерод-теллур.
Классическим химическим тестом для обнаружения соединений серы является галогенный метод Кариуса.
Сероорганические соединения могут быть классифицированы в соответствии с серосодержащими функциональными группами, которые перечислены (приблизительно) в порядке убывания их появления.
Аллицин, активный ароматизатор в измельченном чесноке

(R) - Цистеин, аминокислота, содержащая тиольную группу

Метионин, аминокислота, содержащая сульфид

Дифенилдисульфид, типичный дисульфид

Дибензотиофен, компонент сырой нефти
Перфтороктансульфоновая кислота, сомнительное поверхностно-активное вещество
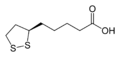
Липоевая кислота, важный кофактор четырех комплексов митохондриальных ферментов.

Пенициллин основная структура, где «R» - группа переменных.

Сульфаниламид, сульфонамид антибактериальное средство, называемый сульфамидным препаратом.
Серный горчичный, тип сульфида, используемый в качестве боевой химический агент.
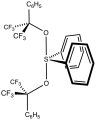
сульфуран Мартина с качающейся структурой, как у SF 4
Сульфиды, ранее известные как тиоэфиры, характеризуются C-S-C связи По сравнению со связями C-C, связи C-S длиннее, потому что атомы серы больше, чем атомы углерода, и примерно на 10% слабее. Типичные длины связи в соединениях серы составляют 183 пм для простой связи S-C в метантиоле и 173 пм в тиофене. Энергия диссоциации связи C-S для тиометана составляет 89 ккал / моль (370 кДж / моль) по сравнению со 100 ккал / моль (420 кДж / моль) метана, и когда водород заменяется метильной группой, энергия снижается до 73 ккал / моль (305 кДж / моль). Простая связь углерода с кислородом короче, чем связь C-C. Энергии диссоциации связи для диметилсульфида и диметилового эфира составляют соответственно 73 и 77 ккал / моль (305 и 322 кДж / моль).
Сульфиды обычно получают алкилированием тиолов. Их также можно получить с помощью перегруппировки Pummerer. В одной названной реакции, называемой реакцией Феррарио фениловый эфир превращается в феноксатиин под действием элементарной серы и хлорида алюминия.

тиоацеталей и тиокеталы имеют последовательность связей C-S-C-S-C. Они представляют собой подкласс сульфидов. Тиоацетали полезны в «удалении » карбонильных групп. Тиоацетали и тиокетали также можно использовать для защиты карбонильной группы в органическом синтезе.
Вышеупомянутые классы соединений серы также существуют в насыщенных и ненасыщенных гетероциклических структурах, часто в сочетании с другими гетероатомами, как проиллюстрировано тииранами, тиирены, тиетаны, тиетаны, дитиетаны, тиоланы, тианы, дитианы, тиепаны, тиепины, тиазолы, изотиазолы и тиофены и другие.. Последние три соединения представляют собой особый класс серосодержащих гетероциклов, которые являются ароматическими. резонансная стабилизация для тиофена составляет 29 ккал / моль (121 кДж / моль) по сравнению с 20 ккал / моль (84 кДж / моль) для кислородного аналога фурана <235.>. Причина этой разницы заключается в более высокой электроотрицательности для кислорода, увлекающего электроны к себе за счет тока ароматического кольца. Однако в качестве ароматического заместителя тиогруппа в меньшей степени высвобождает электроны, чем алкоксигруппа. Дибензотиофены (см. Рисунок), трициклические гетероциклы, состоящие из двух бензольных колец, конденсированных с центральным тиофеновым кольцом, широко встречаются в более тяжелых фракциях нефти.
Тиоловая группа содержат функциональные группы R-SH. Тиолы структурно подобны группе спиртов, но эти функциональные группы сильно различаются по своим химическим свойствам. Тиолы более нуклеофильны, более кислые и более легко окисляются. Эта кислотность может отличаться на 5 pKa единиц.
Разница в электроотрицательности между серой (2,58) и водородом (2,20) мала, и поэтому водородная связь в тиолы не выделяются. Алифатические тиолы образуют монослои на золоте, актуальные для нанотехнологии.
. Доступ к некоторым ароматическим тиолам можно получить с помощью реакции Герца.
Дисульфидов R-S-S-R со связью ковалентной серы с серой важны для сшивки : в биохимии для укладки и стабильности некоторых белков и в химии полимеров для сшивки резины.
Также известны более длинные серные цепи, например, в натуральном продукте варацин, который содержит необычное пентатиепиновое кольцо (5-серная цепь, циклизованная на бензольное кольцо).
Тиоэфиры имеют общую структуру R-C (O) -S-R. Они относятся к обычным сложным эфирам (R-C (O) -O-R), но более подвержены гидролизу и родственным реакциям. Тиоэфиры широко используются в биохимии, особенно в синтезе жирных кислот.
A сульфоксид, R-S (O) -R, представляет собой S-оксид сульфида («оксид сульфида»), сульфон, R-S (O) 2 -R, представляет собой S, S-диоксид сульфида, тиосульфинат, R-S (O) -S-R, представляет собой S-оксид дисульфида и тиосульфоната, R-S (O) 2 -S-R, представляет собой S, S-диоксид дисульфида. Все эти соединения хорошо известны в обширной химии, например, диметилсульфоксид, диметилсульфон и аллицин (см. Рисунок).
Сульфимиды (также называемые сульфилиминами) представляют собой серно-азотные соединения структуры R 2 S = NR ′, азотный аналог сульфоксидов. Отчасти они интересны своими фармакологическими свойствами. Когда к сере присоединены две разные группы R, сульфимиды хиральны. Сульфимиды образуют стабильные α-карбанионы.
Сульфоксимиды (также называемые сульфоксиминами) представляют собой четырехкоординатные серно-азотные соединения, изоэлектронные с сульфонами, в которых один атом кислорода сульфона заменен замещенным атомом азота, например, R 2 S (O) = NR ′. Когда к сере присоединены две разные группы R, сульфоксимиды хиральны. Большой интерес к этому классу соединений вызван открытием того факта, что метионинсульфоксимид (метионинсульфоксимин) является ингибитором глутаминсинтетазы.
. Сульфондиимины (также называемые сульфодииминами, сульфодиимидами или сульфондиимидами) представляют собой четырехкоординатные серно-азотные соединения, изоэлектронный с сульфонами, в котором оба атома кислорода сульфона заменены замещенным атомом азота, например, R 2 S (= NR ') 2. Они представляют интерес из-за их биологической активности и в качестве строительных блоков для синтеза гетероциклов.
S-нитрозотиолы, также известные как тионитриты, представляют собой соединения, содержащие нитрозогруппу, присоединенную к атом серы тиола, например R − S − N = О. В биохимии им уделяется значительное внимание, поскольку они служат донорами иона нитрозония NO и оксида азота NO, которые могут служить сигнальными молекулами в живых системах, особенно связанных с расширением сосудов.
Известен широкий спектр сероорганических соединений, которые содержат один или несколько атомов галогена («X» в следующих химических формулах), связанных с одним атомом серы, например: сульфенилгалогениды., RSX; сульфинилгалогениды, RS (O) X; сульфонилгалогениды, RSO 2 X; трихлориды алкил и арилсеры, RSCl 3 и трифториды, RSF 3 ; и пентафториды алкила и арилсеры, RSF 5. Менее известны тетрагалогениды диалкилсеры, в основном представленные тетрафторидами, например, R 2SF4.
Соединения с двойными связями между углеродом и серой относительно редки, но включают важные соединения сероуглерод, карбонилсульфид и тиофосген. Тиокетоны (RC (= S) R ') редко имеют алкильные заместители, но одним примером является тиобензофенон. Тиоальдегиды встречаются еще реже, что отражает отсутствие у них стерической защиты («тиоформальдегид » существует как циклический тример). Тиоамиды с формулой R 1 C (= S) N (R 2)R3являются более распространенными. Их обычно получают реакцией амидов с реагентом Лавессона. Изотиоцианаты с формулой R − N = C = S встречаются в природе. К овощным продуктам с характерным ароматом изотиоцианатов относятся васаби, хрен, горчица, редис, брюссельская капуста, кресс-салат, настурция и каперсы.
S-оксиды тиокарбонильных соединений известны как тиокарбонильные S-оксиды или сульфины, R 2 C = S = O, и тиокарбонил S, S-диоксиды или сульфены, R 2 C = SO 2. Эти соединения хорошо известны благодаря обширному химическому составу, например, см. syn- пропантиал-S-оксид и сульфен.
Тройные связи между серой и углеродом в сульфалкинах встречаются редко и могут быть обнаружены в моносульфиде углерода (CS) и были предложены для соединений F 3 CCSF 3 и F 5 SCSF 3. Соединение HCSOH также представлено как имеющее формальную тройную связь.
Тиокарбоновые кислоты (RC (O) SH) и дитиокарбоновые кислоты (RC (S) SH) хорошо подходят известен. Они структурно похожи на карбоновые кислоты, но более кислые. Тиоамиды аналогичны амидам.
Сульфоновые кислоты имеют функциональность R-S (= O) 2 -OH. Это сильные кислоты, обычно растворимые в органических растворителях. Сульфоновые кислоты, такие как трифторметансульфоновая кислота, являются часто используемым реагентом в органической химии. Сульфиновые кислоты имеют функциональные группы R-S (O) -OH, тогда как сульфеновые кислоты имеют функциональные группы R-S-OH. В серии сульфоновая-сульфиновая-сульфеновая кислота как сила кислоты, так и стабильность уменьшаются в этом порядке. Сульфонамиды, сульфинамиды и сульфенамиды, с формулами R-SO 2 NR '2, R-S (O) NR' 2 и R-SNR '2 соответственно, каждый имеет богатый химический состав. Например, сульфамидные препараты представляют собой сульфонамиды, полученные в результате ароматического сульфирования. Хиральные сульфинамиды используются в асимметричном синтезе, в то время как сульфенамиды широко используются в процессе вулканизации, чтобы способствовать сшиванию. Тиоцианаты, R-S-CN, относятся к сульфенилгалогенидам и сложным эфирам с точки зрения реакционной способности.
A ион сульфония представляет собой положительно заряженный ион, содержащий три органических заместителя, присоединенных к сере, с формулой [R 3 S]. Вместе со своим отрицательно заряженным аналогом, анионом, эти соединения называются солями сульфония. Ион оксосульфония представляет собой положительно заряженный ион, содержащий три органических заместителя и кислород, присоединенный к сере, с формулой [R 3 S = O]. Вместе со своим отрицательно заряженным аналогом, анионом, эти соединения называются солями оксосульфония. Родственные разновидности включают ионы алкоксисульфония и хлорсульфония, [R 2 SOR] и [R 2 SC1] соответственно.
Депротонирование солей сульфония и оксосульфония дает илиды структуры R 2 S-C-R '2 и R 2 S (O) -C-R '2. В то время как илиды сульфония, например, в реакции Джонсона-Кори-Чайковского, используемой для синтеза оксиранов, иногда рисуются с двойной связью C = S, например, R 2 S = CR '2, илидная связь углерод-сера сильно поляризована и лучше описывается как ионная. Илиды сульфония являются ключевыми промежуточными соединениями в синтетически полезной перегруппировке Стивенса. Тиокарбонилилиды (RR'C = S-C-RR ') могут образовываться путем раскрытия цикла тииранов, фотоциклизации арилвинилсульфидов, а также с помощью других процессов.
Сульфураны представляют собой относительно специализированные функциональные группы, которые представляют собой четырехвалентные, гипервалентные соединения серы с формулой SR 4 и аналогично персульфураны являются шестивалентными SR6. Полностью углеродные шестивалентные комплексы известны для более тяжелых представителей группы халькогенов, например, соединение гексаметилпертеллуран (Te (Me) 6) было обнаружено в 1990 году реакцией тетраметилтеллура с дифторид ксенона в TeF 2 (CH 3)4с последующей реакцией с диметилцинком. Аналог серы гексаметилперсульфуран (S (CH 3)6) предположительно быть стабильным, но еще не синтезирован.
Первый полностью углеродный персульфуран, фактически синтезированный в лаборатории, имеет два метил и два бифенил лиганда :

Его получают из соответствующего сульфурана 1 с дифторидом ксенона / трифторидом бора в ацетонитриле до сульфуранильного дикатиона 2 с последующей реакцией с метиллитием в тетрагидрофуране с образованием (стабильного) персульфурана 3 в качестве цис-изомера. X -дифракция луча показывает, что длина связи C-S находится в диапазоне между 189 и 193 пм (длиннее стандартной длины связи) с центральным атомом серы в искаженной октаэдрической молекулярной геометрии.
Компьютерное моделирование предполагает, что эти связи очень полярны с отрицательными зарядами, находящимися на углероде.
Не все сероорганические соединения являются загрязнителями с неприятным запахом. Пенициллин и цефалоспорин - это спасающие жизнь антибиотики, полученные из грибов. Глиотоксин представляет собой серосодержащий микотоксин, продуцируемый несколькими видами исследуемых грибов в качестве противовирусного агента. Такие соединения, как аллицин и аджоен, отвечают за запах чеснока, а лентионин вносит вклад в аромат грибов шиитаке. Летучие сероорганические соединения также придают тонкие вкусовые характеристики вину, орехам, сыру чеддер, шоколаду, кофе и ароматам тропических фруктов. Многие из этих натуральных продуктов также обладают важными лечебными свойствами, такими как предотвращение агрегации тромбоцитов или борьба с раком.
Большинство органических соединений серы в окружающей среде встречаются в природе, как следствие того факта, что сера необходима для жизни, и две аминокислоты (цистеин и метионин) содержат этот элемент.
Некоторые сероорганические соединения в окружающей среде образуются как второстепенные побочные продукты таких промышленных процессов, как производство пластмасс и шин.
Отдельные процессы создания запаха представляют собой сероорганические соединения, получаемые при коксовании угля, предназначенные для удаления сернистых соединений и других летучих примесей с целью получения «чистого углерода» (кокс ), который является в основном используется для производства стали.
Запахи возникают также при химической переработке угля или сырой нефти в химические вещества-прекурсоры (сырье).) для последующего промышленного использования (например, пластмассы или фармацевтическое производство) и повсеместных потребностей перегонки нефти для бензина, дизельного топлива и других видов топлива . масла производство.
Сероорганические соединения можно понимать как ароматические загрязнители, которые необходимо удалить из природного газа перед коммерческим использованием, из выхлопных труб и вентиляционных отверстий перед сбросом. В этом последнем контексте можно сказать, что сероорганические соединения являются причиной загрязняющих веществ в сернистых кислотных дождях или, что эквивалентно, считаются загрязняющими веществами в большинстве распространенных ископаемых видов топлива, особенно угля.
Наиболее распространенные Сероорганическое соединение, присутствующее во всех нефтяных фракциях, представляет собой тиофен (C4H4S), циклическую ароматическую жидкость. Кроме того, тяжелые фракции нефти содержат бензотиофен (C8H6S, тианафтен) и дибензотиофен. Большинство последних соединений твердые и пахнут нафталином. Многие метилированные, диметиловые, диэтилбензотиофеновые производные присутствуют в дизельном топливе и жидком топливе, что затрудняет очистку жидкого топлива.
Все эти гетероциклические сульфиды составляют 200–500 ppm природного топлива, сильно замещенные дибензотиофены остаются после HDS и составляют 10–20 ppm. Эти молекулы также содержатся в углях, и их необходимо удалить перед употреблением.
Восстановленный молибден вместе с никелем в настоящее время используется для удаления тиофенов из нефти (HDS) из-за его большого сродства к сере. Кроме того, вольфрам вместе с никелем и кобальтом используется для гидрообессеривания (HDS) на крупных нефтеперерабатывающих заводах. Предполагается, что механизм адсорбции тиофена на переходные металлы происходит через π-систему, в которой сероорганическое соединение располагается почти параллельно поверхности металла. Многие исследователи сосредотачивают свои усилия на оптимизации степени окисления переходных металлов для HDS, таких как Cu (I) и Ag (II), которые вместе с Pd (0) оказались более специфичными для π-связывания с тиофенами всех видов.
Люди и другие животные обладают чрезвычайно чувствительным обонянием по отношению к запаху низковалентных сероорганических соединений, таких как тиолы, сульфиды и дисульфиды. Летучие тиолы с неприятным запахом - это продукты распада белка, содержащиеся в гнилостных продуктах, поэтому точное определение этих соединений имеет решающее значение для предотвращения интоксикации. Низковалентные летучие соединения серы также обнаруживаются в местах с низким уровнем кислорода в воздухе, что создает риск удушья. Было обнаружено, что медь необходима для высокочувствительного обнаружения некоторых летучих тиолов и родственных сероорганических соединений обонятельными рецепторами у мышей. Пока неизвестно, нужна ли медь и людям для чувствительного обнаружения тиолов.
.