Ингибиторы тубулина - это химиотерапевтические препараты, которые напрямую на тубулин, которое отличается от химиотерапевтических препаратов, действующих на ДНК. Микротрубочки играют важную роль в эукариотических клетках. Альфа- и бета-тубулин, основные компоненты микротрубочек, вызывают значительный интерес из-за их функций и биофизических свойств и стали предметом интенсивных исследований. Добавление лигандов тубулина может влиять на стабильность и функцию микротрубочек, включая митоз, движение клеток и внутриклеточный органелльный транспорт. Связывающие тубулин молекулы вызвали значительный интерес после введения таксанов в клиническую онкологию и повсеместного использования алкалоидов барвинка. Эти соединения ингибируют митоз клетки, связываясь с белком тубулином в митотическом веретене и предотвращают полимеризацию или деполимеризацию в микротрубочки. Этот способ действия также характерен для другого природного агента, называемого колхицин.
Первым известным соединением, связывающимся с тубулином, был колхицин, он был выделен из осенних крокусов, Colchicum autumnale, но он не использовался для лечения рака. Первыми противораковыми препаратами, одобренными для клинического использования, были алкалоиды барвинка винбластин и винкристин в 1960-х годах. Они были выделены из экстрактов листьев растений Catharanthus roseus (Vinca rosea) в Университете Западного Онтарио в 1958 году. Первое лекарство принадлежит к группе таксанов и паклитаксела, обнаруженный в экстрактах коры тиса Taxus brevifolia в 1967 году Монро Уолл и Мансух Вани, но его активность по ингибированию тубулина не была известна до 1979 года. Они являются плохими активными агентами, которые ограничивают развитие таксанов более 20 лет, пока не открывают способ синтеза. В декабре 1992 г. паклитаксел был одобрен для использования в химиотерапии.
 Формирование микротрубочек
Формирование микротрубочек Микротрубочки важными компонентами цитоскелета эукариотических клеток и их роль в различных клеточных функциях, таких как внутриклеточная миграция и транспорт, поддержание формы клетки, полярность, передача сигналов и митоз. Они играют решающую роль в делении клеток, участвуя в перемещении и прикреплении хромосом на различных стадиях митоза. Следовательно, динамика микротрубочек является мишенью для раскрываемых противораковых препаратов.
Микротрубочки состоят из двух субъединиц глобулярного белка, α- и β-тубулина. Эти две субъединицы объединяются с образованием α, β- гетеродимера, который собирается в нитевидную трубчатую структуру. Гетеродимеры тубулина располагаются по принципу «голова к хвосту», при этом α-субъедица одного димера контактирует с β-субъединицей другого. Такое расположение приводит к образованию длинных белковых волокон, называемых протофиламентами. Эти протофиламенты образуют основу полой цилиндрической микротрубочки, диаметр которой составляет около 25 нанометров, длина варьируется от 200 нанометров до 25 микрометров. Около 12–13 протофиламента располагаются параллельно, образуя С-образный белковый лист, который затем скручивается, образуя трубчатую переносится, называемую микротрубочкой. Расположение гетеродимеров голова к хвосту придает полярность полученной микротрубочке, которая имеет α-субъединицу на одном конце и β-субъединицу на другом конце. Конец α-тубулина имеет отрицательный (-) заряд, тогда как конец β-тубулина имеет положительный (+) заряд. Микротрубочка растет из дискретных участков сборки в клетках, называемых Центрами организации микротрубочек (MTOC), которые представляют собой сеть белков, связанных с микротрубочками (MAP).
Две молекулы, богатые энергией гуанозинтрифосфат (GTP) также являются важными компонентами структуры микротрубочек. Одна молекула GTP прочно связана с α-тубулином и не подлежит обмену, тогда как другая молекула GTP связана с β-тубулином и может быть легко заменена на гуанозиндифосфат (GDP). Стабильность микротрубочек будет зависеть от того, занят ли β-конец GTP или GDP. Микротрубочка, имеющая молекулу GTP на β-конце, будет стабильной и продолжит рост, тогда как микротрубочка, имеющая молекулу GDP на β-конце, будет нестабильной и будет быстро деполимеризоваться.
Микротрубочки не статичны, но они очень динамические полимеры и демонстрируют два типа динамического поведения: «динамическая нестабильность »И« беговая дорожка '. Динамическая нестабильность - это процесс, при котором концы микротрубочек переключаются между периодами роста и сокращения. Эти два конца не равны, конец с кольцом α-тубулина (-) менее динамичен, в то время как более динамичный конец с кольцом β-тубулина (+) растет и укорачивается быстрее. Микротрубочка претерпевает длительные периоды медленного удлинения, короткие периоды быстрого укорачивания, а также паузу, в которой нет ни роста, ни укорочения. Динамическая нестабильность характеризуется четырьмя переменными: скорость роста микротрубочек; скорость укорачивания; Частота перехода к сокращению (называемая «катастрофой ») и частота перехода от сокращения к росту или паузе (называемая «спасением »). Другое динамическое поведение, называемое беговой дорожкой, - это чистый рост микротрубочки на одном конце и чистое сокращение на другом конце. Он включает в себя внутренний поток субъединиц тубулина от положительного конца к отрицательному. Оба динамических поведения важны, и конкретная микротрубочка может демонстрировать в первую очередь динамическую нестабильность, беговую дорожку или их сочетание.
 Игровая среда
Игровая среда Агенты, которые представляют как ингибиторы тубулина, также как ингибиторы клеточного деления. Микротрубочка существует в непрерывном динамическом состоянии роста и укорачивания за счет обратимой ассоциации и диссоциации гетеродимеров α / β-тубулина на обоих концах. Это динамическое поведение и, как следствие, контроль длины микротрубочек жизненно важны для правильного функционирования митотического веретена в митозе, то есть делении клеток.
Микротрубочка участвует в различных стадиях клеточного цикла. Во время первой стадии, или профазы, микротрубочки, необходимые для деления клеток, формируются и растут в вновь образованном хромосомам, образуя пучок микротрубо, называемый митотическим веретеном. Во время прометафазы и метафазы это веретено прикреплено к хромосомам в определенной точке, называемой кинетохорой, и претерпевает несколько периодов роста и восстановления при настройке с возвратом и вперед. колебания хромосом. В анафазе также микротрубочки, прикрепленные к хромосомам, тщательно регулируемый процесс укорочения и удлинения. Таким образом, присутствует лекарственное средство, которое может подавлять динамику микротрубочек, достаточно, чтобы блокировать клеточный цикл и приводить к гибели клеток в результате апоптоза.
Ингибиторы тубулина, таким образом, действовать, действующая в динамику микротрубочек, т. Е. рост (полимеризация ) и укорочение (деполимеризация). Один класс ингибиторов действует путем ингибирования полимеризации тубулина с образованием микротрубочек и называется ингибиторами полимеризации, такими как аналоги колхицина и алкалоиды барвинка. Они увеличивают массу полимера микротрубочек в клетках при высокой концентрации и увеличивают как агенты, дестабилизирующиеротрубочки. Другой класс ингибиторов действует путем ингибирования деполимеризации полимеризованного тубулина и увеличения массы полимера микротрубочек в клетках. Они как агенты, стабилизирующие микротрубочки, называются ингибиторами деполимеризации, аналогам паклитаксела. Эти класса три лекарств, по-видимому, дел по нескольким разному313>механизму
Сайт связывания ингибиторов тубу
Аналоги колхицина блокируют клетки, разрушая микротрубочки. Сообщалось, что β-субъединица тубулина участвует в связывании колхицина. Он связывается с растворимым тубулином с образованием комплекса колхицин-тубулин. Этот комплекс вместе с нормальными тубулинами затем подвергается полимеризации с образованием микротрубочек. Однако присутствие этого комплекса Т-С предотвращает дальнейшую полимеризацию микротрубочек. Этот комплекс вызывает конформационное изменение, которое запускает дальнейшее добавление димеров тубулина и тем предотвращает рост микротрубочек. Комплекс ТС замедляет добавление новых димеров, микротрубочка разрушается из-за структурного дисбаланса или нестабильности во время метафазы митоза.
Алкалоиды барвинка связываются с β-субъединицей тубулина. димеры в отдельной области, называемой доменом связывания барвинка. Они быстро связываются с тубулином, и это связывание является обратимым и не зависит от температуры (от 0 ° C до 37 ° C). В отличие от колхицина, алкалоиды барвинка напрямую связываются с микротрубочками. Они сначала не образуют систему с растворимым тубулином и сополимеризуются с микротрубочек, однако они способны вызывать конформационные изменения тубулина в связи с самоассоциацией тубулина. Алкалоиды барвинка связываются с тубулином с высоким сродством на концах микротрубочек, но с низким сродством к участкам тубулина, расположенным вдоль цилиндра микротрубочек. Связывание этих лекарств в области с высоким сродством приводит к сильному кинетическому подавлению тубулина даже при использовании лекарственного средства, в то время как их связывание с низким сродством при относительно высокой деполимеризует микротрубочки.
В отличие от колхицина и алкалоиды барвинка, паклитаксел усиливают полимеризацию микротрубочек, способя фазам зародышеобразования и фазы удлинения реакции полимеризации, и его критическую концентрацию субъединицы тубулина (т. е. растворимого тубулина в равновесном состоянии). Микротрубочки, полимеризованные в паклитаксела, максимально стабильны. Механизм связывания паклитаксела имитирует механизм связывания нуклеотида GTP наряду с некоторыми важными отличиями. GTP связывается на одном конце димера тубулина, поддерживая контактным димером вдоль каждого протофиламента, в то время как паклитаксел связывается с одной стороной β-тубулина, сохраняя контакт со следующим протофиламентом. GTP связывается с несобранными димерами тубулина, тогда как сайты связывания паклитаксела защищено только в собранном тубулине. гидролиз GTP позволяет разбирать и регулировать систему микротрубочек; однако активация тубулина паклитакселом приводит к постоянной стабилизации микротрубочек. Таким образом описано, что подавление динамики микротрубочек является основным ингибитором деления клеток и гибели опухолевых клеток в клетках, обработанных паклителаксом.
Связывающие тубулин молекулы вызвали большой интерес среди цитотоксических агентов благодаря их успеху в клинической онкологии. Они отличаются от других противоопухолевых препаратов механизмом действия, потому что нацелены на митотическое веретено, а не на ДНК. Лекарства, связывающие тубулин, классифицируют на основе их механизма действия и сайта связывания как:
a)Лиганды сайта паклитаксела, включая паклитаксел, эпотилон, доцетаксел, дискодермолид и т.д.
a) Сайт связывания колхицина, включает колхицин, комбрестатин, 2-метоксиэстрадиол, метоксибензолсульфонамиды (E7010) и т. Д.
б) Сайт связывания алкалоидов барвинка, включает винбластин, винкристин, винорелбин, винфлунин, доластатины, галихондрины, гемиастерлины, криптофизин 52 и т. д.

Таксол, связанный с тубулином.

Винбластин связан с тубулином.

Колхицин, связанный с тубулином.
| Классы ингибиторов тубулина | Домен связывания | Родственные лекарственные средства или аналоги | Терапевтическое применение | Стадия клинической разработки |
|---|---|---|---|---|
| Ингибиторы полимеризации | Домен барвинка | Винбластин | болезнь Ходжкина, рак семенных клеток | в клиническое использование; 22 исследования комбинации в стадии разработки |
| Винкристин | Лейкоз, лимфомы | В клинических условиях; 108 исследований комбинации в стадии разработки | ||
| Винорелбин | Солидные опухоли, лимфомы, рак легкого | В клинической практике; 29 фаза I –III клинические испытания в стадии разработки (одиночные и комбинированные) | ||
| Винфлунин | мочевой пузырь, немелкоклеточный рак легкого, рак груди | Фаза III | ||
| Солидные опухоли | Фаза III завершена | |||
| Галихондрины | - | Фаза I | ||
| Потенциальный нацеленный на сосуды агент | Фаза Я; фаза II завершена | |||
| - | Фаза I | |||
| Колхициновый домен | Колхицин | Не неопластические заболевания (подагра,) | Одобрено в 2009 г. FDA в рамках инициативы по запрещенным лекарственным средствам | |
| Комбретастатины | Потенциальный нацеленный на сосуды агент | Фаза I | ||
| 2-Метоксиэстрадиол | - | Фаза I | ||
| E7010 | Солидные опухоли | Фаза I, II | ||
| Ингибиторы деполимеризации | Таксановый сайт | Паклитаксел (Таксол) | Яичники, опухоли груди и легких, саркома Капоши ; испытания с множеством других опухолей | В клинической практике; 207 испытаний фазы I - III в США; TL00139 находится в фазе I испытаний |
| Доцетаксел (Таксотер) | Простата, опухоли головного мозга и легких | 8 исследований в США (фаза I - III) | ||
| Эпотилон | Резистентные к паклитакселу опухоли | Фазы I - III | ||
| Дискодермолид | - | Фаза I |
| Ингибиторы тубулина | |||
|---|---|---|---|
| Домен барвинка |  | 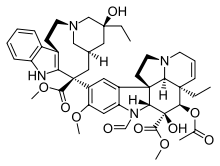 | 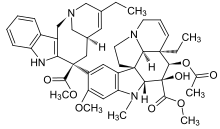 |
| Винбластин | Винкристин | Винорелбин | |
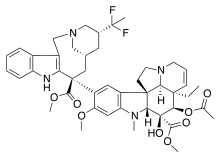 |  |  | |
| Винфлунин | Галихондрин B | ||
 |  |  | |
| Гемиастерлин A | |||
 | |||
| Колхициновый домен |  |  |  |
| Колхицин | Комбретастатин | ||
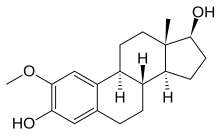 | |||
| 2-Метоксиэстради | |||
| ТАКСАНОВЫЙ САПТОЙТ | 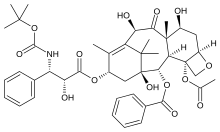 |  |  |
| Доакселцетел | Паклит 44Электронный Дискодермолид | ||
 SAR аналога колхицина
SAR аналога колхицина Колхицин является одним из старейших антимитотических препаратов. большая активность и меньшую токсичность. Это привело к открытию аналогов колхицина. Структура колхицина состоит из трех колец, триметоксибензольного кольца (кольцо A), кольца метокси тропона (кольцо C) и семичного кольца (кольцо B) с ацетамидной группой, расположенной в его позиции C-7. Триметоксифенильная группа колхицина не только помогает в стабилизации комплекса тубулин-колхицин, но также важна для антитубулиновой активности в сочетании с кольцом C. 3-метоксигруппа увеличивает связывающую способность, тогда как 1-метоксигруппа помогает в достижении правильного конформация молекулы. Стабильность тропонового кольца и положение метокси- и карбонильной группы имеют решающее значение для связывающей способности соединения. 10-метоксигруппу можно заменить галогеном, алкилом, алкоксигруппой или аминогруппой, не влияя на сродство связывания тубулина, в то время как объемные заместители снижают активность. Кольцо B при расширении показало пассивную активность, однако считается, что и его боковая цепь C-7 влияет на конформацию аналогов колхицина, а не на их способность связывать тубулин. Замена в C-5 приводила к потере активности, тогда как присоединение аннелированных гетероциклических кольцевых систем к кольцу B приводило к высоко сильнодействующему соединению.
 SAR аналогичного паклитаксела
SAR аналогичного паклитаксела паклитаксела добился большого успеха в качестве противоракового препарата, однако предпринимались постоянные усилия по повышению его эффективности и разработке более активных аналогов с большей биодоступностью и специфичность. Важность С-13-замененной боковой цепи фенилизосерина для биологической активности паклитаксела известна давно. Было протестировано несколько замен при замене C-3 '. Замена C-3 'фенильной группы на алкильные или алкинильные группы значительно усиливает активность, а группа CF3 в этом положении в сочетании с модификацией 10-Ac другими ацильными группами повышала активность в несколько раз. Другая модификация C-3 'с помощью циклопропановой и эпоксидной составляющих также была эффективной. Было обнаружено, что большинство аналогов без кольца намного активны, чем сам паклитаксел. Аналоги с амидной боковой цепью у C-13 менее активны, чем их сложноэфирные аналоги. Также деоксигенация в положении 1 показала пониженную активность. Приготовление 10-α-спироэпоксида и его 7-MOM эфира давало соединения, имеющее сравнимую цитотоксичность и активность сборки тубулина, как у паклитаксела. Замена на C-6-α-OH и C-6-β-OH давала аналоги, которые были эквивалентны паклитакселу в анализе сборки тубулина. Наконец, было обнаружено, что кольцо оксетана играет важную роль во время взаимодействия с тубулином.
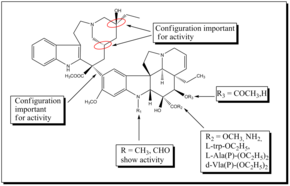 SAR аналогов винбластина
SAR аналогов винбластина Винбластин - это очень сильнодействующий препарат, который также имеет серьезные побочные эффекты, особенно в отношении неврологической системы. Поэтому были разработаны новые синтетические аналоги с использованием более эффективных и менее токсичных лекарств. стереохимические конфигурации на C-20 ', C-16' и C-14 'в части велбанамина имеют решающее значение, и инверсия приводит к потере активности. Карбоксиметильная группа C-16 'важна для активности, поскольку декарбоксилированный димер неактивен. Структурные вариации C-15'-C-20 'в кольце велбанамина хорошо переносятся. Верхняя скелетная модификация винбластина дала винорелбин, которая проявляет активность, сравнимую с активностью винбластина. Другой полученный аналог представлял собой дифторпроизводственное винорелбина, которое показало улучшенную противоопухолевую активность in vivo. Было обнаружено, что фторирование в положении C-19 'винорелбина увеличило активность in vivo. В большинстве случаев SAR использует виндолиновая часть бис-индол алкалоидов, поскольку модификация на C-16 и C-17 открывает хорошие возможности для разработки новых аналогов. Замена сложноэфирной группы амидной группой у C-16 привела к образованию виндезина. Аналогичным образом замена ацетильной группы у C-16 на L-trp-OC2H5, d-Ala (P) - (OC2H5) 2, L-Ala (P) - (OC2H5) 2 и I-Vla (P) - (OC2H5)) 2 приводят к появлению новых аналогов, обладающих антитубулиновой активностью. Также было обнаружено, что индольная метильная группа виндолина является полезным положением для потенциальной функционализации и разработки новых мощных производных винбластина. Новая серия полусинтетических C-16-спирооксазолидин-1,3-дионов, полученные из 17-деацетилвинбластина, показала хорошую анти-тубулиновую активность и более низкую цитотоксичность. Винглицинат, глицинат пролекарство, полученное из группы C-17-OH винбластина, проявляет противоопухолевую активность и токсичность, аналогичную таковой винбластина.
Ограничения в противораковой терапии возникают в основном по двум причинам; из-за организма пациента или из-за специфических генетических изменений в опухолевых клетках. Терапия у пациента ограничена плохим всасыванием лекарства, что может привести к низкой концентрации активного агента в крови и доставке небольшого количества к опухоли. Низкий уровень лекарственного средства в сыворотке также может быть вызван быстрым метаболизмом и выведением, связанными со сродством к кишечному и / или печеночному цитохрому P450. Другая причина - нестабильность и разложение лекарств в желудочно-кишечной среде. Серьезной проблемой также является различие между пациентами, что вызывает различную биодоступность после введения одинаковой дозы лекарства и разную толерантность к действию химиотерапевтических агентов. Вторая проблема особенно важна при лечении пожилых людей. Их организм слабее, и им необходимо применять более низкие дозы, часто ниже терапевтического уровня. Другой проблемой противораковых агентов является их ограниченная растворимость в воде, которая существенно снижает абсорбцию лекарства. Проблемы с доставкой препаратов в опухоль возникают также, когда активный агент имеет высокую молекулярную массу, которая ограничивает проникновение в ткань, или опухоль имеет большой объем, препятствующий проникновению.
Множественная лекарственная устойчивость является наиболее распространенной. важное ограничение в противоопухолевой терапии. Он может развиваться во многих химически различных соединениях. До сих пор известно несколько механизмов развития устойчивости. Наиболее распространено производство так называемых «откачивающих насосов». Насосы удаляют лекарства из опухолевых клеток, что приводит к низкой концентрации лекарства в мишени, ниже терапевтического уровня. Отток вызывается P-гликопротеином, который также называется переносчиком множества лекарственных препаратов. Этот белок является продуктом гена множественной лекарственной устойчивости MDR1 и членом семейства АТФ-зависимых транспортеров (АТФ-связывающая кассета ). Р-гликопротеин присутствует в каждом организме и служит для защиты организма от ксенобиотиков и участвует в перемещении питательных веществ и других биологически важных соединений внутри одной клетки или между клетками. Р-гликопротеин обнаруживает субстраты, когда они проникают в плазматическую мембрану и связывают их, что вызывает активацию одного из АТФ-связывающих доменов. Следующий эпизод - гидролиз АТФ, который приводит к изменению формы P-gp и открывает канал, по которому используется лекарство откачивается из клетки. Гидролиз второй молекулы АТФ приводит к закрытию канала, и цикл повторяется. Р-гликопротеин имеет сродство к гидрофобным лекарствам с положительным зарядом или электрически нейтральным и часто сверхэкспрессируется при многих раковых заболеваниях человека. Некоторые опухоли, например, рак легких, не экспрессируют этот переносчик чрезмерно. Было обнаружено, что другой транспортер MRP1 также работает как насос оттока, но в этом случае субстратами являются отрицательно заряженные природные соединения или лекарства, модифицированные глутатионом, конъюгацией, гликозилированием, сульфатированием и глюкуронилированием. Наркотики могут попасть в клетку несколькими способами. Основные пути: диффузия через плазматическую мембрану, через рецептор или переносчик или в процессе эндоцитоза. Рак может развить устойчивость за счет мутаций в своих клетках, которые приводят к изменениям поверхности клеток или нарушению эндоцитоза. Мутация может устранить или изменить переносчики или рецепторы, что позволяет лекарствам проникать в опухолевую клетку. Другой причиной лекарственной устойчивости является мутация β-тубулина, которая вызывает изменения в сайтах связывания, и данное лекарство не может связываться с его мишенью. Опухоли также изменяют изоформы экспрессии тубулина для этих опухолей, которые не являются мишенями для антимитотических препаратов, например сверхэкспрессия βIII-тубулина. Кроме того, опухолевые клетки экспрессируют другие виды белков и изменяют динамику микротрубочек, чтобы противодействовать действию противоопухолевых препаратов. Резистентность к лекарствам также может развиться из-за прерывания терапии.
Из-за многочисленные побочные эффекты и ограничения в применении, необходимы новые препараты с лучшими свойствами. Особенно желательны улучшения противоопухолевой активности, профиля токсичности, лекарственного препарата и фармакологии. В настоящее время предложено несколько подходов к разработке новых терапевтических агентов с лучшими свойствами.