 Жизненный цикл клетки
Жизненный цикл клетки  Лук (Allium ) клеток в разных фазах клеточного цикла. Рост в «организме » тщательно контролируется путем регулирования клеточного цикла.
Лук (Allium ) клеток в разных фазах клеточного цикла. Рост в «организме » тщательно контролируется путем регулирования клеточного цикла. 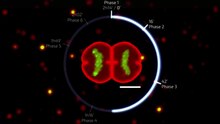 Play media Клеточный цикл Deinococcus radiodurans
Play media Клеточный цикл Deinococcus radiodurans клеточный цикл или цикл деления клетки - это серия событий, происходящих в ячейке, которые заставляют ее делиться на две дочерние клетки. Эти события включают дупликацию его ДНК (репликацию ДНК ) и некоторых его органелл, а затем разделение его цитоплазмы и других компонентов на две дочерние клетки в процессе, называемом делением клетки.
В клетках с ядрами (эукариот ), (т. Е. животных, растений, грибковых и простейших клеток) клеточный цикл делится на две основные стадии: интерфаза и митотическая (M) фаза (включая митоз и цитокинез ).. Во время интерфазы клетка растет, накапливая питательные вещества, необходимые для митоза, и реплицирует свою ДНК и некоторые из своих органелл. Во время митотической фазы реплицированные хромосомы, органеллы и цитоплазма разделяются на две новые дочерние клетки. Для обеспечения надлежащей репликации клеточных компонентов и деления существуют механизмы контроля, известные как контрольные точки клеточного цикла, после каждого из ключевых шагов цикла, которые определяют, может ли клетка перейти к следующей фазе.
В клетках без ядер (прокариот ) (т.е. бактерии и археи ) клеточный цикл равен разделены на периоды B, C и D. Период B длится от конца деления клетки до начала репликации ДНК. Репликация ДНК происходит в период C. Период D относится к стадии между окончанием репликации ДНК и расщеплением бактериальной клетки на две дочерние клетки.
Цикл деления клетки - это жизненно важный процесс, посредством которого одноклеточная оплодотворенная яйцо развивается в зрелый организм, а также процесс, посредством которого волосы, кожа, клетки крови и некоторые внутренние органы обновлены. После деления клетки каждая из дочерних клеток начинает интерфазу нового цикла. Хотя различные стадии интерфазы обычно морфологически не различимы, каждая фаза клеточного цикла имеет отдельный набор специализированных биохимических процессов, которые подготавливают клетку к инициации клеточного деления.
Цикл эукариотических клеток состоит из из четырех различных фаз: G1фаза, S фаза (синтез), G2фаза (коллективная известна как интерфаза ) и фаза М (митоз и цитокинез). М-фаза сама по себе состоит из двух тесно связанных процессов: митоза, в котором ядро клетки делится, и цитокинез, в котором цитоплазма клетки делится с образованием двух дочерних клеток. Активация каждой фазы зависит от правильного развития и завершения предыдущей. Говорят, что клетки, которые временно или обратимо прекратили деление, вошли в состояние покоя, называемое G0фазой.
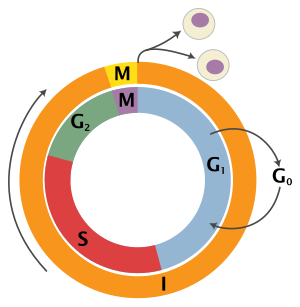 Схема клеточного цикла. Наружное кольцо: I = межфазный, M = митоз ; внутреннее кольцо: M = Митоз, G 1= Разрыв 1, G 2= Разрыв 2, S = Синтез ; не в кольце: G 0= Разрыв 0 / состояние покоя
Схема клеточного цикла. Наружное кольцо: I = межфазный, M = митоз ; внутреннее кольцо: M = Митоз, G 1= Разрыв 1, G 2= Разрыв 2, S = Синтез ; не в кольце: G 0= Разрыв 0 / состояние покоя | Состояние | Фаза | Аббревиатура | Описание |
|---|---|---|---|
| Отдых | Разрыв 0 | G0 | A фаза, когда клетка вышла из цикла и перестала делиться. |
| Interphase | Gap 1 | G1 | Клетки увеличиваются в размере в Gap 1. Механизм контроля G1контрольной точки гарантирует, что все готово для синтеза ДНК. |
| Синтез | S | Репликация ДНК происходит во время этой фазы. | |
| Разрыв 2 | G2 | Во время разрыва между синтезом ДНК и митозом клетка продолжает расти. Контрольный механизм G2контрольной точки гарантирует, что все готово к переходу в фазу М (митоз) и делению. | |
| Деление клетки | Митоз | M | Рост клеток останавливается на этой стадии, и клеточная энергия сосредотачивается на упорядоченном делении на две дочерние клетки. Контрольная точка в середине митоза (Контрольная точка метафазы ) гарантирует, что клетка готова к завершению клеточного деления. |
После деления клетки каждая из дочерних клеток начинает интерфазу нового цикла. Хотя различные стадии интерфазы обычно морфологически не различимы, каждая фаза клеточного цикла имеет отдельный набор специализированных биохимических процессов, которые подготавливают клетку к инициации клеточного деления.
 Цикл растительных клеток
Цикл растительных клеток 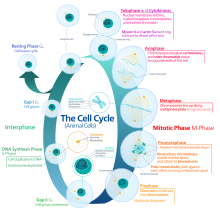 Цикл животных клеток
Цикл животных клеток G0- это фаза покоя, когда клетка вышла из цикла и перестала делиться. Клеточный цикл начинается с этой фазы. Непролиферативные (неделящиеся) клетки многоклеточных эукариот обычно переходят в состояние покоя G 0 из G 1 и могут оставаться в покое в течение длительных периодов времени, возможно бесконечно (как это часто бывает для нейронов ). Это очень характерно для полностью дифференцированных клеток. Некоторые клетки полупостоянно входят в фазу G 0 и считаются постмитотическими, например, некоторые клетки печени, почек и желудка. Многие клетки не попадают в G 0 и продолжают делиться на протяжении всей жизни организма, например эпителиальные клетки.
Слово «постмитотический» иногда используется для обозначения как покоящихся, так и стареющих клеток. Клеточное старение происходит в ответ на повреждение ДНК и внешний стресс и обычно представляет собой остановку в G 1. Клеточное старение может сделать потомство клетки нежизнеспособным; это часто является биохимической альтернативой самоуничтожению такой поврежденной клетки посредством апоптоза.
Интерфаза - это серия изменений, которые происходят во вновь образованной клетке и ее ядре до нее. снова становится способным к делению. Его также называют подготовительной фазой или перемежающейся фазой. Обычно интерфаза длится не менее 91% от общего времени, необходимого для клеточного цикла.
Интерфаза протекает в три стадии: G 1, S и G 2, за которыми следует цикл митоза и цитокинеза. Содержимое ядерной ДНК клетки дублируется во время фазы S.
Первая фаза внутри интерфазы, от конца предыдущей M-фазы до начала синтеза ДНК, называется G1 (G означает разрыв). Ее еще называют фазой роста. Во время этой фазы биосинтетическая активность клетки, которая значительно замедляется во время фазы M, возобновляется с высокой скоростью. Продолжительность G 1 сильно варьируется даже среди разных клеток одного и того же вида. На этой фазе клетка увеличивает запас белков, увеличивает количество органелл (таких как митохондрии, рибосомы) и увеличивается в размерах. В фазе G 1 ячейка имеет три варианта.
Точка принятия решения называется контрольной точкой (точкой ограничения ). Эта контрольная точка называется точкой ограничения или START и регулируется циклинами G 1 / S, которые вызывают переход от G 1 к S-фазе. Прохождение через контрольную точку G 1 фиксирует разделение ячейки.
Последующая S-фаза начинается, когда начинается синтез ДНК ; когда он завершен, все хромосомы реплицированы, то есть каждая хромосома состоит из двух сестринских хроматид. Таким образом, во время этой фазы количество ДНК в клетке удвоилось, хотя плоидность и количество хромосом не изменились. Скорости РНК транскрипции и синтеза белка очень низкие во время этой фазы. Исключением является продукция гистона, большая часть которой происходит во время фазы S.
G2фаза возникает после репликации ДНК и представляет собой период синтеза белка и быстрого рост клеток для подготовки клетки к митозу. Во время этой фазы микротрубочки начинают реорганизовываться, чтобы сформировать веретено (препрофаза). Перед переходом к митотической фазе клетки должны быть проверены в контрольной точке G 2 на предмет повреждений ДНК в хромосомах. Контрольная точка G 2 в основном регулируется опухолевым белком p53. Если ДНК повреждена, p53 либо восстанавливает ДНК, либо запускает апоптоз клетки. Если p53 дисфункциональный или мутировавший, клетки с поврежденной ДНК могут продолжать клеточный цикл, что приводит к развитию рака.
Относительно короткая M-фаза состоит из деления ядра (кариокинез ). Это относительно короткий период клеточного цикла. М-фаза сложна и строго регулируется. Последовательность событий разделена на фазы, соответствующие завершению одного набора действий и началу следующего. Эти фазы последовательно известны как:
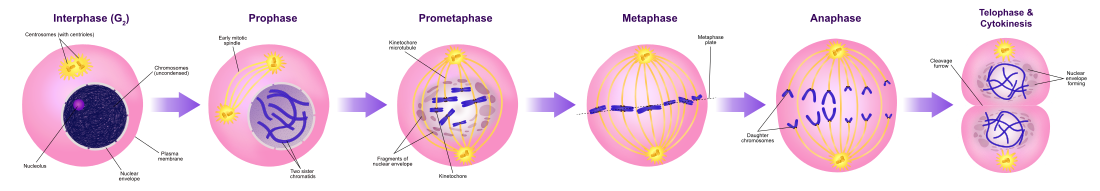
Митоз - это процесс, с помощью которого эукариотическая клетка разделяет хромосомы в его клеточном ядре на два идентичных набора в двух ядрах. В процессе митоза пары хромосом конденсируются и прикрепляются к микротрубочкам, которые тянут сестринские хроматиды к противоположным сторонам клетки.
Митоз возникает исключительно в эукариотических клетках, но у разных видов встречается по-разному. Например, клетки животных подвергаются «открытому» митозу, когда ядерная оболочка разрушается до разделения хромосом, тогда как грибы, такие как Aspergillus nidulans и Saccharomyces cerevisiae (дрожжи ) подвергаются «закрытому» митозу, при котором хромосомы делятся внутри интактного клеточного ядра.
За митозом сразу следует цитокинез, который разделяет ядра, цитоплазму, органеллы и клеточную мембрану на две клетки, содержащие примерно равные доли этих клеточных компонентов. Митоз и цитокинез вместе определяют деление материнской клетки на две дочерние клетки, генетически идентичные друг другу и своей родительской клетке. Это составляет примерно 10% клеточного цикла.
Поскольку цитокинез обычно происходит в сочетании с митозом, «митоз» часто используется взаимозаменяемо с «фазой М». Однако во многих клетках митоз и цитокинез протекают отдельно, образуя отдельные клетки с множеством ядер в процессе, называемом эндорепликацией. Это наиболее заметно среди грибов и слизистых плесневых грибов, но обнаруживается в различных группах. Даже у животных цитокинез и митоз могут происходить независимо, например, на определенных стадиях эмбрионального развития плодовой мушки . Ошибки в митозе могут привести к гибели клеток из-за апоптоза или вызвать мутации, которые могут привести к раку.
 Уровни трех основных циклинов типы осциллируют во время клеточного цикла (вверху), обеспечивая основу для колебаний в комплексах cyclin-Cdk, которые управляют событиями клеточного цикла (внизу). В общем, уровни Cdk постоянны и значительно превышают уровни циклина; таким образом, комплексы циклин-Cdk образуются параллельно с уровнями циклина. Ферментативная активность комплексов cyclin-Cdk также имеет тенденцию повышаться и падать параллельно с уровнями циклина, хотя в некоторых случаях белки-ингибиторы Cdk или фосфорилирование вводят задержку между образованием и активацией комплексов cyclin-Cdk. Образование активных комплексов G1 / S – Cdk фиксирует клетку к новому циклу деления в контрольной точке Start в конце G1. G1 / S-Cdks затем активирует комплексы S-Cdk, которые инициируют репликацию ДНК в начале S фазы. Активация M – Cdk происходит после завершения S фазы, приводя к прохождению через контрольную точку G2 / M и сборке митотического веретена. Активация APC затем запускает разделение сестринских хроматид при переходе от метафазы к анафазе. Активность APC также вызывает разрушение S и M циклинов и, таким образом, инактивацию Cdks, что способствует завершению митоза и цитокинеза. Активность APC сохраняется в G1 до тех пор, пока активность G1 / S – Cdk снова не возрастет и не передает клетку в следующий цикл. Эта схема служит только в качестве общего руководства и не применима ко всем типам клеток.
Уровни трех основных циклинов типы осциллируют во время клеточного цикла (вверху), обеспечивая основу для колебаний в комплексах cyclin-Cdk, которые управляют событиями клеточного цикла (внизу). В общем, уровни Cdk постоянны и значительно превышают уровни циклина; таким образом, комплексы циклин-Cdk образуются параллельно с уровнями циклина. Ферментативная активность комплексов cyclin-Cdk также имеет тенденцию повышаться и падать параллельно с уровнями циклина, хотя в некоторых случаях белки-ингибиторы Cdk или фосфорилирование вводят задержку между образованием и активацией комплексов cyclin-Cdk. Образование активных комплексов G1 / S – Cdk фиксирует клетку к новому циклу деления в контрольной точке Start в конце G1. G1 / S-Cdks затем активирует комплексы S-Cdk, которые инициируют репликацию ДНК в начале S фазы. Активация M – Cdk происходит после завершения S фазы, приводя к прохождению через контрольную точку G2 / M и сборке митотического веретена. Активация APC затем запускает разделение сестринских хроматид при переходе от метафазы к анафазе. Активность APC также вызывает разрушение S и M циклинов и, таким образом, инактивацию Cdks, что способствует завершению митоза и цитокинеза. Активность APC сохраняется в G1 до тех пор, пока активность G1 / S – Cdk снова не возрастет и не передает клетку в следующий цикл. Эта схема служит только в качестве общего руководства и не применима ко всем типам клеток. Регуляция клеточного цикла включает процессы, имеющие решающее значение для выживания клетки, включая обнаружение и восстановление генетических повреждений, а также предотвращение неконтролируемых деление клеток. Молекулярные события, которые контролируют клеточный цикл, упорядочены и направлены; то есть каждый процесс происходит последовательно, и невозможно «повернуть вспять» цикл.
 . Нобелевский лауреат. Пол Нерс . Нобелевский лауреат. Пол Нерс |  . Нобелевский лауреат. Тим Хант . Нобелевский лауреат. Тим Хант |
Два ключевых класса регуляторных молекул, циклины и циклинзависимые киназы (CDK), определяют продвижение клетки в клеточном цикле. Leland H. Hartwell, R. Тимоти Хант и Пол М. Нерс выиграли Нобелевскую премию по физиологии и медицине 2001 года за открытие этих центральных молекул. Многие из генов, кодирующих циклины и CDK, консервативны среди всех эукариот, но в целом более сложные организмы имеют более сложные системы контроля клеточного цикла, которые включают больше индивидуальных компонентов. Многие из соответствующих генов были впервые идентифицированы при изучении дрожжей, особенно Saccharomyces cerevisiae ; В генетической номенклатуре дрожжей многие из этих генов дублируются cdc (для «цикла деления клетки»), за которыми следует идентификационный номер, например cdc25 или cdc20.
Циклины образуют регуляторные субъединицы, а CDK - каталитические субъединицы активированного гетеродимера ; циклины не обладают каталитической активностью, а CDK неактивны в отсутствие циклина-партнера. При активации связанным циклином CDK выполняют обычную биохимическую реакцию, называемую фосфорилирование, которая активирует или инактивирует целевые белки для организации скоординированного входа в следующую фазу клеточного цикла. Различные комбинации циклин-CDK определяют следующие белки-мишени. CDK конститутивно экспрессируются в клетках, тогда как циклины синтезируются на определенных стадиях клеточного цикла в ответ на различные молекулярные сигналы.
При получении промитотического внеклеточный сигнал, комплексы G 1циклин-CDK становятся активными для подготовки клетки к S-фазе, способствуя экспрессии факторов транскрипции, которые, в свою очередь, способствуют экспрессии S-циклинов и ферментов, необходимых для Репликация ДНК. Комплексы G 1 циклин-CDK также способствуют деградации молекул, которые действуют как ингибиторы S-фазы, направляя их на убиквитинирование. После того как белок убиквитинирован, он подвергается протеолитической деградации протеасомой. Однако результаты недавнего исследования динамики транскрипции E2F на уровне отдельных клеток показывают, что роль активности G1 циклин-CDK, в частности циклина D-CDK4 / 6, заключается в настройке времени, а не в обязательстве входа в клеточный цикл..
Активные комплексы S-циклин-CDK фосфорилируют белки, которые составляют пререпликационные комплексы, собранные во время фазы G 1 на ДНК ориджинах репликации. Фосфорилирование служит двум целям: для активации каждого уже собранного пререпликационного комплекса и для предотвращения образования новых комплексов. Это гарантирует, что каждая часть генома клетки будет реплицирована один раз и только один раз. Причина предотвращения пробелов в репликации довольно ясна, потому что дочерние клетки, в которых отсутствуют все или часть важных генов, погибнут. Однако по причинам, связанным с эффектами числа копий гена, наличие дополнительных копий некоторых генов также вредно для дочерних клеток.
Митотические комплексы циклин-CDK, которые синтезируются, но инактивируются во время фаз S и G 2, способствуют инициированию митоза, стимулируя последующие белки, участвующие в конденсации хромосом и митотическое веретено сборка. Критическим комплексом, активируемым во время этого процесса, является убиквитинлигаза, известная как комплекс, стимулирующий анафазу (APC), который способствует деградации структурных белков, связанных с хромосомной кинетохорой. APC также нацелен на митотические циклины для деградации, гарантируя, что телофаза и цитокинез могут продолжаться.
Циклин D - это первый циклин, продуцируемый в клетках, которые попадают в клетку цикл в ответ на внеклеточные сигналы (например, факторы роста ). Уровни циклина D остаются низкими в покоящихся клетках, которые не размножаются. Кроме того, CDK4 / 6 и CDK2 также неактивны, поскольку CDK4 / 6 связаны членами семейства INK4 (например, p16), ограничивая активность киназы. Между тем, комплексы CDK2 ингибируются белками CIP / KIP, такими как p21 и p27. Когда клетке пора войти в клеточный цикл, который запускается митогенными стимулами, уровни циклина D повышаются. В ответ на этот триггер циклин D связывается с существующим CDK4 / 6, образуя активный комплекс циклин D-CDK4 / 6. Комплексы циклин D-CDK4 / 6, в свою очередь, монофосфорилируют белок чувствительности ретинобластомы (Rb ) к pRb. Нефосфорилированный Rb опухолевый супрессор индуцирует выход из клеточного цикла и поддерживает остановку G0 (старение).
В последние несколько десятилетий получила широкое распространение модель, согласно которой белки pRB инактивируются циклином D-Cdk4 / 6-опосредованное фосфорилирование. Rb имеет 14+ потенциальных сайтов фосфорилирования. Циклин D-Cdk 4/6 постепенно фосфорилирует Rb до гиперфосфорилированного состояния, что запускает диссоциацию комплексов pRB– E2F, тем самым вызывая экспрессию гена клеточного цикла G1 / S и переход в S-фазу.
Однако научные наблюдения из недавнего исследования показывают, что Rb присутствует в трех типах изоформ: (1) нефосфорилированный Rb в состоянии G0; (2) монофосфорилированный Rb, также называемый «гипофосфорилированным» или «частично» фосфорилированным Rb в раннем состоянии G1; и (3) неактивный гиперфосфорилированный Rb в позднем состоянии G1. В ранних клетках G1 монофосфорилированный Rb выходит в виде 14 различных изоформ, каждая из которых имеет различную аффинность связывания E2F. Было обнаружено, что Rb связан с сотнями различных белков, и идея о том, что разные монофосфорилированные изоформы Rb имеют разных белковых партнеров, была очень привлекательной. Недавнее сообщение подтвердило, что монофосфорилирование контролирует ассоциацию Rb с другими белками и генерирует различные функциональные формы Rb. Все различные монофосфорилированные изоформы Rb ингибируют программу транскрипции E2F и способны блокировать клетки в G1-фазе. Важно отметить, что разные монофосфорилированные формы RB имеют разные транскрипционные выходы, которые выходят за рамки регуляции E2F.
В целом связывание pRb с E2F ингибирует экспрессию гена-мишени E2F некоторых переходных генов G1 / S и S включая циклины E-типа. Частичное фосфорилирование RB дерепрессирует Rb-опосредованное подавление экспрессии гена-мишени E2F, начинает экспрессию циклина E. Молекулярный механизм, который вызывает переключение клетки на активацию циклина E, в настоящее время неизвестен, но поскольку уровни циклина E повышаются, образуется активный комплекс циклин E-CDK2, в результате чего Rb инактивируется гиперфосфорилированием. Гиперфосфорилированный Rb полностью диссоциирует от E2F, обеспечивая дальнейшую экспрессию широкого диапазона генов-мишеней E2F, необходимых для перехода клеток в S-фазу [1]. Недавно было идентифицировано, что циклин D-Cdk4 / 6 связывается с С-концевой альфа-спиральной областью Rb, которая отличается только от циклина D, а не с другими циклинами, циклином E, A и B. Это наблюдение, основанное на структурном анализе фосфорилирования Rb, подтверждает, что Rb фосфорилируется на другом уровне посредством множественных комплексов Cyclin-Cdk. Это также делает возможной текущую модель одновременной инактивации, подобной переключателю, всех монофосфорилированных изоформ Rb посредством одного типа механизма гиперфосфорилирования Rb. Кроме того, мутационный анализ специфической Rb C-концевой спирали циклина D-Cdk 4/6 показывает, что нарушение связывания циклина D-Cdk 4/6 с Rb предотвращает фосфорилирование Rb, задерживает клетки в G1 и поддерживает функции Rb в супрессоре опухолей.. Этот управляемый циклин-Cdk переходный механизм клеточного цикла управляет клеткой, зафиксированной в клеточном цикле, что делает возможной пролиферацию клеток. Рост раковых клеток часто сопровождается нарушением регуляции активности Cyclin D-Cdk 4/6.
Гиперфосфорилированный Rb диссоциирует от комплекса E2F / DP1 / Rb (который был связан с E2F чувствительными генами, эффективно «блокируя» их от транскрипции), активируя E2F. Активация E2F приводит к транскрипции различных генов, таких как циклин E, циклин A, ДНК-полимераза, тимидинкиназа и т. Д. Cyclin E полученный таким образом связывается с CDK2, образуя комплекс циклин E-CDK2, который переводит клетку из G 1 в S-фазу (G 1 / S, которая инициирует переход G 2 / M). Активация комплекса циклин B -cdk1 вызывает разрушение ядерной оболочки и инициацию профазы, а затем, его дезактивация заставляет клетку выйти из митоза. Количественное исследование динамики транскрипции E2F на уровне отдельной клетки с использованием сконструированных флуоресцентных репортерных клеток обеспечило количественную основу для понимания логики контроля входа в клеточный цикл, бросая вызов канонической модели из учебников. Гены, которые регулируют амплитуду накопления E2F, такие как Myc, определяют обязательность клеточного цикла и вступление в S-фазу. Активность G1 cyclin-CDK не является движущей силой входа в клеточный цикл. Вместо этого они в первую очередь настраивают время увеличения E2F, тем самым модулируя темп прогрессирования клеточного цикла.
 Обзор путей передачи сигнала, участвующих в апоптозе, также известное как «запрограммированная гибель клеток»
Обзор путей передачи сигнала, участвующих в апоптозе, также известное как «запрограммированная гибель клеток» Два семейства генов, семейство cip / kip (белок, взаимодействующий с CDK / белок, ингибирующий киназу) и семейство INK4a / ARF (ингибитор киназы 4 / альтернативная рамка считывания), предотвращают прогрессирование клеточного цикла. Поскольку эти гены играют важную роль в предотвращении образования опухоли, они известны как супрессоры опухоли.
Семейство cip / kip включает гены p21, стр. 27 и стр. 57. Они останавливают клеточный цикл в фазе G 1 путем связывания и инактивации комплексов циклин-CDK. p21 активируется p53 (который, в свою очередь, запускается повреждением ДНК, например, из-за радиации). p27 активируется трансформирующим фактором роста β (TGF β ), ингибитором роста.
Семейство INK4a / ARF включает p16, который связывается с CDK4 и останавливает клеточный цикл в фазе G 1, и p14, который предотвращает деградацию p53.
Синтетические ингибиторы Cdc25 также могут быть полезны для остановки клеточного цикла и, следовательно, могут быть полезны в качестве противоопухолевых и противораковых агентов.
В Часто многие раковые опухоли человека обладают гиперактивированной активностью Cdk 4/6. Учитывая наблюдения за функциями циклина D-Cdk 4/6, ингибирование Cdk 4/6 должно приводить к предотвращению пролиферации злокачественной опухоли. Следовательно, ученые попытались изобрести синтетический ингибитор Cdk4 / 6, поскольку Cdk4 / 6 был охарактеризован как терапевтическая мишень для противоопухолевой эффективности. Три ингибитора Cdk4 / 6 - палбоциклиб, рибоциклиб и абемациклиб - в настоящее время получили одобрение FDA для клинического использования для лечения запущенных стадий или метастазов, гормон-рецептор-положительный (HR-положительный, HR +), HER2-отрицательный (HER2-) рак молочной железы. Например, палбоциклиб является перорально активным ингибитором CDK4 / 6, который продемонстрировал улучшенные результаты при ER-положительном / HER2-отрицательном распространенном раке молочной железы. Основным побочным эффектом является нейтропения, которую можно контролировать путем снижения дозы.
Таргетная терапия Cdk4 / 6 будет лечить только те типы рака, при которых экспрессируется Rb. Раковые клетки с потерей Rb обладают первичной резистентностью к ингибиторам Cdk4 / 6.
Текущие данные свидетельствуют о том, что полуавтономная транскрипционная сеть действует согласованно с аппаратом CDK-циклин, чтобы регулировать клеточный цикл. Несколько исследований экспрессии генов в Saccharomyces cerevisiae выявили 800–1200 генов, которые изменяют экспрессию в течение клеточного цикла. Они транскрибируются на высоких уровнях в определенных точках клеточного цикла и остаются на более низких уровнях в течение остальной части цикла. Хотя набор идентифицированных генов различается в разных исследованиях из-за вычислительных методов и критериев, используемых для их идентификации, каждое исследование показывает, что большая часть дрожжевых генов регулируется во времени.
Многие периодически экспрессируемые гены управляются факторы транскрипции, которые также периодически экспрессируются. Один скрининг нокаутов одного гена выявил 48 факторов транскрипции (около 20% всех несущественных факторов транскрипции), которые показывают дефекты прогрессирования клеточного цикла. Полногеномные исследования с использованием высокопроизводительных технологий выявили факторы транскрипции, которые связываются с промоторами дрожжевых генов, и сопоставление этих результатов с временными паттернами экспрессии позволило идентифицировать факторы транскрипции, которые управляют фазовой экспрессией генов. Профили экспрессии этих факторов транскрипции управляются факторами транскрипции, пик которых наблюдается в предыдущей фазе, и вычислительные модели показали, что CDK-автономная сеть этих факторов транскрипции достаточна для создания устойчивых колебаний экспрессии генов).
Экспериментальные данные также предполагают, что экспрессия генов может колебаться с периодом, наблюдаемым при делящемся клетке дикого типа, независимо от аппарата CDK. Орландо и др. использовали микроматрицы для измерения экспрессии набора из 1271 гена, который они идентифицировали как периодические как в клетках дикого типа, так и в клетках, лишенных всех S-фаз и митотических циклинов (clb1,2,3,4,5,6). Из 1271 проанализированных генов 882 продолжали экспрессироваться в клетках с дефицитом циклина в то же время, что и в клетках дикого типа, несмотря на то, что клетки с дефицитом циклина задерживаются на границе между G1 и S фаза. Однако 833 из исследованных генов изменили поведение между клетками дикого типа и мутантными клетками, что указывает на то, что эти гены, вероятно, прямо или косвенно регулируются механизмом CDK-циклин. Некоторые гены, которые продолжали вовремя экспрессироваться в мутантных клетках, также экспрессировались на разных уровнях в мутантных клетках и клетках дикого типа. Эти находки предполагают, что хотя транскрипционная сеть может колебаться независимо от осциллятора CDK-cyclin, они связаны способом, который требует обоих, чтобы гарантировать правильное время событий клеточного цикла. Другая работа указывает на то, что фосфорилирование, посттрансляционная модификация факторов транскрипции клеточного цикла с помощью Cdk1, может изменять локализацию или активность факторов транскрипции, чтобы строго контролировать время появления генов-мишеней..
В то время как осцилляторная транскрипция играет ключевую роль в прогрессировании клеточного цикла дрожжей, механизм CDK-циклин работает независимо в раннем эмбриональном клеточном цикле. Перед переходом в среднюю бластулу зиготическая транскрипция не происходит, и все необходимые белки, такие как циклины B-типа, транслируются из материнской загруженной мРНК.
Анализ синхронизированных культур Saccharomyces cerevisiae в условиях, которые предотвращают инициацию репликации ДНК без задержки прогрессирования клеточного цикла, показал, что лицензирование ориджина снижает экспрессию генов с ориджинами вблизи их 3'-концов, показывая, что расположенные ниже ориджины могут регулировать экспрессию вышестоящих гены. Это подтверждает предыдущие прогнозы математического моделирования глобальной причинной координации между активностью репликации ДНК и экспрессией мРНК и показывает, что математическое моделирование данных микроматрицы ДНК может быть использовано для правильного прогнозирования ранее неизвестных биологических режимов регуляции.
Контрольные точки клеточного цикла используются клеткой для мониторинга и регулирования хода клеточного цикла. Контрольные точки предотвращают развитие клеточного цикла в определенных точках, позволяя проверить необходимые фазовые процессы и восстановить повреждение ДНК. Ячейка не может перейти к следующему этапу, пока не будут выполнены требования контрольной точки. Контрольные точки обычно состоят из сети регуляторных белков, которые контролируют и определяют продвижение клетки через различные стадии клеточного цикла.
Есть несколько контрольных точек, чтобы гарантировать, что поврежденная или неполная ДНК не передается дочерним клеткам. Существуют три основных контрольных точки: контрольная точка G 1 / S, контрольная точка G 2 / M и контрольная точка метафазы (митотическая). Переход
G1/ S является этапом ограничения скорости в клеточном цикле и также известен как точка ограничения. Здесь клетка проверяет, достаточно ли у нее сырья для полной репликации ДНК (нуклеотидные основания, ДНК-синтаза, хроматин и т. Д.). Нездоровая или недоедающая клетка застрянет на этой контрольной точке.
Контрольная точка G 2 / M - это точка, в которой клетка гарантирует, что у нее достаточно цитоплазмы и фосфолипидов для двух дочерних клеток. Но иногда, что более важно, он проверяет, подходящее ли время для репликации. Бывают ситуации, когда многие клетки должны реплицироваться одновременно (например, растущий эмбрион должен иметь симметричное распределение клеток, пока не достигнет перехода в середину бластулы). Это делается путем управления контрольной точкой G 2 / M.
Контрольная точка метафазы - это довольно незначительная контрольная точка, поскольку, когда клетка находится в метафазе, она совершает митоз. Однако это не значит, что это не важно. В этой контрольной точке клетка проверяет, сформировалось ли веретено и что все хромосомы выровнены по экватору веретена перед началом анафазы.
Хотя это три «основных» контрольных точки, не все клетки имеют пройти через каждую из этих контрольных точек в указанном порядке для воспроизведения. Многие виды рака вызваны мутациями, которые позволяют клеткам быстро проходить через различные контрольные точки или даже вообще пропускать их. Переход от S к M к S фазе почти последовательно. Поскольку эти клетки потеряли свои контрольные точки, любые мутации ДНК, которые могли произойти, игнорируются и передаются дочерним клеткам. Это одна из причин, по которой раковые клетки имеют тенденцию к экспоненциальному нарастанию мутаций. Помимо раковых клеток, многие полностью дифференцированные типы клеток больше не реплицируются, поэтому они покидают клеточный цикл и остаются в G 0 до своей смерти. Таким образом устраняется необходимость в контрольно-пропускных пунктах сотовой связи. Также была предложена альтернативная модель ответа клеточного цикла на повреждение ДНК, известная как контрольная точка после репликации..
Регулирование контрольной точки играет важную роль в развитии организма. При половом размножении, когда происходит оплодотворение яйцеклетки, когда сперма связывается с яйцеклеткой, она высвобождает сигнальные факторы, которые уведомляют яйцеклетку о том, что она оплодотворена. Среди прочего, это побуждает оплодотворенный ооцит возвращаться из своего ранее спящего состояния, G 0, обратно в клеточный цикл и к митотической репликации и делению.
p53 играет важную роль в запуске механизмов контроля как в контрольных точках G 1 / S, так и в G 2 / M. В дополнение к p53, регуляторы контрольных точек активно исследуются на предмет их роли в росте и распространении рака.
 Флуоресцентные белки визуализируют развитие клеточного цикла. Флуоресценция IFP2.0-hGem (1/110) показана зеленым и выделяет фазы S / G 2 / M. Флуоресценция smURFP -hCdtI (30/120) показана красным цветом и выделяет фазы G 0/G1.
Флуоресцентные белки визуализируют развитие клеточного цикла. Флуоресценция IFP2.0-hGem (1/110) показана зеленым и выделяет фазы S / G 2 / M. Флуоресценция smURFP -hCdtI (30/120) показана красным цветом и выделяет фазы G 0/G1. Новаторская работа Ацуши Мияваки и его сотрудников разработала флуоресцентный индикатор клеточного цикла на основе убиквитинирования (FUCCI ), что обеспечивает флуоресцентную визуализацию клеточного цикла. Первоначально зеленый флуоресцентный белок, mAG, был слит с hGem (1/110), а оранжевый флуоресцентный белок (mKO 2) был слит с hCdt1 ( 30/120). Обратите внимание, что эти слияния представляют собой фрагменты, которые содержат сигнал ядерной локализации и сайты убиквитинирования для деградации, но не являются функциональными белками. зеленый флуоресцентный белок образуется во время фазы S, G 2 или M и разлагается во время фазы G 0 или G 1., в то время как оранжевый флуоресцентный белок образуется во время фазы G 0 или G 1 и разрушается во время фазы S, G 2 или Фаза М. FUCCI в дальнем красном и ближнем инфракрасном диапазонах был разработан с использованием производного от цианобактерий флуоресцентного белка (smURFP ) и бактериофитохрома. флуоресцентный белок (фильм найден по этой ссылке ).
Нарушение регуляции компонентов клеточного цикла может привести к образованию опухоли. Упомянутое выше, когда некоторые гены, такие как ингибиторы клеточного цикла, RB, p53 и т.д. мутируют, они могут вызывать неконтролируемое размножение клетки, формируя опухоль. Хотя продолжительность клеточного цикла в опухолевых клетках равна или больше чем в нормальном клеточном цикле, доля клеток, которые находятся в активном клеточном делении (по сравнению с покоящимися клетками в фазе G 0) в опухолях намного выше, чем в нормальной ткани. Th У нас наблюдается чистое увеличение количества клеток, поскольку количество клеток, погибших в результате апоптоза или старения, остается прежним.
Клетки, которые активно подвергаются клеточному циклу, являются мишенями для лечения рака, поскольку ДНК относительно подвергается воздействию во время деления клеток и, следовательно, подвержена повреждению лекарствами или излучением. Этот факт используется при лечении рака; с помощью процесса, известного как удаление опухоли, значительная масса опухоли удаляется, что переводит значительное количество оставшихся опухолевых клеток из фазы G 0 в фазу G 1 (из-за повышенной доступности питательных веществ, кислорода, факторов роста и т. д.). Лучевая или химиотерапия после процедуры удаления массы убивает эти клетки, которые только что вошли в клеточный цикл.
Клетки млекопитающих с наиболее быстрым циклом цикла в культуре, клетки крипт в кишечном эпителии, имеют продолжительность цикла всего от 9 до 10 часов.. Стволовые клетки в коже покоящихся мышей могут иметь время цикла более 200 часов. Большая часть этой разницы обусловлена переменной длиной G 1, наиболее изменчивой фазы цикла. M и S не сильно различаются.
В целом клетки наиболее радиочувствительны в поздних фазах M и G 2 и наиболее устойчивы в поздних фазах S.
Для клеток с более длительным временем клеточного цикла и значительно длинной фазой G 1 имеется второй пик сопротивления в конце G 1.
. Характер устойчивости и чувствительности коррелирует с уровень сульфгидрильных соединений в клетке. Сульфгидрилы - это природные вещества, которые защищают клетки от радиационного повреждения и, как правило, имеют самый высокий уровень S и самый низкий уровень около митоза.
Гомологичная рекомбинация (HR) - это точный процесс восстановления двухцепочечных разрывов ДНК. HR почти отсутствует в фазе G1, наиболее активен в фазе S и снижается в G 2 / M. Негомологичное соединение концов, менее точный и более мутагенный процесс восстановления двухцепочечных разрывов, активен на протяжении всего клеточного цикла.
| Викискладе есть материалы, относящиеся к клеточному циклу. |