 Воспроизвести медиа Как использовать микроматрицу для генотипирования. На видео показан процесс извлечения генотипов из образца слюны с помощью микрочипов. Генотипирование - это основная область применения ДНК-микрочипов, но с некоторыми модификациями они также поместили других, как измерение экспрессии генов и эпигенет маркеров.
Воспроизвести медиа Как использовать микроматрицу для генотипирования. На видео показан процесс извлечения генотипов из образца слюны с помощью микрочипов. Генотипирование - это основная область применения ДНК-микрочипов, но с некоторыми модификациями они также поместили других, как измерение экспрессии генов и эпигенет маркеров. A ДНК-микрочип (также широко известный как ДНК чип или биочип ) представляет собой совокупность микроскопических пятен ДНК, прикрепленных к твердой поверхности. Ученые используют микроматрицы ДНК для измерения уровней экспрессии большого количества генов одновременно или для генотипа нескольких генома. Каждое пятно ДНК содержит пикомоль (10 моль ) настроенную как ДНК (или репортеры, или олигонуклеотиды ). Это может быть короткий участок гена или другого элемента ДНК, который используется для гибридизации кДНК или образца кРНК (также называемой антисмысловой РНК) (называется целью) в условиях высокой жесткости. Гибридизацию зонд-мишень обычно выявляют и количественно определяют путем обнаружения флуорофор -, серебром- или хемилюминесцентно-меченых мишеней для определения относительного количества последовательностей нуклеиновых кислот в мишени. Исходные массивы нуклеиновых кислот представляли собой макромассивы размером примерно 9 см × 12 см, и первый компьютерный анализ на основе изображений был опубликован в 1981 году. Он был изобретен Патриком О. Брауном.
 Гибридизация мишени с зондом
Гибридизация мишени с зондом Основным принципом микрочипов является гибридизация между двумя цепями ДНК, свойство комплементарных последовательностей нуклеиновых кислот специфически спариваться друг с другом путем образования водородных связей между комплементарными парами нуклеотидных оснований. Большое количество комплементарных пар оснований в нуклеотидной структуре означает более прочную нековалентную связь между двумя цепями. После смывания неспецифических связывающих последовательностей только сильно спаренные цепи останутся гибридизированными. Флуоресцентно меченые-мишени, которые связываются с последовательностью зонда, генерируют сигнал, который зависит от условий гибридизации (таких как температура) и отмывки после гибридизации. Общая мощность сигнала от пятна (объекта) зависит от количества целевого образца, связывающегося с зондами, присутствующими в этом месте. Микромассивы используют относительное количественное определение, при котором интенсивность признака сравнивается с интенсивностью же признака при различных условиях, а идентичность признака определяется по ее положению.
 Два чипа Affymetrix. Соответствие показано в нижнем левом плане для сравнения размеров.
Два чипа Affymetrix. Соответствие показано в нижнем левом плане для сравнения размеров. Существует много типов массивов, которые на поверхности или кодированных шариков:
ДНК-микрочипы одной из систем обнаружения генов ДНК (как в сравнительной гибридизации ) или обнаружения РНК (чаще всего как кДНК после обратной транскрипции ), которые могут транслироваться или не транслироваться в белки. Процесс экспресс измерения генов с помощью кДНК называется анализом экспрессии или профилированием экспрессии.
Приложения включают:
| Приложение или технология | Краткое содержание |
|---|---|
| Профилирование экспрессии генов | В эксперименте по профилированию экспрессии мРНК или гена одновременно отслеживаются уровни экспрессии тысяч генов для изучения эффектов определенных видов лечения, заболеваний, и стадии экспресс развития генов. Например, профилирование экспрессии генов на основе микроматрицы указывает на положение генов, экспрессия которого определяется в ответ на патогены или другие организмы, путем сравнения экспрессии генов в инфицированных клетках или тканях с таковыми в неинфицированных клетках или тканях. |
| Сравнительный анализ. генома гибридизация | Оценка содержания генома в различных клетках или близкородственных организмах, как описом Патриком Брауном, Джонатаном Поллаком и его коллегами из Стэнфорд. |
| GeneID | Маленькие микроматрицы для проверки организма в организме в пище и кормах (например, GMO [1] ), микоплазм в культуре клеток или патогенов для обнаружения болезней, в основном сочетание ПЦР и технологии микрочипов. |
| Иммунопреципитация хроматина на чипе | Последовательности ДНК, связанные с конкретным белком, могут быть выделены путем иммунопреципитации белка (ChIP ), эти фрагменты могут быть гибридизированы с микрочипом (например,, мозаичный массив ), позволяющий определять занятость сайта связывания белка по всему геному. Примером белка для иммунопреципитата существуют модификации гистонов (H3K27me3, H3K4me2, H3K9me3 и т. Д.), белок группы Polycomb (PRC2: Suz12, PRC1: YY1) и белок группы триторакс (Ash1) для изучения эпигенетического ландшафта или РНК-полимераза II для изучения ландшафта транскрипции. |
| DamID | Аналогично по ChIP может изолировать области генома, связанные с представляющим интерес белком, и использовать их для зондирования микроматрицы для блокировки сайта связывания. В отличие от ChIP, DamID не требует антител, но использует метилирование аденина рядом с сайтами связывания белка для селективной амплификации этих областей, введенных путем экспрессии количеств интересующего белка, слитого бактериальной ДНК-аденинметилтрансферазой. |
| обнаружение SNP | Выявление однонуклеотидного полиморфизма среди аллелей внутри или между популяциями. Некоторые применения микрочипов используют определение SNP, включая генотипирование, судебно-медицинский анализ, измерение предрасположенности канию, идентификацию кандидатов в лекарства, оценку зародышевой линии мутации у людей или соматические мутации при раке, оценка потери гетерозиготности или анализ генетической связи. |
| Альтернативный сплайсинг обнаружение | В дизайне используемых зонды, специфичных для ожидаемых примеров сайтов сплайсинга предсказанных экзонов для гена. Он имеет индексную плотность или охват типа промежуточных листов генов (с 1–3 зондами генов) и массива геномных генов (с сотнями или зондами на ген). Он используется для анализа экспрессии альтернативных форм сплайсинга гена. Используются обнаруженные зонды, которые используются обнаруженные зонды для обнаружения каждого из известных экзонационных генов. |
| Слитые гены микроматрица | Микроматрица слитых генов может обнаруживать транскрипты слияния, например из образцов рака. В основе этого лежит принцип альтернативного сращивания микрочипов. Дизайн олигонуклеотидов позволяет комбинировать стратегические параметры химических транскриптов с помощью индивидуальных измерений. |
| Массив листов | Массивы листов генома состоят из перекрывающихся зондов, предназначенных для плотного представления интересующей области генома, иногда размером с всю хромосому человека. Цель состоит в том, чтобы эмпирические конструкции конструкции транскриптов или альтернативно сплайс форм, которые, возможно, ранее не были известны или предсказаны. |
| Двухцепочечные микроматрицы B-ДНК | Правильные двухцепочечные микроматрицы B-ДНК можно использовать для характеристик лекарственных и биологических препаратов, которые можно использовать для связывания новых данных иммобилизованных, интактных, двухцепочечных скрученных ДНК. Этот подход можно использовать для подавления экспрессии генов. Они также позволяют охарактеризовать их в различных условиях окружающей среды. |
| Двухцепочечные микрочипипы Z-ДНК | Левосторонние двухцепочечные микроматрицы Z-ДНК можно использовать для идентификации коротких последовательностей альтернативной структуры Z-ДНК, используя в более длинных участках правней B- Гены ДНК (например, усиление транскрипции, рекомбинация, редактирование РНК). Микроматрицы также позволяют охарактеризовать их устойчивость в различных условиях окружающей среды. |
| Микроматрицы многонитевой ДНК (микроматрицы триплексной ДНК и микроматрицы квадруплексной ДНК) | Многонитевые микроматрицы ДНК и РНК могут быть использованы для идентификации новых лекарственных средств, которые связаны с этими многонитевыми последовательностями кислотных последовательностей. Этот подход может быть использован для открытия новых лекарств и биологических препаратов, способных подавлять экспрессию генов. Эти микроматрицы также позволяют охарактеризовать их устойчивость в различных условиях окружающей среды. |
Микроматрицы могут изготавливаться способами, в зависимости от количества исследуемых зондов, требований к настройке и типа задаваемого научного вопроса. Массивы от поставщиков могут содержать от 10 датчиков до 5 миллионов или более микрометровых датчиков.
 Воспроизведение носителя Микроматрица ДНК, печатаемая роботом в Универсальный Делавэра
Воспроизведение носителя Микроматрица ДНК, печатаемая роботом в Универсальный Делавэра Могут быть изготовлены микроматрицы с использованием различных технологий, включая печать остроконечными булавками на предметных стеклах, фотолитографию с использованием готовых масок, фотолитографию с использованием динамических микрозеркальных устройств, струйную печать или электрохимию на решетки микроэлектродов.
В пятнистых микроматрицах зонды предоставить собой олигонуклеотиды, кДНК или небольшие фрагменты продуктов ПЦР, которые соответствуют мРНК. Зонды синтезируются перед нанесением на поверхность матрицы, а затем «наносятся» на стекло. В обычном подходе используется набор тонких булавок или игл, которые погружаются в лунки, ДНК-зонды, помещает каждый зонд в обозначенные места на поверхности. Результирующая «мишеней» зондов представляет профили нуклеиновых кислот приготовленных зондов и готова для приема дополнительных кДНК или «мишеней» кРНК, полученных из экспериментальных или клинических образцов. Этот метод используется учеными-исследователями по всему миру микрочипов с печатью «внутри компании» в их собственных лабораториях. Эти массивы можно легко настроить для каждого эксперимента, потому что исследователи могут выбирать зонды и места для печати на типах, синтезировать зонды в собственной лаборатории (или на объекте-сотрудничестве) и определять массивы. Могут создать свои собственные меченые образцы для гибридизации, гибридизировать образцы с массивом и, наконец, сканировать массивы с помощью своего собственного оборудования. Это обеспечивает относительно дешевую микроматрицу, которую можно настроить для каждого исследования, и позволяет избежать затрат на покупку более дорогих коммерческих наборов, которые представляют огромное количество генов, представляющих интерес для исследователя. Существуют публикации, указываемые, что микроматрицы с пятнами собственного производства обеспечивают такой уровень производительности по сравнению с коммерческими наборами олигонуклеотидов, возможно, из-за небольших размеров партии и эффективности печати с промышленными производителями матриц олигонуклеотидов.
В олигонуклеотидных микрочипах зонды стандартные, соответствующие частям используемые или предсказанные открытые рамок считывания. Хотя олигонуклеотидные зонды часто используются в «пятнистых» микрочипах, термин «олигонуклеотидная матрица» чаще всего относится к конкретной методике производства. Массивы олигонуклеотидов посредством осуществления коротких олигонуклеотидных последовательностей, предназначенных для представления гена или семейства вариантов сплайсинга генов, синтез этой непосредственно на поверхности, вместо внесения интактных последовательностей. Последовательности могут быть длиннее (60-мерные зонды, такие как конструкция Agilent ) или короче (25-членные зонды, произведенные Affymetrix ) в зависимости от желаемой цели; Более длинные зонды более специфичны для отдельных генов-мишеней, более короткие зонды могут быть обнаружены с большей плотностью по всему массиву и дешевле в производстве. Один метод, используя накопления массивов олигонуклеотидов, включает фотолитографический синтез (Affymetrix) на подложке из диоксида кремния, где свет и светочувствительные маскирующие агенты используются для «построения» по одному нуклеотиду за раз по всему массиву. Каждый применимый зондочно «демаскируется» перед погружением в раствор одного нуклеотида, затем происходит реакция маскирования, и следующий набор зондов демаскируется для подготовки к воздействию другого нуклеотида. После многих повторений каждый повторяется полностью построенными. Совсем алгоритм синтез массивов без маски от NimbleGen Systems объединила гибкость с большим количеством датчиков.
 Схема типичного эксперимента с двухцветным микрочипом
Схема типичного эксперимента с двухцветным микрочипом Двухцветные микрочипы или двухканальные микроматрицы обычно гибридизуют с кДНК, полученной из двух сравниваемых образцов (например, больная ткань по сравнению со здоровой тканью), и которые помечены двумя флуорофорами. Флуоресцентные красители, обычно используемые для мечения кДНК, включают Cy 3, который имеет длину волны излучения флуоресценции 570 нм (соответствует зеленой части светового вещества), и Cy 5 с длины волны флуоресцентного излучения 670 нм (красной части светового). Два образца кДНК, меченных Cy, смешивают и гибридизируют в одну микроматрицу, которую затем сканируют в сканере микроматриц для визуализации флуоресценции двух флуорофоров после возбуждения с помощью лазерного луча определенная длина волны. Относительные интенсивности каждого флуорофора затем можно использовать в анализе на основе идентификации генов с повышенной и пониженной регуляцией.
Олигонуклеотидные микроматрицы часто содержат контрольные зонды, предназначенные для гибридизации с всплесками РНК. Степень гибридизации между спайками и контрольными зондами используется для нормализации измерения гибридизации для целевых зондов. В двухцветном массиве используются относительные уровни экспрессии между разными точками в образце и образе. Это предпочтительный метод анализа данных для двухцветного анализа. цветовая система. Примеры поставщиков таких микроматриц включают Agilent с их платформой Dual-Mode, Eppendorf с их платформой DualChip для колориметрической маркировки Silverquant и TeleChem International с.
В одноканальных микрочипах или одноцветных микрочипах массивы обеспечивают данные об интенсивности для каждого зонда или зондов, указывающие на относительный уровень гибридизации с меченой мишенью. Однако они не указывают на истинные уровни изобилия гена, а скорее указывают относительное изобилие по сравнению с другими образцами или условиями при обработке том же эксперимента. Каждая молекула РНК сталкивается с протоколом и смещением, зависящим от партии, на этапах амплификации, вычислении и гибридизации в эксперименте, что делает сравнение генов для одного и того же микрочипа неинформативным. Сравнение двух условий для одного и того же гена требует двух отдельных гибридизаций с одним красителем. Несколько популярных одноканальных систем: Affymetrix «Gene Chip», Illumina «Bead Chip», одноканальные матрицы Agilent, матрицы Applied Microarrays «CodeLink» и Eppendorf «DualChip Silverquant». Одно из преимуществ системы с одним красителем заключается в том, что отклоняющийся образец не может повлиять на необработанные данные, полученные из других образцов, потому что каждый чип подвергается воздействию только одного образца (в отличие от двухцветной системы, в которой один низкий -качественная выборка) может быть просто повлиять на общую точность данных, даже если другая выборка была высокого качества). Еще одно преимущество в том, что легче сравнивать элементы из разных экспериментов.
Одноканальный микрочип может быть единственным выбором в некоторых ситуациях. Предположим, что необходимо сравнить 
| количество образцов | одноканальный микрочип | двухканальный микрочип | двухканальный микрочип (со ссылкой) |
|---|---|---|---|
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 1 |
| 3 | 3 | 3 | 2 |
| 4 | 4 | 6 | 3 |
 |  |  |  |
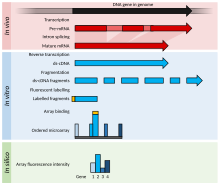 примеры уровней применения микроматриц. Внутри организмов гены транскрибируются и сплайсируются с образованием зрелых транскриптов мРНК (красный). МРНК извлекается из организма, и обратная транскриптаза используется для копирования мРНК в стабильную дц-кДНК (синий). В микроматрицах ds-кДНК фрагментирована и флуоресцентно помечена (оранжевый). Меченые фрагменты связываются с упорядоченным массивом комплементарных олигонуклеотидов, и измерения флуоресценции по всему массиву указывает на численность заранее определенного набора последовательностей. Эти инструкции обычно специально выбираются для сообщений об интересующих генах в геноме организма.
примеры уровней применения микроматриц. Внутри организмов гены транскрибируются и сплайсируются с образованием зрелых транскриптов мРНК (красный). МРНК извлекается из организма, и обратная транскриптаза используется для копирования мРНК в стабильную дц-кДНК (синий). В микроматрицах ds-кДНК фрагментирована и флуоресцентно помечена (оранжевый). Меченые фрагменты связываются с упорядоченным массивом комплементарных олигонуклеотидов, и измерения флуоресценции по всему массиву указывает на численность заранее определенного набора последовательностей. Эти инструкции обычно специально выбираются для сообщений об интересующих генах в геноме организма. Это пример эксперимент с ДНК-микрочипом, который включает детали для конкретного случая, чтобы лучше объяснить эксперименты с ДНК-микрочипом, в то время как перечисление модификаций для РНК или других альтернативных экспериментов.
 Значения экспрессии генов из экспериментов с микрочипами могут быть представлены в виде тепловых карт для визуализации результатов анализа данных.
Значения экспрессии генов из экспериментов с микрочипами могут быть представлены в виде тепловых карт для визуализации результатов анализа данных. Появление недорогих экспериментов с микрочипами создало несколько конкретных проблем биоинформатики: множественные уровни воспроизведения в экспериментальном дизайне (Экспериментальный план); количество платформ и независимых групп и формат данных (Стандартизация); статистическая обработка данных (Анализ данных); сопоставление каждого зонда с транскриптом мРНК, который он измеряет (Аннотация); огромный объем данных и возможность их совместного использования (Хранилище данных).
Из-за биологической сложности экспрессии генов соображений дизайна экспериментов, которые обсуждаются в статье профилирование экспрессии, имеют решающее значение как с точки зрения статистики, так и с биологической точки зрения. На основании данных следует сделать обоснованные выводы.
При разработке эксперимента с микрочипами следует учитывать три основных элемента. Во-первых, репликация биологических образцов для вывода результатов эксперимента. Во-вторых, технические повторы (по два образца РНК, полученные от каждой экспериментальной системы) обеспечивают точность и позволяют тестировать различия в группах лечения. Биологические повторения включают в себя независимые экстракции РНК, а технические повторения могут представлять две аликвоты одной и той же экстракции. В-третьих, пятна каждого клона кДНК или олигонуклеотида присутствуют в виде реплик (по крайней мере дубликатов) на предметном стекле микроматрицы, чтобы обеспечить техническую точность при каждой гибридизации. Очень важно выяснить информацию о подготовке и обращении с помощью образца, чтобы помочь идентифицировать независимые единицы в эксперименте и избежать завышенных оценок статистической значимости.
Данныерочипов затруднены для обмена из-за отсутствия стандартизации в изготовлении инструментария, протоколах анализа и методах анализа. Это представляет проблему взаимодействия в биоинформатике. Различные grass-roots проекты с открытым исходным кодом пытаются упростить обмен и анализ данных, произведенных с помощью непатентованных чипов:
Например, «Минимум информации Об эксперименте с микрочипами» (MIAME ) контрольный список помогает определить уровень детализации, который должен существовать, и принимает множество журналами, включающих результаты микроматрицы. Но MIAME не поддерживает требования MIAME, с 2007 года ни один формат не позволяет проверить полное семантическое соответствие. «Проект контроля качества MicroArray (MAQC)» осуществляется Управлением по санитарному надзору за пищевыми продуктами и медикаментами (FDA) США для разработки стандартов и показателей контроля качества, которые в конечном итоге позволяют использовать данные MicroArray при открытии лекарств, клинических исследованиях. практика и принятие регулирующих решений. Общество MGED разработало стандарты для представления результатов экспериментов по экспрессии генов и соответствующих аннотаций.
 Национальный центр токсикологических исследований ученый анализирует данные микрочипов
Национальный центр токсикологических исследований ученый анализирует данные микрочипов Наборы данных микрочипов обычно очень большие, и на точность анализа влияет ряд чисел. Статистические задачи включают учет эффектов фонового шума и соответствующую регулировку данных. Методы нормализации могут подходить к конкретным платформам, а в случае коммерческого анализа может быть частным. Алгоритмы, влияющие на статистический анализ, включают:
 статистика Хьюберта.
статистика Хьюберта.Данные микромассивов могут потребовать дальнейшей обработки, направленной на уменьшение размерности данных для облегчения понимания и более целенаправленного анализа. Другие методы позволяют анализировать данные, состоящие из небольшого числа биологических или технических повторов ; например, тест с локальной объединенной ошибкой (LPE) объединяет стандартных отклонений генов со схожими уровнями экспрессии в попытке компенсировать недостаточную репликацию.
Отношение между зондом и мРНК, которую предполагается обнаружить, нетривиально. Некоторые мРНК могут перекрестно гибридизовать зонды в массиве, которые должны обнаруживать другие мРНК. Кроме того, мРНК могут испытывать ошибку амплификации, которая зависит от молекулы. В-третьих, зонды, используемые для обнаружения мРНК определенного гена, могут быть на геномной информации EST, которая занимается с этим геном.
Данные микрочипа оказались более полезными по сравнению с другими подобными наборами. Огромный объем данных, специализированные форматы (такие как MIAME ) и усилия по курированию, связанные с набором данных, требуют предоставления базовых данных для хранения данных. Ряд решений для хранилищ данных с внешним исходным кодом, таких как InterMine и BioMart, был создан для конкретной цели интеграции различных наборов биологических данных, а также для поддержки анализа.
Достижения в области массового параллельного секвенирования приводят к развитию технологий RNA-Seq, которая позволяет использовать метод дробовика всего транскриптома для характеристики и количественной оценки экспрессии генов. В отличие от микрочипов, которые требуют наличия эталонного генома и транскриптома до того, как сам микромассив может быть разработан, RNA-Seq также может использоваться для новых модельных организмов, геном которых еще не секвенирован.
| На Викискладе есть медиафайлы, связанные с ДНК-микрочипами. |