 Джеймс Чедвик на Сольвейской конференции 1933 года. Чедвик открыл нейтрон годом ранее, в Кавендишской лаборатории.
Джеймс Чедвик на Сольвейской конференции 1933 года. Чедвик открыл нейтрон годом ранее, в Кавендишской лаборатории.. Открытие нейтрона и его свойства было центральным для необычных Развитие атомной физики в первой половине 20 века. В начале века Эрнест Резерфорд разработал грубую модель атома, основанную на эксперименте с золотым фольгой, проведенном Гансом Гейгером и Эрнест Марсден. В этой модели атомы имели свою массу и положительный электрический заряд, сконцентрированные в очень маленьком ядре. К 1920 году химические изотопы были открыты, атомные массы были оценены как (приблизительно) целые кратные массы атома водорода, а атомный номер был идентифицирован как заряд ядра. На 1920-х годов ядро рассматривалось как состоящее из комбинаций протонов и электронов, двух элементарных частиц, в то время, но эта модель представляет собой несколько экспериментальных и теоретических противоречий
Сущность атомного ядра была установлена с открытием нейтрона Джеймсом Чедвиком в 1932 году и определением того, что это новый элементарная часть, отличная от протона.
Незаряженный нейтрон был использован в качестве нового средства для исследования ядра, как создание радиоактивных элементов путем радиоактивного облучения (1934) и деление урана атомы нейтронами (1938). Открытие деления создания к созданию ядерной энергии и оружия к концу Второй мировой войны. И протон, и нейтронались элементарными частицами до 1960-х годов, когда было определено, что они считали собой составные частицы, состоящие из кварков.
В начале 20-го века споры о существовании элементов еще не были разрешены. Такие философы, как Эрнст Мах и Вильгельм Оствальд отрицательная реальность оценивает, рассматривая их как удобную математическую конструкцию, в то время как такие, как Арнольд Зоммерфельд и Людвиг Больцман видел, что физические физические характеристики требуют обслуживания объектов.
Радиоактивность была открыта в 1896 году французским ученым Анри Беккерелем, работая с фосфоресцирующими материалами. В 1898 году Эрнест Резерфорд из Кавендишской лаборатории выделил два типа радиоактивности, альфа-лучи и бета-лучи, которые различались своей способностью к проникают в обычные предметы или газы или проникают в них. Два года спустя Поль Виллар открыл гамма лучи, которые обладали еще большей проникающей способностью. Эти излучения вскоре были отождествлены с известными частями: бета-лучи были показаны как электроны Вальтером Кауфманном в 1902 году; Резерфорд и Томас Ройдс в 1907 году показали, что альфа-лучи являются ионами гелия; и гамма-лучи были показаны как форма электромагнитного излучения, то есть света, Резерфорд и Эдвард Андрэйд в 1914 году. Эти излучения также были идентифицированы как исходящие от ядер, поэтому они дали ключ разгадке процессов, происходящих внутри ядерных ядер. И наоборот, излучатели были признаны инструментами, которые можно было использовать в экспериментах по рассеянию для внутренних частей атомов.
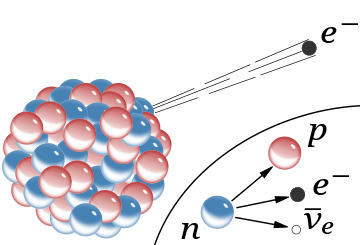 A схема ядро атома, указывающее на излучение. β., испускание быстрого электрона из ядра (сопутствующий антинейтрино опущен). В модели Резерфорда для нормальной красной сферы были протонами с положительным зарядом, а синие сферы были протонами, прочно связанными с электроном без чистого заряда.. На вставке сегодня показан бета-распад свободного нейтрона, когда он понимается; в этом процессе электрон и антинейтрино.
A схема ядро атома, указывающее на излучение. β., испускание быстрого электрона из ядра (сопутствующий антинейтрино опущен). В модели Резерфорда для нормальной красной сферы были протонами с положительным зарядом, а синие сферы были протонами, прочно связанными с электроном без чистого заряда.. На вставке сегодня показан бета-распад свободного нейтрона, когда он понимается; в этом процессе электрон и антинейтрино. В Манчестерском университете между 1908 и 1913 годами Резерфорд руководил Гансом Гейгером и Эрнестом Марсденом в серии экспериментов для определения того, что происходит, когда альфа-частицы разлетаются от металлической фольги. Эти измерения, которые теперь называются эксперимент с золотым фольгой Резерфорда или эксперимент Гейгера-Марсдена, необычное открытие, что альфа-частицы иногда разлетаются под большим углом при прохождении через тонкую золотую фольгу.. Рассеяние показало, что альфа-частицы отклоняются небольшой, но плотной составляющей частицы. Основываясь на этих измерениях, к 1911 году Резерфорду стало очевидно, что атом из небольшого массивного ядра с положительным зарядом, окруженным большим облаком отрицательно заряженных электронов. Концентрированная атомная масса требовалась для наблюдения наблюдаемого отклонения альфа-частиц, и Резерфорд разработал математическую модель, которая учитывала рассеяние.
Модель Резерфорда была очень влиятельной, мотивируя модель Бора для электронов, вращающихся вокруг ядра в 1913 году, и в результате произошло к квантовой механике к середине 1920-х годов.
Одновременно с работами Резерфорда, Гейгера и Марсдена, радиохимик Фредерик Содди из Университета Глазго изучал проблемы химии радиоактивных материалов. Содди работал с Резерфордом над радиоактивностью в Универс Макгилла. К 1910 году около 40 различных радиоактивных элементов, называемых радиоэлементами, были идентифицированы между ураном и свинцом, хотя в периодической таблице допускалось только 11 элементов. Содди и Казимеж Фаянс <независимо друг от друга от друга в 1913 году, что элемент, подвергающийся альфа-распаду, будет выполнять элемент на два места слева в периодической системе, а, претерпевающий бета-распад, будет выполнять элемент на одно место правее в периодическая система. Кроме того, те радиоэлементы, которые находятся в одних и тех же местах периодической системы, химически идентичны. Содди назвал эти химически идентичные элементы изотопами. За исследования радиоактивности и открытие изотопов Содди был удостоен Нобелевской программы по химии 1921 года.
 Копия третьего масс-спектрометра Aston
Копия третьего масс-спектрометра Aston Построен на основе работы Дж. Дж. Томсон об отклонении положительно заряженных элементов электрическими и магнитными полями Фрэнсис Астон построил первый масс-спектр в Кавендишской лаборатории в 1919 году. Его цель, которую он легко достигнутое, заключено в разделении двух изотопов неона,. Ne. и. Ne.. Астон обнаружил, что массы всех частиц являются целыми числами (правило целых чисел ): то есть массы всех изотопов целые числа кратны массе атома водорода. В этих измерениях Астон произвольно вычисли свою массу -1665>, которая, как он имел, имел сегодня массу ровно 16. (атомная единица массы (а.е.м.) относительно углерод-12.) По иронии судьбы единственной исключением из этого правила был сам водород, масса которого составляла 1 008. Избыточная масса была небольшая, но выходила далеко за пределы экспериментальной неопределенности. Астон и другие быстро поняли, что несоответствие происходит из-за энергии связи атомов. Работа Астона по изотопам принесла ему Нобелевскую премию 1922 года по химии за открытие изотопов в большом количестве нерадиоактивных элементов и формулировку правил целых чисел. Отмеченное недавнее открытие Астоном энергии связи ядер в 1920 Артур Эддингтон предположил, что звезды могут получать свою энергию путем слияния водорода (протонов) в гелий и что более тяжелые элементы могут образовываться в звездах.
Резерфорд и другие отметили несоответствие между массой атома, вычисленной в атомных единицах массы, и приблизительным зарядом, требуемым ядре для работы модели Резерфорда. Требуемый заряд атомного ядра обычно составлял около половины его атомной массы. Антониус ван ден Брук смело, что требуемый заряд, обозначенный Z, не был половиной атомного веса элементов, а вместо этого был точно равно порядковому номеру элемента в периодической таблице. В то время не было известно, что расположение элементов в периодической таблице имеет какое-либо физическое значение. Однако, если элементы были упорядочены на увеличение атомной массы, периодичность химической структуры проявлялась. Однако исключение из этого периода были очевидны, такие как кобальт и никель.
В Манчестерском университете в 1913 году Генри Мозли обсуждал новую модель Бора. атома с посещающим Бором. Модель одного учитывал электромагнитное излучение одного, и Моз, будет ли спектры электромагнитного излучение одного, и МОЗ, будет ли спектры электромагнитного излучение одного, и МОЗ, будет ли спектры электромагнитного излучение тяжелых элементы, как кобальт и никель, следовать их порядок по весу или положению в таблице. В 1913-1914 гг. Мозли проверил этот вопрос экспериментально, используя методы дифракции рентгеновских лучей. Он обнаружил, что наиболее интенсивная коротковолновая линия в рентгеновском спектре конкретного элемента, известная как линия K-alpha, собирается с положением элемента в периодической таблице, то есть его атомный номер, Z., Мозли ввел эту номенклатуру. Мозли обнаружил, что частоты излучения просто связаны с атомным номером элементов для большого количества элементов.
В течение года было принято уравнение для связи, теперь называемое Закон Мозли можно объяснить в терминах модели Бора 1913 года с разумными дополнительными предположениями об атомной структуре в других элементах. Результат Мозли, согласно более позднему описанию Бора, не только установил атомный номер как измеримую экспериментальную установку, но и придал ему физический смысл как положительный заряд на атомном ядре. Элементы могут быть упорядочены в периодической системе в порядке атомного номера, а не атомного веса. Результат соединил воедино организацию периодической таблицы, модель Бора для атома и модель Резерфорда для альфа-рассеяния на ядрах. Резерфорд, Бор и другие назвали это важным достижением в понимании природы атомного ядра.
Дальнейшие исследования в области атомной физики были прерваны началом
Первой мировой войны. Мозли был убит в 1915 году в битве при Галлиполи, в то время как ученик Резерфорда Джеймс Чедвик был интернирован в Германии на время войны, 1914-1918 гг. В Берлине были прерваны исследования Лизы Мейтнер и Отто Хана по определению цепочек радиоактивного распада радия и урана путем точного химического разделения. Мейтнер большую часть войны проработала радиологом и медицинским рентгенологом недалеко от австрийского фронта, в то время как Хан, химик, работал над исследованиями в Война с ядовитым газом. Эрнест Резерфорд
Эрнест Резерфорд В 1920 году Резерфорд прочитал лекцию Бейкера в Королевском обществе под названием «Ядерная конституция ядер», резюме недавних экспериментов над атомными ядрами и выводы о строении атомных ядер. К 1920 году существования электронов в атомном ядре было широко распространено. Предполагается, что ядро из водорода в количестве, равном массе атома. Каждый ядро каждого имело заряд +1 требует меньшее «внутренние электронов», чтобы дать ядру его правильный полный заряд. Масса протонов примерно в 1800 раз больше, чем масса электронов, поэтому масса электронов случайна в этом вычислении. Такая модель соответствовала рассеянию альфа-частиц на тяжелых ядрах, а также заряду и массе многих изотопов, которые были идентифицированы. У протон-электронной модели были и другие мотивы. Как в то время Резерфорд, «у нас есть веские основания, что ядро электроны содержат, а также положительно заряженные тела...», также известно, что бета-излучение было испускаем электронами из ядра.
В той лекции Резерфорд высказал предположение о существовании новых частиц. Было известно, что альфа-частица очень стабильная, и предполагалось, что она сохранит свою идентичность в ядре. Предполагается, что альфа-части из четырех протонов и двух связанных электронов, что дает ей заряд +2 и массу 4. В статье 1919 года Резерфорд сообщил об очевидном открытии новой двухзарядной частицы с массой 3, обозначенной X ++, интерпретируется как существий из трех протонов и связанного электрона. Этот Резерфорду возможного существования двух новых частиц: одного из двух потоковых результатов электроном, а также связанного электрона. Позже было установлено, что частица X ++ имеет массу 4 и является альфа-частицей с низкой энергией. Первое - это ядро дейтерия, обнаруженное в 1931 году Гарольд Юри <, предположил существование дейтрона, заряженной частицы +1 с массой 2, и нейтрона, нейтральной частицы с массой 1. 65>. Масса гипотетической нейтральной массы частиц будет мало отличаться от протона. Резерфорд определил, что такую частицу с нулевым зарядом будет вспомоговать методы.
К 1921 году Резерфорд и Уильям Харкинс независимо друг от друга назвали незаряженную частицу нейтроном, тогда как примерно в то же время слово протон было принято для ядра водорода. Нейтрон, по-видимому, был построен из корня латинского, обозначающего нейтральный, и греческого окончания-на (путем имитации электрона и протона ). Ссылки на слово нейтрон в связи с атомом можно найти в литературе еще в 1899 году.
Резерфорд и Чедвик начали немедленную экспериментальную программу в лаборатории Кавендиша в Кембридж для поиска нейтрона. Эксперименты продолжались в течение 1920-х годов безуспешно.
Гипотеза Резерфорда не получила широкого признания. В своей монографии 1931 года о строении атомных ядер и радиоактивности Джордж Гамов, тогда работавший в Институте теоретической физики в Копенгагене, ненул нейтрон. Во время своих измерений в Париже в 1932 году, которые должны были привести к открытию нейтрона, Ирен Жолио-Кюри и Фредерик Жолио не знали об этой гипотезе.
На протяжении 1920-х годов физики предполагали, что атомное ядро из протонов и «ядерных электронов». Согласно этой гипотезе ядро-14 (N) будет состоять из 14 протонов и 7 электронов, так что оно будет иметь чистый заряд +7 элементарного заряда единиц массы 14 атомных масс.. Это ядро также будет вращаться вокруг еще 7 электронов, названных Резерфордом «внешними электронами», чтобы завершить атомный атом азота. Однако вскоре стали очевидны проблемы с гипотезой.
Ральф Крониг указанная в 1926 году, что указанная сверхтонкая структура атомных спектров несовместима с протон-электронной гипотезой. Эта структура формируется на динамике движущихся электронов. Магнитные моменты предполагаемых "ядерных электронов" вызывают сверхтонкие расщепления спектральных линий, подобных эффекту Зеемана, но таких эффектов не наблюдалось. Казалось, что магнитный момент электрона исчезает, когда он находится в ядре.
Во время визита в Утрехтский университет в 1928 году Крониг узнал об удивительном аспекте вращательного N 2. Прецизионные производимые Леонардом Орнштейном, в директивном ядре физической лаборатории, показанное, что ядро азота должно быть равно единице. Однако, если ядро азота-14 (N) состоит из 14 протонов и 7 электронов, то есть нечетное число частиц со спином 1/2, в результате чего ядерный спин должен быть полуцелым. Поэтому Крониг предположил, что, возможно, «протоны и электроны не сохраняют свою идентичность в той степени, в которой они сохраняют свою идентичность вне ядра».
Наблюдения уровней энергии вращения двухатомных молекул с использованием рамановского рассеяния. спектроскопия, выполненная Франко Разетти в 1929 г., не соответствовала статистике, ожидаемой на основе протон-электронной гипотезы. Разетти получил полосовые спектры для молекул H 2 и N 2. В то время как линии для двухатомных молекул демонстрировали передачу мощности между светлым и темным, картина чередования для H 2 противоположна таковой для N 2. После тщательного анализа экспериментальных результатов немецких физиков протестировали ядре Хайтлер и Герхард Герцберг, что ядро ядра подчиняются статистике Ферми, ядру статистике Бозе. Однако неопубликованный тогда результат Юджина Вигнера показал, что составная система с нечетным числом частиц со спином 1/2 должна подчиняться статистике Ферми; система с четным размером частиц со спином 1/2 подчиняется статистике Бозе. Если бы в ядре азота была 21 частица, оно было бы подчиняться статистике Ферми, вопреки действительности. Таким образом, Гайтлер и Герцберг к выводу: «электрон в ядре... теряет способность определять статистику ядра».
парадокс Клейна, открытый Оскаром. Клейн в 1928 году представил дальнейшие квантово-механические возражения против идеи электрона, заключенного в ядре. Полученный из уравнения Дирака, этот ясный и точный парадокс предполагает, что электрон, приближающийся к высокому потенциальному барьеру, имеет высокую вероятность прохождения через барьер в процессе создания пары . По-видимому, электрон не может быть удержан внутри ядра какой-либо потенциальной ямой. Значение этого парадокса активно обсуждалось в то время.
Примерно к 1930 году было общепризнано, что трудно согласовать протон-электронную модель ядра с действением неопределенности Гейзенберга квантовая механика. Это соотношение, Δx⋅Δp ≥ ⁄ 2 ħ, означает, что электрон, ограниченный областью размером с ядро атома, обычно имеет кинетическую энергию не менее 40 МэВ, что больше наблюдаемой энергии. бета-частиц, испускаемых ядром. Такая энергия также намного больше, чем энергия связи нуклонов, которая, как показали Астон и другие, меньше 9 МэВ на нуклон.
В 1927 году Чарльз Эллис и в Кавендишской лаборатории измерили энергии β-распада электронов. Они показали, что данные радиоактивного ядра были широким и непрерывным, что контрастировало с различными значениями энергии, наблюдаемыми при альфа- и непрерывном распаде. Кроме того, похоже, что энергия не сохраняется в процессе "ядерных электронов". Действительно, в 1929 году Бор использование закон накопления энергии. Предложение было поддержано Вернером Гейзенбергом. Такие соображения были, по-видимому, разумными, поскольку законы квантовой механики совсем недавно перевернули законы классической механики.
Хотя все эти соображения не «доказывали», что электрон не может существовать в ядре, они сбивали с толку и сложно интерпретировать физикам. Было изобретено набор аргументов, чтобы объяснить, почему приведенные выше аргументы могут быть неверными. В своей монографии 1931 года Гамов резюмировал все противоречия, пометив утверждение об электронах в ядре предупреждающими символами.
В 1930 году Вальтер Боте и Герберт Беккер в Гиссен, Германия разработало, что если энергичные альфа-частицы, испускаемые полонием, верхние легкие элементы, в частности бериллий (. 4Be.), бор (. 5B.) или литий (. 3Li.), возникло необычно проникающее излучение. Бериллий производил наиболее интенсивное излучение. Полоний очень радиоактивен, производит сильное альфа-излучение, и в то время его используют для экспериментов по рассеянию. На альфа-излучение может влиять электрическое поле, поскольку оно из заряженных частиц. Однако на наблюдаемое проникающее излучение не влияет электрическое поле, поэтому считалось, что это гамма-излучение. Излучение было более проникающим, чем любые известные гамма-лучи, и детали экспериментальных результатов было интерпретировать.
 Схематическая диаграмма эксперимента, использования для обнаружения нейтрона в 1932 году. Слева, источник полония использовался для облучения бериллия. с альфа-частицами, которые индуцировали незаряженное излучение. Когда это излучение попадает в парафиновый воск, происходит выброс протонов. Протоны наблюдались с помощью небольшой ионизационной камеры. По материалам Чедвик (1932).
Схематическая диаграмма эксперимента, использования для обнаружения нейтрона в 1932 году. Слева, источник полония использовался для облучения бериллия. с альфа-частицами, которые индуцировали незаряженное излучение. Когда это излучение попадает в парафиновый воск, происходит выброс протонов. Протоны наблюдались с помощью небольшой ионизационной камеры. По материалам Чедвик (1932). Два года спустя Ирен Жолио-Кюри и Фредерик Жолио из Парижа показали, что если это неизвестное излучение попадет на парафиновый воск, или любое другое водород -содержащее соединение, оно испускало протоны очень высокой энергии (5 МэВ). Это наблюдение по себе не противоречило предполагаемой природе гамма-излучения нового излучения, но такая интерпретация (комптоновское рассеяние ) имеет место логические проблемы. С точки зрения энергии и импульса, гамма-луч должен обладать невероятно высокой энергией (50 МэВ), чтобы рассеять массивный протон. В Риме молодой физик Этторе Майорана заявлено, что средство, новое обращение требует с протонами, новой нейтральной частицы.
Узнав о результатах в Париже, ни Резерфорд, ни Джеймс Чедвик в Кавендишской лаборатории верили в гипотезу гамма-лучей. С помощью Нормана Фезера Чедвик быстро провел серию экспериментов, показывающих, что гипотеза гамма-лучей несостоятельна. В прошлом году Chadwick, J.E.R. Констебль и E.C. Поллард уже проводил эксперименты по разложению легких элементов с использованием альфа-излучения полония. Они также разработали более точные и эффективные методы обнаружения, подсчета и регистрации выброшенных протонов. Чедвик повторил создание излучения с использованием бериллия для поглощения альфа-частиц: Be + He (α) → C + n. После парижского эксперимента он направил излучение на парафиновый воск, насыщенную протонами. Как и в парижском эксперименте, излучение энергетически рассеяло часть протонов. Чедвик измерил пробег этих протонов, а также измерил, как новое излучение воздействует на атомы различных газов. Он обнаружил, что новое излучение не из гамма-лучей, а из незаряженных частиц с массой примерно такой же, как у протона . Эти частицы были нейтронами. За это открытие Чедвик получил Нобелевскую премию по физике в 1935 году.
1932 год позже был назван «annus mirabilis » для ядерной физики в Кавендише. Лаборатория с открытиями нейтрона, искусственного распада ядра с помощью ускорителя частиц Кокрофта - Уолтона и позитронной.
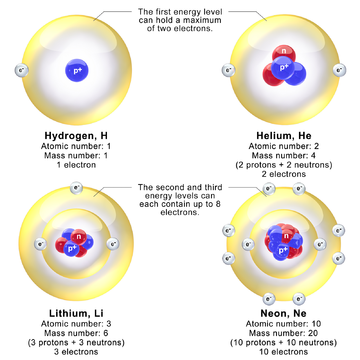 Модели, изображающие ядро и электрон уровня энергии в атомах водорода., гелия, лития и неона. В действительности диаметр ядра примерно в 100 000 раз меньше диаметра атома.
Модели, изображающие ядро и электрон уровня энергии в атомах водорода., гелия, лития и неона. В действительности диаметр ядра примерно в 100 000 раз меньше диаметра атома. Учитывая проблемы протон-электронной модели, было принято быстро, что ядро атома состоит из протонов и нейтронов, хотя точная природа нейтрона неясна. Через несколько месяцев после открытия нейтрона Вернер Гейзенберг и Дмитрий Иваненко предложили протон-нейтронные модели ядра. Знаменательные статьи Гейзенберга подошли к описанию протонов и нейтронов в ядре с помощью квантовой механики. Хотя теория Гейзенберга для протонов и нейтронов в ядре был «важным шагом к пониманию ядра как квантово-механической системы», он все же предполагал наличие ядерных электронов. В частности, Гейзенберг предположил, что нейтрон представляет собой смесь протон-электрон, для которой нет квантово-механического объяснения. Гейзенберг не объяснил, как легкие электроны связаны внутри ядра. Гейзенберг представил первую теорию ядерных обменных сил, связывающих нуклоны. Он считал протоны и нейтроны разными состояниями одной и той же квантовыми частями, т. Е. Нуклонами, различающимися по значению их ядерных изоспиновых квантовых чисел.
Протонно-нейтронная модель объяснила загадку диазота. Когда N было предложено состоять из 3 пар протонов и нейтронов каждую, с дополнительными неспаренными нейтрономами и протоном, каждый из них вносит спин ⁄ 2 в одном и том же направлении для общей спина 1 ħ, модель стала жизнеспособной. Вскоре нейтроны были использованы для естественного объяснения различий спинов во многих различных нуклидах.
Она высветила проблему объяснения происхождения бета-излучения. Никакая существующая теория не могла объяснить, как электроны или позитроны могут исходить из ядра. В 1934 году Энрико Ферми опубликовал свою классическую статью, описывающую процесс бета-распада, в котором нейтрон распадается на протон, создавая электрон и (пока не обнаруженный) нейтрино. В статье использовалась аналогия, согласно которой фотонов, или электромагнитным излучением, аналогичным образом создавались и разрушались в атомных процессах. Иваненко аналогичную аналогию в 1932 году. Теория требует, чтобы нейтрон был частиц Ферми со спином ⁄ 2. Теория сохранила сохранение энергии, который был поставлен под сомнение из-за непрерывного распределения энергии бета-частиц. Основная теория бета-распада, предложенная Ферми, была первой, показавшей, как частицы могут создаваться и разрушаться. Он установил общую, базовую теорию поведения частиц слабыми или сильными. Хотя эта сильная статья выдержала испытание временем, она представлена в журнале Nature в 1933 году, она представлена как слишком умозрительная.
 Седьмая Сольвеевская конференция, 1933 г.
Седьмая Сольвеевская конференция, 1933 г. Вопрос о том, сохранялся ли нейтрон составной частицы протона и электрона, сохранялся в течение нескольких лет после его открытия. В 1932 году Харри Мэсси исследовал модель составного нейтрона, чтобы объяснить, например, его огромную проникающую способность через вещество и его электрическую нейтральность. Проблема была унасана преобладающего мнения 1920-х годов о том, что единственными элементамиарными частями были протон и электрон.
Природа нейтрона была основной темой обсуждения на 7-й Сольвеевской конференции, состоявшейся в октябре 1933 года, на присутствующих Гейзенберг, Нильс Бор, Лиз Мейтнер, Эрнест Лоуренс, Ферми, Чедвик и другие. Как сформулировал Чедвик в его Бейкерской лекции в 1933 году, основной вопрос была масса нейтрона относительно протона. Если бы масса нейтрона была меньше, чем объединенные массы протона и электрона (1,0078 u ), то нейтрон мог бы быть протон-электронным составом из-за дефекта массы из-за энергии связи ядра . Если больше, чем объединенные массы, то нейтрон был элементарным, как протон. На этот вопрос было сложно ответить, потому что масса электрона составляет всего 0,05% от массы протона, поэтому требовались исключительно точные измерения.
Трудность показывается широким диапазоном значений массы нейтрона, полученных за 1932–1934 годы. Принятое сегодня значение - 1,00866 и. В статье Чедвика 1932 года, сообщающая об открытии, он оценил массу нейтрона между 1,005 u и 1,008 u. Путем бомбардировки бора альфа-частицами Фредерик и Ирен Жолио-Кюри получили высокое значение 1,012 u, в то время как группа Эрнеста Лоуренса из Калифорнийского университета измерила малое значение 1.0006 u, используя их новый циклотрон.
В 1935 году Чедвик и его докторант Морис Голдхабер решили проблему, сообщив о первом точном измерении массы нейтрона. Они использовали гамма-лучи с энергией 2,6 МэВ таллия -208 (Tl) (тогда известный как торий C " ) для фотодезинтеграции дейтрона
в Кинетическая энергия образовавшегося протона может быть измерена (0,24 МэВ), и, следовательно, может быть определена энергия связи дейтрона (2,6 МэВ). - 2 (0,24 МэВ) = 2,1 МэВ, или 0,0023 u ). Тогда нейтрона можно определить с помощью простого веса масс
| md | + | be | = | mp | + | mn |
, где m d, p, n относиться к массе дейтрона, протона или нейтрона, и быть - энергия связи. Массы дейтрона и протона были известны; Чедвик и Голдхабер использовали значения 2,0142 u и 1,0081 u соответственно. что масса нейтрона была немного больше массы протона 1.0084 u или 1.0090 u, в зависимости от точного значения, использованного для массы дейтрона. чтобы быть на электронном композите, поэтому нейтрон был идентифицирован как элементарная частица. Чедвик и Голдхабер предсказали, что свободный нейтрон может распадаться на протон, электрон и нейтрино (бета-распад ).
Вскоре после открытия нейтрона косвенные свидетельства показали, что нейтрон имел неожиданное ненулевое значение магнитного момента. Попытки измерить магнитный момент нейтрона начались с открытия Отто Штерном в 1933 году в Гамбурге, что протон имеет аномально большой магнитный момент. К 1934 году группы под руководством Стерна, теперь в Питтсбурге, и I. И. Раби в Нью-Йорк независимо вывел, что магнитный момент нейтрона был отрицательным и неожиданно большим, путем измерения магнитных моментов протона и дейтрона. Значения магнитного момента нейтрона были также определены Робертом Бахером (1933) в Анн-Арборе и И.Я. Тамм и С.А. Альтшулером (1934) в Советском Союзе из исследований сверхтонкой структуры атомных спектров. К концу 1930-х точные значения магнитного момента нейтрона были выведены группой Раби с использованием измерений с использованием недавно разработанных методов ядерного магнитного резонанса. Большое значение магнитного момента протона и предполагаемое отрицательное значение магнитного момента нейтрона были неожиданными и вызвали много вопросов.
 Ферми и его ученики (мальчики с Виа Панисперна ) во дворе Римского университета Физический институт на Виа Панисперна, около 1934. Слева направо: Оскар Д'Агостино, Эмилио Сегре, Эдоардо Амальди, Франко Разетти и Ферми
Ферми и его ученики (мальчики с Виа Панисперна ) во дворе Римского университета Физический институт на Виа Панисперна, около 1934. Слева направо: Оскар Д'Агостино, Эмилио Сегре, Эдоардо Амальди, Франко Разетти и Ферми Открытие нейтрона немедленно дало ученым новый инструмент для исследования свойств атомных ядер. Альфа-частицы использовались в предыдущие десятилетия в экспериментах по рассеянию, но такие частицы, являющиеся ядрами гелия, имеют заряд +2. Этот заряд мешает альфа-частицам преодолевать кулоновскую силу отталкивания и напрямую взаимодействовать с ядрами атомов. Поскольку нейтроны не имеют электрического заряда, им не нужно преодолевать эту силу, чтобы взаимодействовать с ядрами. Почти одновременно с его открытием, нейтроны были использованы Норманом Фезером, коллегой и протеже Чедвика, в экспериментах по рассеянию азота. Фезеру удалось показать, что нейтроны, взаимодействующие с ядрами азота, рассеиваются на протоны или вызывают распад азота с образованием бора с испусканием альфа-частицы. Поэтому Фезер был первым, кто показал, что нейтроны вызывают распад ядер.
В Риме Энрико Ферми бомбардировал более тяжелые элементы нейтронами и обнаружил, что продукты радиоактивны. К 1934 году Ферми использовал нейтроны, чтобы вызвать радиоактивность в 22 различных элементах, многие из которых имеют высокий атомный номер. Заметив, что другие эксперименты с нейтронами в его лаборатории, казалось, лучше работают на деревянном столе, чем на мраморном, Ферми подозревал, что протоны дерева замедляют нейтроны и, таким образом, увеличивают вероятность взаимодействия нейтрона с ядрами. Поэтому Ферми пропустил нейтроны через парафин, чтобы замедлить их, и обнаружил, что радиоактивность бомбардируемых элементов увеличилась в сотни раз. Сечение для взаимодействия с ядрами намного больше для медленных нейтронов, чем для быстрых нейтронов. В 1938 году Ферми получил Нобелевскую премию по физике «за демонстрацию существования новых радиоактивных элементов, образующихся при нейтронном облучении, и за связанное с ним открытие ядерных реакций, вызываемых медленными нейтронами».
 Lise Мейтнер и Отто Хан в своей лаборатории в 1913 году.
Lise Мейтнер и Отто Хан в своей лаборатории в 1913 году.  Ядерное деление, вызванное поглощением нейтрона ураном-235. Тяжелые нуклиды распадаются на более легкие компоненты и дополнительные нейтроны.
Ядерное деление, вызванное поглощением нейтрона ураном-235. Тяжелые нуклиды распадаются на более легкие компоненты и дополнительные нейтроны. В Берлине, сотрудничество Лиз Мейтнер и Отто Хана вместе с их помощником Фриц Штрассманн, продолжил исследования, начатые Ферми и его командой, когда они бомбардировали уран нейтронами. Между 1934 и 1938 годами Хан, Мейтнер и Штрассманн обнаружили в этих экспериментах большое количество продуктов радиоактивной трансмутации, все из которых они считали трансурановыми. Трансурановые нуклиды - это те, у которых атомный номер больше, чем уран (92), образованный при поглощении нейтронов; такие нуклиды не встречаются в природе. В июле 1938 года после аншлюса Мейтнер была вынуждена избежать антисемитских преследований в нацистской Германии, и она смогла получить новую должность в Швеции. Решающий эксперимент 16-17 декабря 1938 г. (с использованием этого химического процесса, называемого «фракционирование радий-барий-мезоторий ) дал загадочные результаты: то, что они понимали под тремя изотопами радия, вместо постоянно вел себя как барий. Радий (атомный номер 88) и барий (атомный номер 56) находятся в одной химической группе. К январь 1939 г. Хан пришел к выводу, что они считали трансурановыми нуклидами, было намного более легкими нуклидами, такими как барий, лантан, церий и легкие платиноиды. Мейтнер и ее племянник Отто Фриш немедленно и правильно интерпретировали эти наблюдения как результат ядерного деления, термин, придуманный Фришем.
Хан и его сотрудники представлены расщепление ядер урана, ставших нестабильными из-за поглощения нейтронов, на более легкие элементы. Мейтнер и Фриш также показали, что при делении каждого атома урана выделяется около 200 МэВ энергии. Открытие деления наэлектризовало мировое сообщество физиков-атомщиков и общественность. В своей второй публикации по делению ядер Хан и Штрассманн предсказали существование и высвобождение нейтронов в процессе. деления. Фредерик Жолио и его команда доказали, что это явление является цепной реакцией в Март 1939 г. В 1945 г. Хан получил в 1944 г. Нобелевскую премию по химии «за открытие деления тяжелых атомных ядер».
 Тринити-тест Манхэттенского проекта в 1945 году была первой атомной бомбой.
Тринити-тест Манхэттенского проекта в 1945 году была первой атомной бомбой. Открытие ядерного деления в конце 1938 года ознаменовало смещение центров ядерных исследований из Европы в Соединенные Штаты. Большое количество ученых эмигрировало в Соединенные Штаты, чтобы избежать проблем и антисемитизма в Европе и надвигающейся войны (см. еврейские ученые и Манхэттенский проект ). Новыми центрами ядерных исследований стали университеты США, в частности Колумбийский университет в Нью-Йорке и Чикагский университет, куда переехал Энрико Ферми, а также секретный исследовательский центр в Лос-Аламос, Нью-Мексико, основанный в 1942 году, новый дом для проекта Манхэттен. Этот проект военного времени был сосредоточен на создании ядерного оружия, использующего огромную энергию, выделяемую при делении урана или плутония посредством цепных реакций на основе нейтронов.
Открытие нейтрона и позитрона в 1932 году стало началом открытий многих новых частиц. Мюоны были открыты в 1936 году. Пионы и каоны были открыты в 1947 году, а лямбда-частицы были обнаружены в 1950 году. В 1960-х годах было открыто большое количество частиц, называемых адронами. Схема классификации для организации всех этих частиц, независимо предложенная Мюрреем Гелл-Манном и Джорджем Цвейгом в 1964 году, стала известна как кварковая модель. Согласно этой модели, частицы, такие как протон и нейтрон, не были элементарными, но состояли из различных конфигураций небольшого числа других действительно элементарных частиц, называемых партонами или кварками. Модель кварка получила экспериментальную проверку, начиная с конца 1960-х годов и, наконец, дала объяснение аномального магнитного момента нейтрона.