 цитохром фотосистема I ацетил-КоА карбоксилаза rubisco тРНК тРНК фотосистема II тРНК тРНК фотосистема II рибосомные. белки тРНК тРНК наддегидрогеназа рибосомные белки тРНК области ориджина репликации тРНК малая РНК рибосомный белок области ориджина репликации рибосомная РНК тРНК рибосомная РНК тРНК цитохромы фотосистема II рибосомные белки фотосистема I цитохромы фотосистема II атр-синтаза тРНК наддегидрогеназа тРНК рибосомальный белки фотосистема I тРНК фотосистема II РНК-полимераза рибосомный белок атр-синтаза тРНК рибосомный белок тРНК фотосистема II тРНК тРНК рибосомная РНК тРНК рибосомная РНК тРНК рибосомный белок фотосис тема I наддегидрогеназа тРНК рибосомный белок наддегидрогеназа тРНК тРНК рибосомные белки фактор инициации 1 рибосомные белки РНК-полимераза атр-зависимая протеаза рибосомные белки тРНК nicotiana tabacum редактировать · изображение ДНК хлоропласта Интерактивная карта генов ДНК хлоропласта из Nicotiana tabacum. Сегменты с метками на внутренней стороне находятся на цепи B ДНК, сегменты с метками снаружи находятся на цепи A. Насечки указывают на интроны.
цитохром фотосистема I ацетил-КоА карбоксилаза rubisco тРНК тРНК фотосистема II тРНК тРНК фотосистема II рибосомные. белки тРНК тРНК наддегидрогеназа рибосомные белки тРНК области ориджина репликации тРНК малая РНК рибосомный белок области ориджина репликации рибосомная РНК тРНК рибосомная РНК тРНК цитохромы фотосистема II рибосомные белки фотосистема I цитохромы фотосистема II атр-синтаза тРНК наддегидрогеназа тРНК рибосомальный белки фотосистема I тРНК фотосистема II РНК-полимераза рибосомный белок атр-синтаза тРНК рибосомный белок тРНК фотосистема II тРНК тРНК рибосомная РНК тРНК рибосомная РНК тРНК рибосомный белок фотосис тема I наддегидрогеназа тРНК рибосомный белок наддегидрогеназа тРНК тРНК рибосомные белки фактор инициации 1 рибосомные белки РНК-полимераза атр-зависимая протеаза рибосомные белки тРНК nicotiana tabacum редактировать · изображение ДНК хлоропласта Интерактивная карта генов ДНК хлоропласта из Nicotiana tabacum. Сегменты с метками на внутренней стороне находятся на цепи B ДНК, сегменты с метками снаружи находятся на цепи A. Насечки указывают на интроны.Хлоропласты, имеющие свою собственную ДНК, часто сокращенно хпДНК . Он также известен как пластом по отношению к геномам других пластид. Его существование было впервые доказано в 1962 году. Первые полные последовательности генома хлоропластов были опубликованы в 1986 году: Nicotiana tabacum (табак) Sugiura и его коллеги и Marchantia polymorpha (печеночник) Ozeki et al.. С тех пор сотни хлоропластных ДНК различных видов были секвенированы, но в основном это ДНК наземных растений и зеленых водорослей - глаукофиты, красные водоросли и другие группы водорослей крайне недопредставлены, что потенциально вносит некоторую предвзятость во взглядах на "типичную" структуру и содержание ДНК хлоропластов.
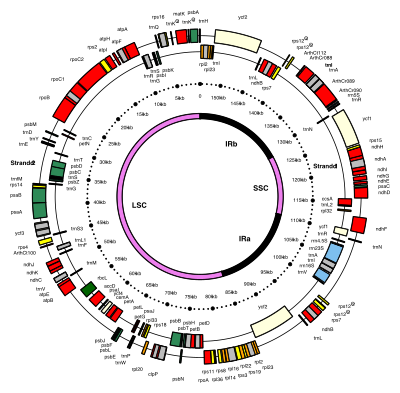 Карта ДНК хлоропластов 154 т.п.н. модельного цветущего растения (Arabidopsis thaliana : Brassicaceae) с генами и инвертированными повторами.
Карта ДНК хлоропластов 154 т.п.н. модельного цветущего растения (Arabidopsis thaliana : Brassicaceae) с генами и инвертированными повторами. ДНК хлоропластов имеют кольцевую форму и обычно имеют длину 120 000–170 000 пар оснований. Они могут иметь контурную длину около 30–60 микрометров и массу около 80–130 миллионов дальтон..
У большинства хлоропластов весь геном хлоропластов объединен в одно большое кольцо, хотя те из них Водоросли-динофиты являются заметным исключением - их геном разбит примерно на сорок маленьких плазмид, каждая из которых составляет 2 000–10 000 пар оснований длиной. Каждое мини-кольцо содержит от одного до трех генов, но также были обнаружены пустые плазмиды без кодирующей ДНК.
Многие ДНК хлоропластов содержат два инвертированных повтора, которые отделяют длинный однокопийный участок (LSC) от короткого однокопийного участка (SSC).
Перевернутый повторы сильно различаются по длине, в пределах от 4000 до 25000 пар оснований каждый. Инвертированные повторы у растений, как правило, находятся в верхней части этого диапазона, каждый из которых имеет длину 20 000–25 000 пар оснований. Области инвертированных повторов обычно содержат три гена рибосомной РНК и два тРНК, но они могут быть расширены или уменьшены, чтобы содержать от четырех до более 150 генов. Хотя данная пара инвертированных повторов редко бывает полностью идентична, они всегда очень похожи друг на друга, очевидно, в результате согласованной эволюции.
Области инвертированных повторов очень консервативны среди наземных растений, и накапливают несколько мутаций. Подобные инвертированные повторы существуют в геномах цианобактерий и двух других линий хлоропластов (glaucophyta и rhodophyceæ ), что позволяет предположить, что они предшествуют хлоропласту, хотя некоторые хлоропластные ДНК, подобные ДНК горох и несколько красных водорослей с тех пор потеряли инвертированные повторы. Другие, такие как красная водоросль Porphyra, перевернули один из своих перевернутых повторов (сделав их прямыми повторами). Возможно, что инвертированные повторы помогают стабилизировать остальную часть генома хлоропласта, так как ДНК хлоропласта, потерявшая некоторые из сегментов инвертированного повтора, имеет тенденцию к большей перестройке.
ДНК хлоропласта долгое время считалось, что она имеет круговую структуру, но некоторые данные свидетельствуют о том, что ДНК хлоропластов чаще принимает линейную форму. Было обнаружено, что более 95% ДНК хлоропластов в хлоропластах кукурузы имеют разветвленную линейную форму, а не отдельные круги.
Каждый хлоропласт содержит около 100 копий его ДНК в молодых листьях, уменьшается до 15–20 копий в старых листьях. Обычно они упакованы в нуклеоиды, которые могут содержать несколько идентичных колец ДНК хлоропластов. В каждом хлоропласте можно найти множество нуклеоидов.
Хотя ДНК хлоропласта не связана с истинными гистонами, в красных водорослях гистоноподобный белок хлоропласта (HC) кодируется хлоропластной ДНК, которая плотно упаковывает каждое кольцо хлоропластной ДНК в нуклеоид.
У примитивных красных водорослей нуклеоиды хлоропластной ДНК сгруппированы в центр хлоропласта, тогда как в зеленых растениях и зеленых водорослях нуклеоиды рассредоточены по всей строме.
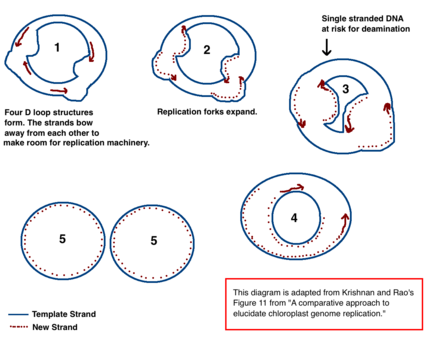 ДНК хлоропласта репликация через несколько механизмов петли D. Адаптировано из статьи Кришнана Н.М., Рао Б.Дж. «Сравнительный подход к выяснению репликации хлоропластного генома».
ДНК хлоропласта репликация через несколько механизмов петли D. Адаптировано из статьи Кришнана Н.М., Рао Б.Дж. «Сравнительный подход к выяснению репликации хлоропластного генома». Механизм репликации хлоропластной ДНК (хпДНК) окончательно не определен, но были предложены две основные модели. Ученые пытались наблюдать репликацию хлоропластов с помощью электронной микроскопии с 1970-х годов. Результаты экспериментов с микроскопией привели к идее, что ДНК хлоропластов реплицируется с использованием петли двойного смещения (D-петля). По мере того, как D-петля движется по кольцевой ДНК, она принимает промежуточную форму тета, также известную как промежуточное звено репликации Кэрнса, и завершает репликацию с помощью механизма катящегося круга. Репликация начинается в определенных точках происхождения. Множественные открытия, позволяющие репликационному механизму реплицировать ДНК. По мере продолжения репликации вилки разрастаются и в конечном итоге сходятся. Новые структуры хпДНК разделяются, образуя дочерние хромосомы хпДНК.
В дополнение к ранним микроскопическим экспериментам эта модель также подтверждается количествами дезаминирования, обнаруженными в хпДНК. Дезаминирование происходит, когда аминогруппа потеряна и представляет собой мутацию, которая часто приводит к изменениям оснований. Когда аденин дезаминируется, он становится гипоксантином. Гипоксантин может связываться с цитозином, и когда пара оснований XC реплицируется, он становится GC (таким образом, происходит изменение основания A → G).
 Со временем могут возникать изменения оснований в последовательности ДНК от мутаций дезаминирования. Когда аденин дезаминируется, он становится гипоксантином, который может соединяться с цитозином. Во время репликации цитозин будет спариваться с гуанином, вызывая изменение основания A → G.
Со временем могут возникать изменения оснований в последовательности ДНК от мутаций дезаминирования. Когда аденин дезаминируется, он становится гипоксантином, который может соединяться с цитозином. Во время репликации цитозин будет спариваться с гуанином, вызывая изменение основания A → G. В хпДНК существует несколько градиентов дезаминирования A → G. ДНК становится восприимчивой к событиям дезаминирования, когда она является одноцепочечной. Когда образуются репликационные вилки, не копируемая нить является однонитевой и, следовательно, подвержена риску дезаминирования A → G. Следовательно, градиенты дезаминирования указывают на то, что вилки репликации, скорее всего, присутствовали, и направление, в котором они изначально открывались (самый высокий градиент, скорее всего, находится ближе всего к месту старта, потому что он был одноцепочечным в течение самого длительного периода времени). Этот механизм до сих пор является ведущей теорией; однако вторая теория предполагает, что большая часть хпДНК на самом деле линейна и реплицируется посредством гомологичной рекомбинации. Далее он утверждает, что только меньшая часть генетического материала хранится в кольцевых хромосомах, тогда как остальная часть находится в разветвленных, линейных или других сложных структурах.
Одна из основных конкурирующие модели для хпДНК утверждают, что большая часть хпДНК является линейной и участвует в гомологичной рекомбинации и структурах репликации, подобных бактериофагу Т4. Было установлено, что некоторые растения имеют линейную хпДНК, например кукурузу, и что многие из них все еще содержат сложные структуры, которые ученые еще не понимают; однако сегодня преобладает мнение, что большая часть хпДНК является кольцевой. Когда были выполнены оригинальные эксперименты с хпДНК, ученые действительно заметили линейные структуры; однако они приписали эти линейные формы ломаным кругам. Если разветвленные и сложные структуры, наблюдаемые в экспериментах с хпДНК, являются реальными, а не артефактами конкатенированной кольцевой ДНК или разорванных кругов, то механизма репликации D-петли недостаточно, чтобы объяснить, как эти структуры будут реплицироваться. В то же время гомологичная рекомбинация не объясняет множественные градиенты A → G, наблюдаемые в пластомах. Этот недостаток является одним из самых больших для теории линейной структуры.
Геном хлоропласта обычно включает около 100 генов, которые кодируют различные вещи, в основном связанные с протеиновым конвейером и фотосинтез. Как и в прокариотах, гены в хлоропластной ДНК организованы в опероны. Интроны распространены в молекулах хлоропластной ДНК, в то время как они редко встречаются в прокариотах Молекулы ДНК (растительные митохондриальные ДНК обычно имеют интроны, но не мтДНК человека).
Среди наземных растений содержание генома хлоропластов довольно похоже - они кодируют четыре рибосомные РНК, 30–31 тРНК, 21 рибосомные белки и 4 субъединицы РНК-полимеразы, участвующие в синтезе белка. Для фотосинтеза ДНК хлоропласта включает гены 28 тилакоидных белков и большой субъединицы Rubisco. Кроме того, его гены кодируют одиннадцать субъединиц белкового комплекса, который опосредует окислительно-восстановительные реакции по рециркуляции электронов, что аналогично НАДН-дегидрогеназе, обнаруженной в митохондриях.
Со временем многие части генома хлоропласта были перенесены в ядерный геном хозяина, этот процесс называется перенос эндосимбиотического гена. В результате геном хлоропласта сильно сокращен по сравнению с геномом свободноживущих цианобактерий. Хлоропласты могут содержать 60–100 генов, тогда как цианобактерии часто имеют более 1500 генов в своем геноме. Напротив, известно лишь несколько случаев, когда гены были перенесены в хлоропласт от различных доноров, включая бактерии.
Эндосимбиотический перенос генов - это то, откуда мы знаем о потерянных хлоропластах во многих хромальвеолатные линии. Даже если хлоропласт в конечном итоге потерян, гены, которые он передал ядру бывшего хозяина, сохраняются, что свидетельствует о существовании утраченного хлоропласта. Например, в то время как диатомовые (гетероконтофит ) теперь имеют хлоропласт, происходящий из красных водорослей, наличие многих генов зеленых водорослей в ядро диатомовых водорослей свидетельствует о том, что у предка диатомовых водорослей (вероятно, также и у предков всех хромальвеолатов) в какой-то момент был хлоропласт, полученный из зеленых водорослей, который впоследствии был заменен красным хлоропластом.
На суше У растений примерно 11–14% ДНК в их ядрах можно проследить до хлоропластов, до 18% у Arabidopsis, что соответствует примерно 4500 генам, кодирующим белок. Недавно было осуществлено несколько переносов генов из ДНК хлоропластов в ядерный геном наземных растений.
Из примерно трех тысяч белков, обнаруженных в хлоропластах, некоторые 95% из них кодируются ядерными генами. Многие белковые комплексы хлоропласта состоят из субъединиц как генома хлоропласта, так и ядерного генома хозяина. В результате синтез белка должен координироваться между хлоропластом и ядром. Хлоропласт в основном находится под ядерным контролем, хотя хлоропласты также могут выдавать сигналы, регулирующие экспрессию гена в ядре, называемую.
Синтез белка в хлоропластах зависит от РНК-полимераза, кодируемая собственным геномом хлоропласта, которая связана с РНК-полимеразами, обнаруженными в бактериях. Хлоропласты также содержат загадочную вторую РНК-полимеразу, которая кодируется ядерным геномом растения. Две РНК-полимеразы могут распознавать и связываться с разными видами промоторов в геноме хлоропласта. рибосомы в хлоропластах аналогичны бактериальным рибосомам.
- это вставка, делеция и замена нуклеотидов в транскрипте мРНК перед трансляцией в белок. Сильно окислительная среда внутри хлоропластов увеличивает скорость мутаций, поэтому посттранскрипционная репарация необходима для сохранения функциональных последовательностей. Эдитосома хлоропласта заменяет C ->U и U ->C в очень определенных местах транскрипта. Это может изменить кодон аминокислоты или восстановить нефункциональный псевдоген, добавив стартовый кодон AUG или удалив преждевременный стоп-кодон UAA.
Эдитосома распознает и связывается с цис-последовательностью перед редактирующим сайтом. Расстояние между сайтом связывания и сайтом редактирования зависит от гена и белков, участвующих в редактировании. Сотни различных белков PPR ядерного генома участвуют в процессе редактирования РНК. Эти белки состоят из 35-мерных повторяющихся аминокислот, последовательность которых определяет сайт связывания цис для отредактированного транскрипта.
Базальные наземные растения, такие как печеночники, мхи и папоротники, имеют сотни различных сайтов редактирования, в то время как цветковые растения обычно бывает от тридцати до сорока. У паразитарных растений, таких как Epifagus virginiana, наблюдается потеря редактирования РНК, что приводит к потере функции генов фотосинтеза.
Перемещение большого количества хлоропластов гены в ядро означает, что многие хлоропластные белки, которые, как предполагалось, были транслированы в хлоропласте, теперь синтезируются в цитоплазме. Это означает, что эти белки должны быть направлены обратно в хлоропласт и импортированы как минимум через две мембраны хлоропластов.
Любопытно, что около половины белковых продуктов перенесенных генов даже не нацелены обратно в хлоропласт. Многие из них стали экзаптациями, взяв на себя новые функции, такие как участие в делении клеток и даже устойчивость к болезням. Несколько генов хлоропластов нашли новые пристанища в митохондриальном геноме - большинство из них стало нефункциональными псевдогенами, хотя несколько генов тРНК все еще работают в митохондриях. Некоторые перенесенные белковые продукты хлоропластной ДНК направляются в секреторный путь (хотя многие вторичные пластиды ограничены самой внешней мембраной, происходящей из клеточной мембраны хозяина, и, следовательно, топологически вне клетки, потому что для достижения хлоропласта из цитозоля вы должны пересечь клеточную мембрану, как если бы вы направлялись к внеклеточное пространство. В этих случаях белки, нацеленные на хлоропласты, первоначально перемещаются по секреторному пути).
Поскольку клетка, приобретающая хлоропласт , уже имела митохондрии (и пероксисомы и клеточная мембрана для секреции) новому хлоропластному хозяину пришлось разработать уникальную систему нацеливания на белки, чтобы избежать попадания белков хлоропластов. отправлено в неправильную органеллу.
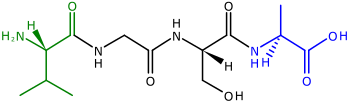 A полипептид с четырьмя аминокислотами, связанными с ее. Слева находится N-конец с его амино (H2N) группой зеленого цвета. Синий С-конец с его карбоксильной группой (CO2H) находится справа.
A полипептид с четырьмя аминокислотами, связанными с ее. Слева находится N-конец с его амино (H2N) группой зеленого цвета. Синий С-конец с его карбоксильной группой (CO2H) находится справа. Полипептиды, предшественники белков, представляют собой цепи аминокислот. Два конца полипептида называются N-концом, или амино-концом, и С-концом, или карбоксильным концом. Для многих (но не всех) белков хлоропластов, кодируемых ядерными генами, расщепляемые транзитные пептиды добавляются к N-концам полипептидов, которые используются, чтобы помочь направить полипептид к хлоропласт для импорта (N-концевые транзитные пептиды также используются для направления полипептидов к митохондриям растений ). N-концевые транзитные последовательности также называют пре-последовательностями, потому что они расположены на «переднем» конце полипептида - рибосомы синтезируют полипептиды от N-конца до C-конца.
Хлоропласт. транзитные пептиды обладают огромным разнообразием по длине и аминокислотной последовательности. Они могут состоять из 20–150 аминокислот - необычно большой длины, что позволяет предположить, что транзитные пептиды на самом деле представляют собой совокупности доменов с различными функциями. Транзитные пептиды, как правило, положительно заряжены, богаты гидроксилированными аминокислотами, такими как серин, треонин и пролин и с низким содержанием кислых аминокислот, таких как аспарагиновая кислота и глутаминовая кислота. В водном растворе транзитная последовательность образует случайный клубок.
Однако не все хлоропластные белки включают N-концевой расщепляемый транзитный пептид. Некоторые включают транзитную последовательность в пределах функциональной части самого белка. У некоторых транзитная последовательность вместо этого добавляется к их С-концу. Большинство полипептидов, у которых отсутствуют N-концевые целевые последовательности, - это полипептиды, которые отправляются на внешнюю мембрану хлоропласта, плюс, по крайней мере, один отправляется на внутреннюю мембрану хлоропласта.
После того, как хлоропласт полипептид синтезируется на рибосоме в цитозоле, АТФ энергия может быть использована для фосфорилируют или добавляют фосфатную группу ко многим (но не всем) из них в их транзитных последовательностях. Серин и треонин (оба очень часто встречаются в транзитных последовательностях хлоропластов (составляющие 20–30% последовательности) часто являются аминокислотами, которые принимают фосфатную группу. Фермент , осуществляющий фосфорилирование, специфичен для полипептидов хлоропластов и игнорирует ферменты, предназначенные для митохондрий или пероксисом.
Фосфорилирование изменяет форму полипептида, что упрощает прикрепление 14-3-3 белков к полипептиду. У растений 14-3-3 белки связываются только с препротеинами хлоропластов. Он также связывается hсъесть s скакательный сустав pбелок Hsp70, который препятствует преждевременному сворачиванию полипептида. Это важно, потому что это не позволяет белкам хлоропластов принимать свою активную форму и выполнять свои функции хлоропластов в неправильном месте - цитозоле. В то же время они должны сохранять форму, достаточную для того, чтобы их можно было распознать и импортировать в хлоропласт.
Белок теплового шока и белки 14-3-3 вместе образуют комплекс управления цитозолом, который делает полипептиду хлоропласта легче попасть в хлоропласт.
В качестве альтернативы, если транзитный пептид препротеина хлоропласта не фосфорилирован, препротеин хлоропласта все еще может прикрепляться к белку теплового шока или. Эти комплексы могут связываться с комплексом TOC на внешней мембране хлоропласта, используя энергию GTP.
Комплекс ТОС, или tранслокон на o матке c хлоропластной мембране, представляет собой набор белков, которые импортируют препротеины через внешняя оболочка хлоропласта. Идентифицированы пять субъединиц комплекса TOC - два GTP -связывающих белка и туннель импорта белка, плюс белки и.
Первые три белка образуют основной комплекс, состоящий из одного Toc159, от четырех до пяти Toc34 и четырех Toc75, которые образуют четыре отверстия в диске диаметром 13 нанометров. Весь основной комплекс весит около 500 килодальтон. Два других белка, Toc64 и Toc12, связаны с основным комплексом, но не являются его частью.
![Toc34 из растения гороха. Toc34 имеет три почти идентичных молекулы (показаны немного разными оттенками зеленого), каждая из которых образует димер с одной из соседних молекул. Часть сайта связывания молекулы GDP выделена розовым цветом. [48]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e4/TOC34.png/350px-TOC34.png) Toc34 из растения гороха. Toc34 имеет три почти идентичных молекулы (показаны немного разными оттенками зеленого), каждая из которых образует димер с одной из своих соседних молекул. Часть сайта связывания молекулы GDP выделена розовым цветом.
Toc34 из растения гороха. Toc34 имеет три почти идентичных молекулы (показаны немного разными оттенками зеленого), каждая из которых образует димер с одной из своих соседних молекул. Часть сайта связывания молекулы GDP выделена розовым цветом. представляет собой интегральный белок во внешней мембране хлоропласта, который закреплен в ней его гидрофобной C-терминал хвост. Однако большая часть белка, включая его большой гуанозинтрифосфат (GTP) -связывающий домен, проецируется в строму.
Задача Toc34 - улавливать хлоропласты препротеины в цитозоле и передают их остальной части комплекса ТОС. Когда GTP, энергетическая молекула, подобная ATP, присоединяется к Toc34, белок становится гораздо более способным связываться со многими препротеинами хлоропластов в цитозоле. Присутствие препротеина хлоропласта заставляет Toc34 расщеплять GTP на гуанозиндифосфат (GDP) и неорганический фосфат. Эта потеря GTP заставляет белок Toc34 высвобождать препротеин хлоропласта, передавая его следующему белку TOC. Затем Toc34 высвобождает обедненную молекулу GDP, вероятно, с помощью неизвестного коэффициента обмена GDP. Домен of может быть фактором обмена, который выполняет удаление GDP. Затем белок Toc34 может принять другую молекулу GTP и снова начать цикл.
Toc34 может быть отключен посредством фосфорилирования. протеинкиназа, перемещающаяся по внешней мембране хлоропласта, может использовать АТФ для добавления фосфатной группы к белку Toc34, не позволяя ему получить другую молекула GTP, ингибирующая активность белка. Это может обеспечить способ регулирования импорта белка в хлоропласты.
Arabidopsis thaliana содержит два гомологичных белка, и (At означает A rabidopsis t haliana), каждый из которых примерно на 60% идентичен по аминокислотной последовательности с Toc34 в горохе (называемый psToc34). AtToc33 является наиболее распространенным у арабидопсиса и является функциональным аналогом Toc34, потому что он может быть отключен путем фосфорилирования. AtToc34, с другой стороны, не может быть фосфорилирован.
представляет собой другую GTP связывающую TOC субъединицу, например. Toc159 имеет три домена . На N-конце находится A-домен, который богат кислыми аминокислотами и занимает примерно половину длины белка. A-домен часто отщепляется, оставляя вызываемый фрагмент 86 килодальтон. В середине находится его связывающий домен GTP, который очень похож на гомологичный GTP-связывающий домен в Toc34. На C-конце конце находится гидрофильный M-домен, который прикрепляет белок к внешней мембране хлоропласта.
Toc159, вероятно, работает во многом так же, как Toc34, распознавая белки в цитозоле с использованием GTP. Он может регулироваться посредством фосфорилирования, но с помощью другой протеинкиназы, чем та, которая фосфорилирует Toc34. Его M-домен является частью туннеля, через который проходят препротеины хлоропластов, и, по-видимому, обеспечивает силу, которая проталкивает препротеины, используя энергию от GTP.
. Toc159 не всегда находится в составе комплекса TOC - он также был обнаружен растворенным в цитозоле. Это предполагает, что он может действовать как челнок, который находит препротеины хлоропластов в цитозоле и переносит их обратно в комплекс TOC. Однако прямых доказательств такого поведения не так много.
Семейство белков Toc159, обнаруженных в Arabidopsis thaliana. Они различаются по длине своих A-доменов, которая полностью отсутствует в Toc90. Toc132, Toc120 и Toc90, по-видимому, выполняют специализированные функции по импорту таких веществ, как нефотосинтетические препротеины, и не могут заменить Toc159.

является наиболее распространенным белком на внешней оболочке хлоропласта. Это трансмембранная трубка, которая формирует большую часть самой поры TOC. Toc75 представляет собой канал β-ствола, облицованный 16 β-гофрированными листами. Образовавшееся отверстие имеет ширину около 2,5 нанометров на концах и сжимается до 1,4–1,6 нанометра в диаметре в самом узком месте - достаточно широкого, чтобы позволить частично свернутым препротеинам хлоропласта пройти через него.
Toc75 также может связываться с препротеинами хлоропластов, но в этом отношении он намного хуже, чем Toc34 или Toc159.
Arabidopsis thaliana имеет несколько изоформ, названных по хромосомной позиции кодирующих для них генов. является наиболее распространенным из них.
Транслокон TIC, или t ранслокон на i nner c мембрана хлоропласта транслокон - еще один белковый комплекс, который импортирует белки через внутреннюю оболочку хлоропласта. Полипептидные цепи хлоропластов, вероятно, часто проходят через два комплекса одновременно, но комплекс TIC также может извлекать препротеины, потерянные в межмембранном пространстве.
Подобно транслокону TIC, он имеет большой сердцевинный комплекс окружены некоторыми слабо связанными периферическими белками, такими как, и. Основной комплекс весит около миллиона дальтон и содержит, возможно, по три каждого из них.
представляет собой интегральный белок, который, как считается, имеет четыре трансмембранных α-спиралей. Он находится в комплексе TIC в 1 миллион дальтон. Поскольку он похож на транспортеры бактериальной аминокислоты и митохондриальный импортируемый белок (tранслоказа на iвнутренней м. итохондриальный м эмбран ), он был предложен как часть канала импорта TIC. Однако in vitro доказательств этого не имеет. В Arabidopsis thaliana известно, что примерно на каждые пять белков внешней мембраны хлоропласта приходится два белка (основная форма Tic20 в Arabidopsis ) во внутренней мембране хлоропласта.
В отличие от, или, Tic20 имеет гомологичных родственников в цианобактериях и почти во всех линиях хлоропластов, что позволяет предположить, что он развился до первого эндосимбиоза хлоропластов. и являются уникальными для хлоропластов хлоропластидана, что позволяет предположить, что они эволюционировали позже.
- еще один основной комплексный белок TIC, названный так потому, что он весит чуть менее 214 килодальтон.. Он состоит из 1786 аминокислот и, как полагают, имеет шесть трансмембранных доменов на своем N-конце конце. Tic214 примечателен тем, что кодируется ДНК хлоропластов, а точнее первой открытой рамкой считывания. Tic214 и вместе, вероятно, составляют часть комплекса TIC в один миллион дальтон, который охватывает всю мембрану. Tic20 похоронен внутри комплекса, тогда как Tic214 открыт с обеих сторон внутренней мембраны хлоропласта.
- это кодируемый ядром белок, содержащий 871 аминокислот долго. В совокупности 871 аминокислота весит немногим менее 100 тысяч дальтон, и поскольку зрелый белок, вероятно, не теряет никаких аминокислот, когда сам импортируется в хлоропласт (он не имеет расщепляемого транзитного пептида ).>), он получил название Tic100. Tic100 находится на краях комплекса в 1 миллион дальтон на стороне, которая обращена к межмембранному пространству хлоропластов.
также является кодируемым ядром белком. препротеин, который кодирует его ген, имеет длину 527 аминокислот и весит около 62 тысяч дальтон ; зрелая форма, вероятно, подвергается обработке, которая сокращает ее до веса 56 тысяч дальтон, когда она попадает в хлоропласт. Tic56 в значительной степени встроен в комплекс размером 1 миллион дальтон.
Tic56 и очень консервативен среди наземных растений, но они не похожи ни на один белок, функция которого известна. Ни у одного из них нет трансмембранных доменов.