 A График свободной энергии Гиббса энантиоселективной реакции присоединения. Эффект асимметричной индукции заключается в понижении энергии переходного состояния для образования одного энантиомера по сравнению с другим
A График свободной энергии Гиббса энантиоселективной реакции присоединения. Эффект асимметричной индукции заключается в понижении энергии переходного состояния для образования одного энантиомера по сравнению с другим В стереохимии, асимметричная индукция (также энантиоиндукция ) описывает преимущественное образование в химической реакции одного энантиомера или диастереоизомера по сравнению с другим в результате влияния хирального признак, присутствующий в субстрате, реагенте, катализаторе или окружающей среде. Асимметричная индукция - ключевой элемент в асимметричном синтезе.
Асимметричная индукция была введена Германом Эмилем Фишером на основе его работы по углеводам. Существует несколько типов индукции.
Внутренняя асимметричная индукция использует хиральный центр, связанный с реактивным центром посредством ковалентной связи, и остается таковой во время реакции. Исходный материал часто получают из синтеза хирального пула. В асимметричной индукции с ретрансляцией хиральная информация вводится на отдельном этапе и удаляется снова в отдельной химической реакции. Специальные синтоны называются хиральными вспомогательными веществами. В внешней асимметричной индукции хиральная информация вводится в переходном состоянии через катализатор из хирального лиганда. Этот метод асимметричного синтеза экономически наиболее желателен.
Существует несколько моделей для описания хиральной индукции по карбонильным углеродам во время нуклеофильных добавлений. Эти модели основаны на сочетании стерических и электронных соображений и часто противоречат друг другу. Модели были разработаны Крамом (1952), Корнфортом (1959), Фелкиным (1969) и другими.
Правило асимметричной индукции Крэма, разработанное Дональдом Дж. Крамом в 1952 году, является ранней концепцией, относящейся к предсказанию стереохимии. в некоторых ациклических системах. В целом правило таково:
В некоторых некаталитических реакциях будет преобладать диастереомер, который может быть образован приближением входящей группы с наименее затрудненной стороны, когда вращательная конформация связи CC такова, что двойная связь фланкируется двумя наименее объемными группами, присоединенными к соседнему асимметричному центру.
Правило указывает на то, что наличие асимметричного центра в молекуле вызывает образование соседнего с ним асимметричного центра на основе стерических препятствий.
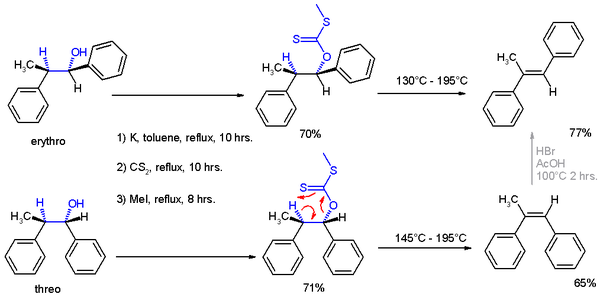
В своей публикации 1952 года Крам представил большое количество реакций описал в литературе, для которой конформация продуктов реакции может быть объяснена на основе этого правила, и он также описал сложный эксперимент (схема 1), подтверждающий его аргументы.

Эксперименты включали две реакции. В эксперименте один 2-фенилпропиональдегид (1, рацемический, но (R) -энантиомер показан) реагировал с реактивом Гриньяра бромбензола до 1,2-дифенил-1. -пропанол (2 ) в виде смеси диастереомеров, преимущественно стерео изомера (см. объяснение в проекции Фишера ).
Предпочтение образования изомера трео может быть объяснено правилом, изложенным выше, тем, что активный нуклеофил в этой реакции атакует карбонильную группу с наименьшей с затрудненной стороной (см. проекцию Ньюмана A), когда карбонил расположен в шахматном образовании с метильной группой и атомом водорода, которые - два наименьших заместителя, создающих минимум стерических препятствий, в гош-ориентации и фенил как наиболее объемная группа в антиконформация.
Вторая реакция - это органическое восстановление 1,2-дифенил-1-пропанона 2 с помощью алюмогидрида лития, в результате чего в том же продукте реакции, что и выше, но теперь предпочтение отдается изомеру эритро (2a ). Теперь гидрид анион (H) - это нуклеофил, атакующий с наименее затрудненной стороны (представьте, что водород поступает из бумажного самолетика).
В оригинальной публикации 1952 года были получены дополнительные доказательства для структурной принадлежности продуктов реакции путем применения их к элиминированию Чугаева, где изомер трео реагирует с цис-изомером -α-метил- стильбена и эритроизомера транс-версии.
Модель Фелкина (1968), названная в честь Хью Фелкина, также предсказывает стереохимию нуклеофильного присоединения реакции на карбонильные группы. Фелкин утверждал, что модель Крэма страдает серьезным недостатком: затмевает конформацию в переходном состоянии между карбонильным заместителем (атом водорода в альдегидах) и самым большим α-карбонильным заместителем. Он продемонстрировал, что за счет увеличения стерического объема карбонильного заместителя от метил до этил до изопропил до изобутил, стереоселективность также увеличилось, что не предсказывается правилом Крэма:

Правила Фелкина:

Модель Фелкина – Аня является расширением модели Фелкина, которая включает улучшения, предложенные Нгуен Тронг Ань и Одиль Эйзенштейн для исправления два ключевых недостатка модели Фелкина. Первой уязвимостью было заявление Фелкина о сильном полярном эффекте в переходных состояниях нуклеофильного присоединения, который приводит к полной инверсии стереохимии реакциями S N 2, без каких-либо обоснований того, почему это явление наблюдалось.. Решение Anh заключалось в том, чтобы предложить антиперипланарный эффект как следствие асимметричной индукции, контролируемой как заместительными, так и орбитальными эффектами. В этом эффекте σ * -орбиталь лучшего акцептора нуклеофила выстраивается параллельно π и π * орбиталям карбонила, которые обеспечивают стабилизацию поступающего аниона.

Вторым недостатком модели Фелкина было допущение минимизации заместителей вокруг карбонила R, что не может быть применено к альдегидам.

Включение угла Бюрги-Дуница позволило Аню постулировать неперпендикулярную атаку нуклеофила на карбонильный центр в любом месте от 95 ° до 105 ° относительно двойной связи кислород-углерод, отдавая предпочтение приблизиться к меньшему заместителю и тем самым решить проблему предсказуемости для альдегидов.
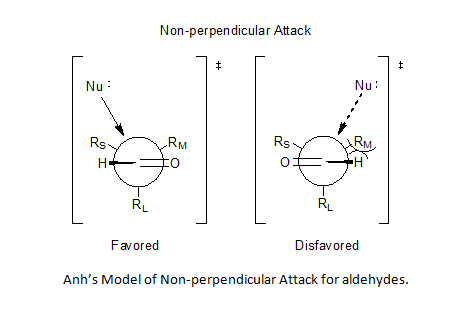
Хотя модели Крэма и Фелкина-Аня различаются рассмотренными конформерами и другими предположения, они оба пытаются объяснить одно и то же основное явление: предпочтительное добавление нуклеофила к наиболее стерически благоприятной стороне карбонильной части. Однако существует множество примеров реакций, которые демонстрируют стереоселективность, противоположную той, что предсказывается основными принципами моделей Крам и Фелкина – Аня. Хотя обе модели включают попытки объяснить эти изменения, полученные продукты все еще называются продуктами «антифелкина». Один из наиболее распространенных примеров измененной селективности асимметричной индукции требует, чтобы α-углерод был замещен компонентом с символом основания Льюиса (то есть заместителями O, N, S, P). В этой ситуации, если вводится кислота Льюиса, такая как Al-iPr 2 или Zn, может наблюдаться эффект бидентатного хелатирования. Это блокирует карбонил и заместитель основания Льюиса в закрытой конформации, и затем нуклеофил будет атаковать со стороны с наименьшим свободным α-углеродным заместителем. Если хелатирующая группа R определена как самая большая, это приведет к получению «антифелкинского» продукта.
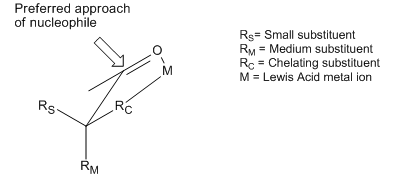
Этот стереоселективный контроль был признан и обсужден в первой статье, устанавливающей модель Крэма, в результате чего Крам утверждал, что его модель требует нехелатных условий. Пример хелатирования контроля реакции можно увидеть здесь из статьи 1987 года, в которой впервые непосредственно наблюдалось такое промежуточное соединение «крам-хелат», подтверждающее модель:

Здесь метил хлорид титана образует крам-хелат. Затем метильная группа диссоциирует от титана и атакует карбонил, что приводит к образованию диастереомера Фелкина.
Эффект нехелатирующего электроноакцепторного заместителя также может приводить к селективности против Фелкина. Если заместитель на α-углероде является в достаточной степени электроноакцепторным, нуклеофил добавит анти- по отношению к электроноакцепторной группе, даже если заместитель не является самым большим из 3 связанных к α-углероду. Каждая модель предлагает несколько разное объяснение этого явления. Полярный эффект был постулирован моделью Корнфорта и исходной моделью Фелкина, в которой заместитель EWG и входящий нуклеофил располагались анти- друг к другу, чтобы наиболее эффективно нейтрализовать дипольный момент структура перехода .

Эта проекция Ньюмана иллюстрирует переходное состояние Корнфорта и Фелкина , которое ставит EWG против входящего нуклеофила, независимо от его стерический объем относительно R S и R L.
. Усовершенствованная модель Фелкина-Аня, как обсуждалось выше, делает более сложную оценку полярного эффекта, учитывая молекулярные орбитальные взаимодействия в стабилизация предпочтительного переходного состояния. Типичная реакция, иллюстрирующая потенциальную антифелкинскую селективность этого эффекта, вместе с предполагаемой переходной структурой, изображена ниже:

Было обнаружено что стереоэлектронная среда у β-углерода также может направлять асимметричную индукцию. За прошедшие годы был разработан ряд прогностических моделей, позволяющих определить стереоселективность таких реакций.
Согласно Ритцу, модель Cram-хелата для 1,2-индукции может быть расширена для прогнозирования хелатного комплекса β-алкоксиальдегида и металла. Видно, что нуклеофил атакует с менее стерически затрудненной стороны и против заместителя R β, что приводит к антиаддукту в качестве основного продукта.
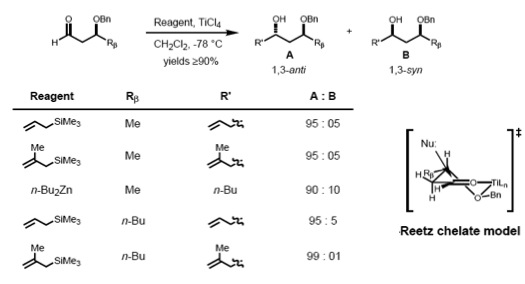
Для образования таких хелатов металлический центр должен имеют по крайней мере два свободных координационных центра, а защитные лиганды должны образовывать бидентатный комплекс с кислотой Льюиса.
Крам и Ритц продемонстрировали, что 1,3-стереоконтроль возможен, если реакция протекает через ациклическое переходное состояние. Реакция β-алкоксиальдегида с аллилтриметилсиланом показала хорошую селективность в отношении анти-1,3-диола, что объясняется полярной моделью Крам. Полярная бензилоксигруппа ориентирована против карбонила, чтобы минимизировать дипольные взаимодействия, и нуклеофил атакует против более массивных (R M) оставшихся двух заместителей.

Совсем недавно Эванс представил другую модель нехелатной 1,3-индукции. В предложенном переходном состоянии β-стереоцентр ориентирован против поступающего нуклеофила, как видно из модели Фелкина-Аня. Полярная группа X в β-стереоцентре размещается против карбонила для уменьшения дипольных взаимодействий, а Rβ размещается против альдегидной группы, чтобы минимизировать стерические препятствия. Следовательно, 1,3-антидиол можно было бы предсказать как основной продукт.

Если субстрат имеет как α-, так и β-стереоцентры, Правило Фелкина – Аня (1,2-индукция) и модель Эванса (1,3-индукция) следует рассматривать одновременно. Если эти два стереоцентра имеют анти-отношения, обе модели предсказывают один и тот же диастереомер (случай, усиливающий стерео).
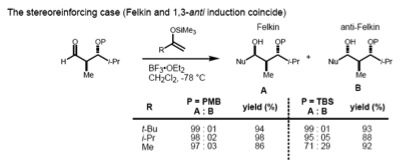
Однако в случае син-субстрата модели Фелкина-Аня и Эванса предсказывают разные продукты (нестереорекрепляющий случай). Было обнаружено, что размер поступающего нуклеофила определяет тип контроля над стереохимией. В случае большого нуклеофила взаимодействие α-стереоцентра с поступающим нуклеофилом становится доминирующим; поэтому продукт Felkin является основным. С другой стороны, меньшие нуклеофилы приводят к 1,3-контролю, определяющему асимметрию.

Хиральные ациклические алкены также проявляют диастереоселективность при таких реакциях, как эпоксидирование и енолятное алкилирование. Заместители вокруг алкена могут способствовать приближению электрофила с одной или другой стороны молекулы. Это основа модели Хоука, основанной на теоретической работе Кендалла Хоука, которая предсказывает, что селективность более сильная для цис-связей, чем для транс-двойных связей.

в показанный пример, th Цис-алкен принимает показанную конформацию, чтобы минимизировать стерическое столкновение между R S и метильной группой. Приближение электрофила предпочтительно происходит с одной и той же стороны средней группы (R M), а не с большой группы (R L), в основном с получением показанного диастереоизомера. Поскольку для транс-алкена стерические препятствия между R S и H-группой не такие большие, как для цис-случая, селективность намного ниже.
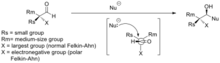 Модель Фелкина – Ана для нуклеофильного добавления к хиральным альдегидам
Модель Фелкина – Ана для нуклеофильного добавления к хиральным альдегидам 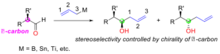 Контроль субстрата. добавление ахиральных аллилметаллов к α-хиральным альдегидам.
Контроль субстрата. добавление ахиральных аллилметаллов к α-хиральным альдегидам. 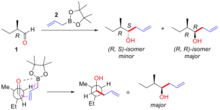 Пример контролируемого субстратом добавления ахирального аллилбора к α-хиральному альдегиду.
Пример контролируемого субстратом добавления ахирального аллилбора к α-хиральному альдегиду. Асимметричная индукция молекулярным каркасом ациклического субстрата заключается в том, что асимметричные стерические и электронные свойства молекулы могут определять хиральность последующих химических реакций на этой молекуле. Этот принцип используется для разработки химического синтеза, где имеется один стереоцентр и требуются дополнительные стереоцентры.
При рассмотрении того, как две функциональные группы или разновидности реагируют, точные трехмерные конфигурации задействованных химических объектов будут определять, как они могут сближаться. Любые ограничения относительно того, как эти частицы могут сближаться друг с другом, будут определять конфигурацию продукта реакции. В случае асимметричной индукции мы рассматриваем влияние одного асимметричного центра на молекулу на реакционную способность других функциональных групп на этой молекуле. Чем ближе друг к другу эти два участка, тем большее влияние ожидается. Более целостный подход к оценке этих факторов - это компьютерное моделирование, однако простые качественные факторы также могут использоваться для объяснения преобладающих тенденций, наблюдаемых для некоторых синтетических шагов. Простота и точность этого качественного подхода означает, что он чаще применяется при синтезе и проектировании подложек. Примерами подходящих молекулярных каркасов являются альфа-хиральные альдегиды и использование хиральных вспомогательных веществ.
Возможная реакционная способность по альдегидам включает нуклеофильную атаку и добавление аллилметаллов. Стереоселективность нуклеофильной атаки на альфа-хиральные альдегиды может быть описана с помощью моделей Фелкина-Аня или полярных моделей Фелкина-Аня, а добавление ахиральных аллилметаллов может быть описано правилом Крама.
Селективность в нуклеофильных добавках к хиральным альдегидам часто объясняется моделью Фелкина-Аня (см. Рисунок). Нуклеофил приближается к атому углерода карбонильной группы под углом Берги-Дунитца. На этой траектории атака с нижней стороны нежелательна из-за стерического размера прилегающей большой функциональной группы.
Полярная модель Фелкина – Аня применяется в сценарии, где X - электроотрицательная группа. Полярная модель Фелкина-Аня постулирует, что наблюдаемая стереохимия возникает из-за гиперконъюгативной стабилизации, возникающей из антиперипланарного взаимодействия между C-X антисвязывающей σ * орбиталью и формирующейся связью.
Повышение селективности Фелкина – Аня в отношении металлорганических добавок к альдегидам может быть достигнуто за счет использования алюминийорганических нуклеофилов вместо соответствующих нуклеофилов Гриньяра или литийорганических нуклеофилов. Клод Спино и его сотрудники продемонстрировали значительное улучшение стереоселективности при переходе с винилгриньяра на винилалановые реагенты с рядом хиральных альдегидов.
Добавление ахиральных аллилметаллов к альдегидам образует хиральный спирт, стереохимический результат этой реакции определяется хиральностью α-углерода на альдегидном субстрате (рисунок «Контроль субстрата: добавление ахиральных аллилметаллов к α-хиральным альдегидам»). Используемые аллилметаллические реагенты включают бор, олово и титан.
. Правило Крама объясняет стереоселективность с учетом переходного состояния, изображенного на рисунке 3. В переходном состоянии кислород свободен. пара может взаимодействовать с борным центром, в то время как аллильная группа может присоединяться к углеродному концу карбонильной группы. Пространственная потребность этого переходного состояния сводится к минимуму за счет конфигурации α-углерода, удерживающей наибольшую группу вдали от (транс к) перегруженной карбонильной группы, а группа аллилметалла приближается к наименьшей группе на α-углеродном центре. В приведенном ниже примере (Рисунок «Пример контролируемого субстратом добавления ахирального аллилбора к α-хиральному альдегиду») (R) -2-метилбутаналь (1) реагирует с реагентом аллилбора (2) с двумя возможными диастереомерами, из которых (R, R) -изомер является основным продуктом. Модель Крама этой реакции показана с карбонильной группой, помещенной в транс к этильной группе (большая группа), и аллилбором, проходящим мимо водорода (малая группа). Структура показана в проекции Ньюмана. В этом случае реакция нуклеофильного присоединения происходит на поверхности, где находится водород (малая группа), с образованием (R, R) -изомера в качестве основного продукта.
Асимметричная стереоиндукция может быть достигнута с использованием хиральных вспомогательных веществ. Хиральные вспомогательные вещества могут быть обратимо присоединены к субстрату, вызывая диастереоселективную реакцию перед расщеплением, в целом производя энантиоселективный процесс. Примеры хиральных вспомогательных веществ включают хиральные оксазолидиноновые вспомогательные вещества Эванса (для асимметричных альдольных реакций) псевдоэфедриновые амиды и трет-бутансульфинамид имины.
Циклические молекулы часто существуют в гораздо более жестких конформациях, чем их линейные аналоги. Даже очень большие макроциклы, такие как эритромицин, существуют в определенных геометрических формах, несмотря на наличие многих степеней свободы. Из-за этих свойств часто легче добиться асимметричной индукции с макроциклическими субстратами, чем с линейными. Ранние эксперименты, проведенные У. Кларк Стилл и его коллеги показали, что органические молекулы со средним и большим кольцом могут обеспечивать поразительные уровни стереоиндукции в качестве субстратов в таких реакциях, как кинетическое енолят алкилирование, присоединение и каталитическое гидрирование. Даже одной метильной группы часто достаточно для искажения диастереомерного результата реакции. Эти исследования, среди прочего, помогли бросить вызов широко распространенному мнению ученых о том, что большие кольца слишком гибкие, чтобы обеспечить какой-либо стереохимический контроль.
В ряде полных синтезов использовался макроциклический стереоконтроль для получения желаемых продуктов реакции. При синтезе (-) - кладиелла-6,11-диен-3-ола напряженный тризамещенный олефин был дигидроксилирован диазетереоселективно с помощью N-метилморфолина N-оксида (NMO) и четырехокись осмия в присутствии необработанного олефина. На пути к (±) -перипланону B химики достигли лицевого селективного эпоксидирования промежуточного соединения енона с использованием трет-бутилгидропероксида в присутствии двух других алкенов. Боргидрид натрия Восстановление 10-членного кольца енон промежуточного звена на пути к сесквитерпену происходило в соответствии с расчетами молекулярного моделирования, которые учитывали наименьшую энергию конформация макроцикла. Синтетические схемы, контролируемые субстратом, имеют много преимуществ, так как не требуют использования сложных асимметричных реагентов для достижения селективных превращений.
В органическом синтезе контроль реагентов - это подход к избирательному образованию одного стереоизомера из Во многих случаях стереоселективность определяется структурой и хиральностью используемого реагента. Когда хиральные аллилметаллы используются для реакции нуклеофильного присоединения к ахиральным альдегидам, хиральность вновь образованного углерода спирта определяется хиральностью реагентов аллиметалла (рис. 1). Хиральность аллиметаллов обычно обусловлена используемыми асимметричными лигандами. Металлы в реагентах на основе аллилметаллов включают бор, олово, титан, кремний и т. Д.
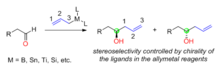 Фиг. 1: Контроль реагента: добавление хиральных аллилметаллов к ахиральным альдегидам
Фиг. 1: Контроль реагента: добавление хиральных аллилметаллов к ахиральным альдегидам Были разработаны различные хиральные лиганды для получения хиральных аллилметаллов для реакции с альдегидами. Х. C. Brown был первым, кто сообщил о хиральных реагентах на основе аллилбора для реакций асимметричного аллилирования с альдегидами. Хиральные реагенты аллилборона были синтезированы из природного продукта (+) - a-пинена в две стадии. Лиганды TADDOL, разработанные Дитером Зеебахом, были использованы для получения хиральных соединений аллилтитана для асимметричного аллилирования альдегидами. Джим Лейтон разработал хиральные соединения аллиз кремния, в которых высвобождение кольцевого штамма облегчало реакцию стереоселективного аллилирования, при этом энатиомерный избыток от 95% до 98% может быть достигнут для ряда ахиральных альдегидов.
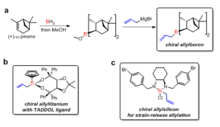 Рис. 2: Пример используемых хиральных аллилметаллов: (а) аллилбор, (б) аллилтитан и (в) аллилкремний
Рис. 2: Пример используемых хиральных аллилметаллов: (а) аллилбор, (б) аллилтитан и (в) аллилкремний