A никотиновый агонист - это препарат, имитирующий действие ацетилхолин (ACh) на никотиновых ацетилхолиновых рецепторах (nAChRs). NAChR назван из-за его сродства к никотину.
Примеры включают никотин (по определению), ацетилхолин (эндогенный агонист nAChR), холин, эпибатидин, лобелин, варениклин и цитизин.
 Химическая структура ABT-418
Химическая структура ABT-418 Никотин веками известен своим опьяняющим действием. Впервые он был выделен в 1828 году из растения табак немецкими химиками Поссельтом и Рейманом.
Положительное влияние никотина на память животных было обнаружено in vivo исследования в середине 1980-х гг. Эти исследования привели к новой эре в исследованиях никотиновых рецепторов ацетилхолина (nAChR) и их стимуляции, но до тех пор основное внимание уделялось никотиновой зависимости. Разработка агонистов nAChR началась в начале 1990-х годов после открытия положительных эффектов никотина. Некоторые исследования показали возможный вариант терапии в доклинических исследованиях. ABT-418 был одним из первых в серии агонистов nAChR и был разработан Abbott Labs. ABT-418 показал значительное увеличение производительности отложенного сопоставления с образцом (DMTS) у зрелых обезьян макак разных видов и полов. ABT-418 также был исследован как возможное средство лечения болезни Альцгеймера, болезни Паркинсона и синдрома дефицита внимания с гиперактивностью: эти эксперименты показали положительные результаты.
Одно из первых активных соединений nAChR, помимо никотина, которое было продано в качестве лекарственного средства использовался галантамин, растительный алкалоид, который действует как слабый ингибитор холинэстеразы (IC50 = 5 мкМ), а также как аллостерический сенсибилизатор для nAChR (EC50 = 50 нМ).
 Классификация никотиновых ацетилхолиновых рецепторов
Классификация никотиновых ацетилхолиновых рецепторов В человеческой нервной системе никотиновые холинергические сигналы являются распространяется по всей системе, где нейромедиатор ацетилхолин (ACh) играет ключевую роль в активации ионных каналов, управляемых лигандом. Холинергическая система - это жизненно важный нервный путь, где холинергические нейроны синтезируют, хранят и высвобождают нейротрансмиттер ACh. Основными рецепторами, которые преобразуют сообщения ACh, являются холинергические мускариновые рецепторы ацетилхолина, нейрональные и мышечные nAChR. Оглядываясь назад на историю эволюции, можно сказать, что ACh считается самой старой молекулой-передатчиком и появился раньше нервной клетки. В нервной системе холинергическая стимуляция, опосредованная nAChR, контролирует такие пути, как высвобождение передатчиков и чувствительность клеток, которые могут влиять на физиологическую активность, включая сон, тревогу, обработку боли и когнитивные функции.
nAChR - это холинергические рецепторы, обнаруженные в центральной нервной системе (ЦНС), периферической нервной системе (ПНС) и скелетных мышцах, эти рецепторы представляют собой ионные каналы, управляемые лигандами, с сайтами связывания для ацетилхолина и других молекул. Когда ACh или другие агонисты связываются с рецепторами, он стабилизирует открытое состояние ионного канала, обеспечивая приток катионов, таких как ионы калия, кальция и натрия. NAChR состоят из различных субъединиц, которые определяют четвертичную структуру рецептора, эти субъединицы представляют собой субъединицы α (α1-α10), субъединицы β (β1-β4), одну субъединицу δ, одну субъединицу γ и одна субъединица ε. nAChR могут быть гетеромерными или гомомерными. Гетеромерные рецепторы, обнаруженные в центральной нервной системе, состоят из двух субъединиц α и трех субъединиц β с сайтом связывания на границе α и соседней субъединицы. Эти рецепторы содержат по два сайта связывания на рецептор и обладают разным сродством к химическим веществам в зависимости от состава субъединиц. Оба сайта связывания работают вместе, и поэтому оба сайта должны быть заняты агонистом nAChR, чтобы могла происходить активация канала. Было показано, что nAChR, содержащие субъединицы α2-α6 и β2-β4, обладают более высоким сродством к ACh, чем другие рецепторы. Гомомерные рецепторы содержат 5 одинаковых субъединиц, они имеют 5 сайтов связывания, расположенных на границе раздела между двумя соседними субъединицами. В 2000 году у человека были идентифицированы два гомомерных рецептора, рецепторы α7 и α8.
На гетеромерных nAChR есть два сайта связывания; чтобы стабилизировать открытую форму nAChR, оба сайта связывания должны быть заняты агонистами, такими как никотин или ACh.. Сайт связывания ACh nAChR состоит из шести петель, называемых A-F. Петли A, B и C сайта связывания являются частью субъединицы α и являются основными компонентами сайта связывания. Соседняя субъединица к субъединице α (γ, δ, ε или β) содержит петли D, E и F.
 Два разных подтипа никотиновых ацетилхолиновых рецепторов
Два разных подтипа никотиновых ацетилхолиновых рецепторов нАХР α4β2 содержат две субъединицы α4 и три субъединицы β2, поэтому он имеет два сайта связывания для ACh и других агонистов. α4β2 nAChR составляют примерно 90% nAChR в головном мозге человека, и при хроническом воздействии никотина или других агонистов никотина приводит к увеличению плотности α4β2 рецепторов, что противоположно тому, что обычно происходит, когда другие рецепторы хронически подвергаются воздействию своих агонистов. Рецептор α4β2 широко изучался в отношении болезни Альцгеймера, а также никотиновой зависимости, и в 2009 году на рынке появилось несколько препаратов, которые нацелены конкретно на α4β2 nAChR.
α7 рецепторы представляют собой гомомерные нейрональные рецепторы ацетилхолина, состоящие из пяти субъединиц α7 и имеющие пять участков связывания ACh. Сообщалось, что нарушение экспрессии рецепторов α7 влияет на прогрессирование таких заболеваний, как болезнь Альцгеймера и шизофрения. Считается, что α7 не имеет такого же сродства к никотину, как гетеромерный рецептор, но вместо этого они показали большее сродство к альфа-бунгаротоксину, который является антагонистом никотина, обнаруженным в яде некоторых змей. Таким образом, нацеливание на рецепторы α7 считается полезным при лечении болезни Альцгеймера и шизофрении.
nAChR обнаружены в нервно-мышечном соединении скелетных мышц.. Были обнаружены два разных рецептора, один из которых в основном был обнаружен у взрослых и содержит две субъединицы α1, одну β1, одну ε и одну δ, а другой был обнаружен у плодов и содержит субъединицу γ вместо субъединицы ε. NAChR принимают участие в деполяризации мышечной замыкательной пластинки, увеличивая катионную проницаемость, что приводит к сокращению скелетных мышц. NAChRs, обнаруженные в системе скелетных мышц, имеют два сайта связывания ACh, один из которых находится на границе между субъединицами α1 и δ, а другой - на границе между субъединицами α1 и γ или ε. К антагонистам nAChR, разработанным специально для нервно-мышечной системы, относятся нервно-паралитические газы и другие яды, предназначенные для быстрого уничтожения людей или других животных и насекомых.
ACh связывается с nAChR из-за разницы зарядов между молекулами и поверхность рецептора. При связывании с nAChR ACh попадает в карман связывания, образованный петлями A, B и C, которые принадлежат субъединице α и соседней субъединице. Когда ACh помещается в связывающий карман, петли nAChR претерпевают движение, которое приводит к координации молекулы ACh в кармане, усиливая химические связи между молекулой и рецептором. После перемещения петель, принадлежащих субъединице α, молекула ACh иногда может образовать связь, например солевой мостик с соседней субъединицей, еще больше усиливая связи между рецептором и ACh.
Лекарства, влияющие на nAChR, могут быть агонистами, частичными агонистами или антагонистами. Агонисты, например никотин, однако, может действовать как деполяризующие агенты при контакте с nAChR в течение некоторого времени (секунды или минуты, в зависимости от концентрации и подтипа nAChR), хроническое воздействие агониста также может привести к длительной функциональной дезактивации из-за быстрой и стойкой десенсибилизации. Частичные агонисты nAChR изучались, так как они кажутся полезными при отказе от курения. Считается, что частичные агонисты связываются с nAChR и стимулируют высвобождение дофамина меньшими порциями, чем агонисты, и, следовательно, компенсируют отсутствие никотина.. Отсутствие специфичности среди некоторых никотиновых агонистов. хорошо известен и представляет собой потенциальную проблему при их использовании для лечения заболеваний, требующих нацеливания на определенный подтип nAChR. К этим неспецифическим агонистам относятся, например, ACh, никотин и эпибатидин, которые нацелены на более чем один подтип nAChR.
 Химическая структура никотина
Химическая структура никотина Развитие агониста nAChR Фармакофор начался в 1970 году, когда было предположено, что связывание агонистов с рецептором зависит от положительно заряженного атома азота и водородной связи, образующейся из карбонильного атома кислорода в ацетилхолине или атома азота в (S) -никотин. С тех пор было показано, что катионный центр, атомы, которые являются электроотрицательными и способны образовывать водородные связи вместе с центром пиридинового кольца в (S) -никотине, являются благоприятными. Стереохимия является частью фармакофора, что ясно видно на (S) - и (R) - никотине, где (S) - энантиомер в 10-100 раз сильнее. Азабициклическое кольцо эпибатидина - еще один пример благоприятных стерических взаимодействий с рецепторами. Было высказано предположение, что определенное расстояние между азотом, N-N, важно для сродства к агонистам, но возникли дискуссии по поводу его влияния. Более новая теория гласит, что расстояние 7-8 Å между точками, которые дополняют протонированный атом азота и акцептор водородной связи, повысит эффективность. Низкая электронная плотность вблизи протонированного азота и более высокая электронная плотность вблизи пиридинового кольца предпочтительны в протонированных никотиновых лигандах, содержащих пиридиновое кольцо. В последующие годы исследователи стали проявлять больший интерес к рецепторам подтипа α7 и α4β2 при разработке лекарств для лечения никотиновой зависимости и когнитивных нарушений, таких как болезнь Альцгеймера.
Были запущены различные модели, на которых тестируется сродство агонистов nAChR к подтипу рецептора, чтобы помочь идентифицировать молекулы, группы и стерическую конформацию, которые жизненно важны для большей аффинности. Используя модель мышечного рецептора nAChR (α1) 2 β1δγ, были получены следующие результаты:
, где анатоксин имел самую высокую эффективность активности, а тубокурар - самую низкую. С другой стороны, ацетилхолин вызывает гораздо более длительное время открытия рецептора, хотя анатоксин более эффективен. Результаты показывают, что производные анатоксина могут быть полезны для понимания взаимосвязи структура-активность (SAR) для мышечных nAChR.
Сукцинилхолин хлорид, препарат, который уже представлен на рынке, представляет собой сложный эфир бихолина и мышечный препарат короткого действия. релаксант. Сложные эфиры бишолина представляют собой соединения, которые могут действовать как конкурентные агонисты нАХР мышечного типа и использовались в исследованиях SAR. На модели nAChR Torpedo (α1) 2 β1δγ было продемонстрировано, что эффективность агонистов сложного эфира бихолина зависит от длины цепи, поскольку эффективность увеличивается с увеличением длины цепи. Эффективность, по-видимому, не зависит от длины цепи, поскольку наивысшая эффективность наблюдается у сложных эфиров бихолина с 4-7 CH. 2единицами и ниже как для меньшего количества единиц CH. 2, так и для большего количества.
 Пиридиновые производные циклопропана
Пиридиновые производные циклопропана Комбинация структурных элементов ACh и никотина, а также снижение конформационной гибкости за счет использования циклопропанового кольца привели к открытию сильных и селективных лигандов α4β2 nAChR. Модуляция трех структурных элементов, линкера, замещения в аминогруппе и пиридиновом кольце может использоваться для определения влияния на эффективность и селективность лигандов. Факторы, уменьшающие связывание, представляют собой стерические препятствия для аминогруппы и линкеров, которые представляют собой насыщенные / ненасыщенные углеродные цепи. Предпочтительны простые эфирные линкеры с короткой цепью. Благоприятное влияние на связывание наблюдается при замене пиридинового кольца как моно-, так и дизамещения галогенами среди других групп. Замена аминогруппы тремя разными амидами увеличивала аффинность связывания там, где метиламид имел самое высокое связывание. Более низкое связывание в других замещенных амидах объясняется стерическими затруднениями или отсутствием метильной группы, что приводит к потере гидрофобного взаимодействия. Стереохимия пиридинового азота и / или пиридинового кольца и его стереоэлектронные эффекты оказывают незначительное положительное влияние на связывание с α4β2 nAChR. Таким образом, было показано, что лиганд простого пиридилового эфира с бромзамещением в пиридине и метилатедамидом в аминогруппе имел самую высокую эффективность.
 SEN12333 / WAY-317538
SEN12333 / WAY-317538 Поиск селективных и сильных агонистов α7 nAChR дал ряд соединений, которые имеют хороший потенциал в качестве кандидатов в лекарственные средства. В ходе одного из таких поисков был получен SEN12333 / WAY-317538 среди других соединений, которые имеют желаемые фармакокинетические профили и являются селективными в отношении нАХР α7 по сравнению с нАХР α1, α3 и α4β2. Было предложено соотношение структурной активности для этих соединений. Оптимальный фармакофор агониста α7 nAChR состоит из трех частей. Существует основная группа, связанная с углеродной цепью, связанная с ароматической группой амидным мостиком. Амидный мостик можно инвертировать, не влияя на эффективность агониста. Би арильная группа проявляет большую активность, чем моноарильная группа, поскольку ароматический фрагмент и замещение в положении 2 на более поздней арильной группе дополнительно увеличивают эффективность. Эффективность выше для агонистов с донором / акцептором H на более поздней арильной группе на биарильной группе. Большое количество акцепторов водородной связи может снизить проницаемость через гематоэнцефалический барьер (BBB) из-за полярной площади поверхности, и это необходимо учитывать при разработке агонистов для нацеливания на α7 nAChRs.
Различные циклические аминные группы могут действовать как основная составляющая, и активность остается относительно неизменной, например, арил пиперазин, пиперидин и морфолин. Ациклический третичный амин допустим в качестве основного фрагмента, но более крупные стерические группы менее переносятся.
Многие производные хинуклидина, такие как хинуклидин амид, известны как агонисты α7 nAChR. Исследования SAR для хинуклидин амида выявили факторы, которые влияют на эффективность и сродство этих агонистов. Пара-замещение в хинуклидиновом кольце и 3- (R) конфигурации в стереохимии является предпочтительным. Повышенная активность наблюдается, когда 5-членное кольцо сливается с ароматическим фрагментом. Дальнейшее усиление наблюдается, когда конденсированное кольцо способно обеспечить электронный резонанс для амидного карбонила, тогда как активность будет уменьшаться, когда конденсированное кольцо содержит атом, отдающий водородную связь. Считается, что жесткость хинуклидина и ортогональная ориентация азотного мостика по отношению к карбонильной группе амида важны для оптимального связывания. Стабильность некоторых из наиболее сильнодействующих производных хинуклидинамида в моделях in vitro на крысах была низкой, однако при добавлении метильной группы в положение 2 хинуклидинового кольца стабильность значительно увеличилась.
Разработка агонистов никотиновых рецепторов ацетилхолина началась в начале 1990-х годов после открытия положительного воздействия никотина на память животных. С тех пор разработка агонистов никотиновых рецепторов ацетилхолина прошла долгий путь. Агонисты никотиновых рецепторов ацетилхолина привлекают все большее внимание в качестве кандидатов в лекарственные средства при множественных расстройствах центральной нервной системы, таких как болезнь Альцгеймера, шизофрения, синдром дефицита внимания с гиперактивностью (СДВГ) и никотиновая зависимость. Никотиновые рецепторы ацетилхолина представляют собой рецепторы, обнаруженные в центральной нервной системе, периферической нервной системе и скелетных мышцах. Это лиганд-зависимые ионные каналы с сайтами связывания для ацетилхолина, а также других агонистов. Когда агонисты связываются с рецептором, это стабилизирует открытое состояние ионного канала, обеспечивая приток катионов.
. В 2009 году на рынке было по крайней мере пять лекарств, влияющих на никотиновые рецепторы ацетилхолина.
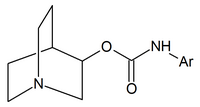 |  | 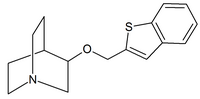 |
| карбаматы хинуклидина | амиды хинуклидина | эфиры хинуклидина |
| Активный ингредиент | Название продукта | Химическое название | Фармацевтическая форма | Фармакодинамические свойства | Терапевтическое использование | Структура |
|---|---|---|---|---|---|---|
| Варениклина тартрат | Champix, Chantix | 7,8,9,10-тетрагидро-6,10-метано-6H-пиразино [2,3-h] [3] бензазепин | Таблетка с пленочным покрытием | Частичный агонист никотиновый ацетилхолиновый рецептор, подтип α 4β2 | Лечение табачной зависимости |  |
| Галантамин гидробромид | Реминил, Нивалин, Разадин и Разадин ER | 4a, 5,9,10,11,12-гексагидро- 3-метокси-11-метил-6H-бензофуро [3a, 3,2-ef] [2] -бензазепин-6-ол | Капсула с замедленным высвобождением, таблетка с пленочным покрытием, раствор для перорального применения | Ингибитор холинэстеразы и неконкурентный агонист никотинового ацетилхолинового рецептора | Лечение деменции, вызванной болезнью Альцгеймера болезнь | 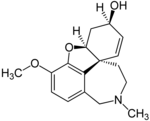 |
| Никотин | Никоретт, Никотинелл, Никвитин, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3 - [(2S) -1-метилпирролидин-2-ил ] пиридин | Трансдермальный пластырь, жевательная резинка, ингалятор, назальный спрей, лепешка, микротаблетка и в природе содержится в табаке | Агонист никотиновых рецепторов, как ганглиозного типа, так и α4β2 | Лечение табачной зависимости | 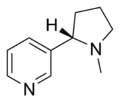 |
| Карбахол | Миостат | 2 - [(аминокарбонил) окси] -N, N, N-триметилэтанаминий | Внутриглазный раствор | Холинергический агонист | Лечение глаукомы | 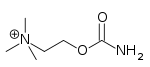 |
| Суксаметония хлорид (сукцинилхолинхлорид) | Анектин, келицин суксаметоний хлорид | 2,2 '- [(1, 4-диоксобутан-1,4-диил) бис (окси)] бис (N, N, N-триметилэтанаминий) | Внутривенная или внутримышечная инъекция | Деполяризующий нервно-мышечный блокирующий агент | Миорелаксант короткого действия | |
| Эпибатидин | Не указан | 2- (6-хлорпиридин-3-ил) -7-азабицикло [2.2. 1] гептан | Не указан | Агонист никотинового ацетилхолинового рецептора | Не используется в качестве лекарственного средства | 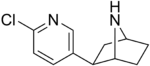 |
Другие никотиновые агонисты, хотя, как правило, с ограниченным клиническим применением, включают:
| Сравнение холинэргических агонистов | ||||
|---|---|---|---|---|
| Вещество | Рецепторная специфичность | Гидролиз. ацетилхолинэстеразой | Комментарии | |
| Мускариновое | Никотиновое | |||
| Холин | +++ | +++ | ++ | Основные питательные вещества |
| Ацетилхолин | +++ | +++ | +++ | Эндогенный лиганд |
| Карбахол | ++ | +++ | - | Используется для лечения глаукомы |
| Метахолин | +++ | + | ++ | |
| Бетанехол | +++ | - | - | Использование d в мочевом пузыре и. желудочно-кишечной гипотонии. |
| Мускарин | +++ | - | - | Природный алкалоид, содержащийся в некоторых грибах. Причина отравления грибами |
| Никотин | - | +++ | - | Природный алкалоид, обнаруженный в табаке. |
| Пилокарпин | ++ | - | - | Используется при глаукоме |
| Оксотреморин | ++ | - | - | |
В настоящее время исследования агонистов никотиновых рецепторов и разработка лекарств направлены на лечение множества заболеваний и расстройств ЦНС.
Таргацепт имеет три препарата-кандидата, которые проходят клинические испытания ; AZD3480 (TC-1734) для лечения СДВГ, который в настоящее время проходит фазу II клинических испытаний, AZD1446 (TC-6683) для лечения болезни Альцгеймера в сотрудничестве с AstraZeneca и TC-5619 для когнитивные дисфункции при шизофрении.
Memory Pharmaceuticals со своим партнером Roche имеет один кандидат в лекарство, MEM 3454 (RG3487), частичный агонист никотинового рецептора α7, от болезни Альцгеймера.
Лаборатории Abbott в партнерстве с NeuroSearch проводят клинические испытания двух лекарственных препаратов-кандидатов: селективного агониста α4β2-никотиновых рецепторов для лечения СДВГ и модулятора нейронных никотиновых рецепторов, который был выбран Abbott в 2006 году в качестве нового кандидата на разработку для лечения когнитивных дисфункций
EnVivo Pharmaceuticals имеет один кандидат на лекарство, участвующий в клинических испытаниях, EVP-6124, селективный агонист α7-никотинового рецептора при болезни Альцгеймера и шизофрении, и одно соединение для последующего наблюдения, EVP-4473, которое успешно завершено доклиническая разработка.
![]() Медиа связаны с агонистами никотина на Wikimedia Commons
Медиа связаны с агонистами никотина на Wikimedia Commons