Специфический белок 65 кДа для пигментного эпителия сетчатки,, также известный как изомерогидролаза ретиноида, является ферментом зрительного цикла позвоночных который кодируется у человека геном RPE65 . RPE65 экспрессируется в пигментном эпителии сетчатки (RPE, слой эпителиальных клеток, которые питают фоторецепторные клетки ) и отвечает за преобразование полностью транс- ретиниловых эфиров в 11-цис- ретинол во время фототрансдукции. Затем 11-цис-ретинол используют для регенерации зрительного пигмента в фоторецепторных клетках. RPE65 принадлежит к семейству ферментов каротиноидоксигеназы.
RPE65 является критическим ферментом в зрительном цикле позвоночных, обнаруженном в пигментированном эпителии сетчатки. Он также встречается в стержнях и конусах. Фотоизомеризация 11-цис-ретиналя в полностью транс-ретиналь инициирует путь фототрансдукции, по которому мозг обнаруживает свет. Полностью транс-ретинол не является фотоактивным и поэтому должен быть повторно преобразован в 11-цис-ретиналь, прежде чем он сможет рекомбинировать с опсином для образования активного зрительного пигмента. RPE65 обращает фотоизомеризацию, превращая полностью транс-ретиниловый эфир в 11-цис-ретинол. Чаще всего сложноэфирным субстратом является ретинилпальмитат. Другие ферменты зрительного цикла завершают реакции, необходимые для окисления и этерификации всего транс-ретинола до ретинилового эфира (субстрат RPE65) и для окисления 11-цис-ретинола до 11-цис-ретиналя (необходимого фотоактивного компонента зрительного пигмента)..
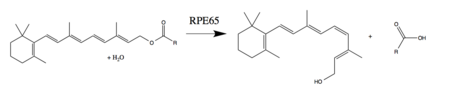 Реакция завершается RPE65 в ретиноидном цикле.
Реакция завершается RPE65 в ретиноидном цикле. RPE65 также называют ретинолизомеразой или ретиноидизомеразой из-за прошлых дебатов о субстрате фермента и о том, участвует ли он в гидролиз сложного эфира.
RPE65 представляет собой димер двух симметричных, ферментативно независимых субъединиц. Активный сайт каждой субъединицы имеет структуру с семью лопастями бета-пропеллером с четырьмя гистидинами, которые содержат кофактор железа (II) . Этот структурный мотив является общим для исследованных членов семейства ферментов каротиноидоксигеназы. RPE65 прочно связан с мембраной гладкой эндоплазматической сети в клетках RPE.
Активный сайт каждого активного сайта RPE65 содержит Fe (II) кофактор, связанный четырьмя гистидинами (His, His, His и His), каждый из которых вносится отдельной лопастью в структуре бета-пропеллера. Три из четырех гистидинов координированы с близлежащими остатками глутаминовой кислоты (Glu, Glu и Glu), которые, как считается, помогают позиционировать гистидины для связывания кофактора железа в октаэдрическая геометрия. Phe, Thr и Glu окружают активный центр, где они помогают стабилизировать промежуточный карбокатион и увеличивают стереоселективность RPE65 для 11-цис-ретинола по сравнению с 13-цис-ретинолом.
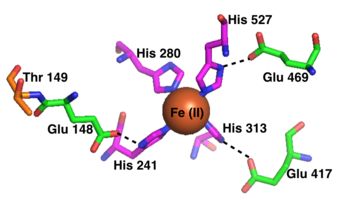 Кофактор железа (II) RPE65, демонстрируя его координацию с 4 остатками гистидина и 3 остатками глутаминовой кислоты.
Кофактор железа (II) RPE65, демонстрируя его координацию с 4 остатками гистидина и 3 остатками глутаминовой кислоты. Реагенты и продукты, вероятно, проникают и покидают активный центр через гидрофобный туннель, который, как считается, открывается в липидную мембрану для прямого всасывания липидного субстрата. Второй туннель меньшего размера также достигает активного центра и может служить в качестве пути для воды, но он слишком узок для транспортировки ретиноидных реагентов и продуктов.
RPE65 прочно связан с мембрана sER. sER аномально много в клетках RPE из-за их роли в процессинге липидных ретиноидов. Структурные исследования показывают, что RPE65 частично встроен в мембрану sER через взаимодействия между его гидрофобной поверхностью и внутренней частью липидной мембраны. Это подтверждается необходимостью использования детергента для растворения RPE65. Основная часть гидрофобной поверхности RPE65, остатки 109–126, образует амфипатическую альфа-спираль, которая, вероятно, способствует сродству белка к мембране. Кроме того, Cys пальмитоилирован в нативном RPE65, что дополнительно подтверждает теорию о том, что гидрофобная поверхность RPE65 встроена в мембрану.
Гидрофобная поверхность содержит вход в большой туннель, который ведет к активный сайт фермента. Наличие этого канала на гидрофобной поверхности в сочетании с продемонстрированной способностью RPE65 поглощать направление субстрата из липидного бислоя согласуется с тем, что RPE65 частично встроен в мембрану.
RPE65 был изолирован от широкого круга позвоночных, включая рыб-зебр, кур, мышей, лягушек и людей. Его структура высоко консервативна между видами, особенно в бета-пропеллерах и, вероятно, мембраносвязанных областях. Аминокислотные последовательности RPE65 человека и крупного рогатого скота отличаются менее чем на 1%. Остатки гистидина бета-пропеллерной структуры и связанный кофактор железа (II) на 100% консервативны в изученных ортологах RPE65 и других представителях семейства каротиноидоксигеназ.
Ранее предполагалось, что RPE65 существует в двух взаимопревращенных формах: мембраносвязанный mRPE65 и растворимый sRPE65. Эта теория предполагает, что обратимое превращение sRPE65 в mRPE65 посредством пальмитоилирования по Cys, Cys и Cys играет роль в регуляции ретиноидного цикла и наделении mRPE65 его сродством к мембране. Однако кристаллографические исследования RPE65 показали, что эти остатки не являются пальмитоилированными и не обращены к поверхности. Новые исследования также не смогли подтвердить наличие большого количества растворимого RPE65. Таким образом, от этой теории в значительной степени отказались.
 Предлагаемый механизм расщепления O-алкила RPE65. Показаны остатки по часовой стрелке от верхнего левого угла - Phe, Thr, His, His, His, His и Glu.
Предлагаемый механизм расщепления O-алкила RPE65. Показаны остатки по часовой стрелке от верхнего левого угла - Phe, Thr, His, His, His, His и Glu. RPE65 катализирует превращение полностью транс-ретинилового эфира в 11-цис-ретинол посредством предлагаемого SN1 Разрыв связи O-алкил. Комбинация RPE65, включающая расщепление O-алкилового эфира, геометрическую изомеризацию и добавление воды, в настоящее время считается уникальной в биологии. Однако реакции расщепления O-алкилового сложного эфира с аналогично стабилизированными интермедиатами карбокатиона используются химиками-органиками.
O-алкильное расщепление сложноэфирной связи при помощи Fe ( II) кофактор, создает промежуточный карбокатион, который стабилизируется сопряженной полиеновой цепью. Делокализация карбокатиона снижает порядок связи полиеновой цепи, тем самым уменьшая энергию активации транс-цис-изомеризации. Phe и Thr дополнительно стабилизируют изомеризованный карбокатион и, как полагают, ответственны за стереоселективность фермента. После изомеризации нуклеофильная атака водой на C15 восстанавливает конъюгацию полиеновой цепи и завершает разрыв сложноэфирной связи.
Практически все другие биохимические реакции гидролиза сложного эфира протекают через SN2-реакцию на ацильном углероде. Однако исследования изотопного мечения продемонстрировали, что кислород в конечном 11-цис-ретинольном продукте RPE65 происходит из растворителя, а не из реагирующего сложного эфира, что подтверждает механизм расщепления O-алкила. Кроме того, механизм реакции гидролиза сложного эфира S N 2 будет основываться на отдельной, неблагоприятной атаке S N 2 на электронно-богатый C11 некоторым нуклеофилом - скорее всего, остаток цистина - для завершения изомеризационной части реакции. Мало того, что нуклеофильная атака алкена энергетически невыгодна, но и в области активного сайта отсутствуют остатки цистина, которые могли бы действовать как нуклеофил.
Мутации в этом гене были связаны с врожденным амаврозом Лебера тип 2 (LCA2) и пигментным ретинитом (RP). Мутации RPE65 являются наиболее часто обнаруживаемыми мутациями у пациентов с LCA в Дании. Подавляющее большинство мутаций RPE65 у пациентов с LCA2 и RP происходит в режиме бета-пропеллера и, как полагают, ингибирует правильную укладку белка и связывание кофактора железа. Наиболее частыми сайтами мутации пропеллеров являются Tyr и His. Замена в Arg также является обычным явлением и, как было показано, влияет на мембранные взаимодействия RPE65 и захват субстрата.
Хотя полная потеря функции связана с такими заболеваниями, как LCA и RP, частичное ингибирование RPE65 было предложено в качестве лечения для возрастной дегенерации желтого пятна (AMD). Было показано, что полностью транс-ретиниламин (Ret-NH2) и эмиксустат конкурентно ингибируют RPE65. Эмиксустат в настоящее время проходит FDA фазу 3 клинических испытаний в качестве терапии AMD.
Джин Беннет и Кэтрин А. Хай работают с мутация RPE65 обратила вспять унаследованную форму слепоты. Они получили первое одобрение FDA на генную терапию генетического заболевания. По этой причине в 2018 году они были названы одним из трех финалистов присужденной Sanford Health премии Lorraine Cross Award в размере 1 млн долларов за инновации в науке и медицине.