 Сложный эфир карбоксилата. R 'обозначает любую алкильную или арильную группу.
Сложный эфир карбоксилата. R 'обозначает любую алкильную или арильную группу. В химии, сложный эфир представляет собой химическое соединение производное от кислоты (органической или неорганической), в которой по крайней мере одна -OH (гидроксильная ) группа заменена на -O- алкил (алкокси ) группа. Обычно сложные эфиры получают в результате реакции замещения карбоновой кислоты и спирта. Глицериды, которые представляют собой сложные эфиры жирных кислот и глицерин, являются важными сложными эфирами в биологии, являясь одним из основных классов липидов, и составляющие основную массу животных жиров и растительных масел. Сложные эфиры с низкой молекулярной массой обычно используются в качестве ароматизаторов и содержатся в эфирных маслах и феромонах. Фосфоэфиры образуют основу молекул ДНК. Сложные эфиры нитратов, такие как нитроглицерин, известны своими взрывоопасными свойствами, в то время как сложные полиэфиры важны пластмассы, содержащие мономеры, связанных сложноэфирными фрагментами. Сложные эфиры обычно имеют сладкий запах и считаются высококачественными растворителями для широкого спектра пластмасс, пластификаторов, смол и лаков. Они также являются одним из крупнейших классов синтетических смазочных материалов на коммерческом рынке.
Слово эфир было придумано в 1848 году немецким химиком Леопольдом Гмелином, вероятно, как сокращение от немецкого Essigäther, "уксусный эфир ".
Названия сложных эфиров образованы от исходного спирта и исходной кислоты, причем последние могут быть органическими или неорганическими. Сложные эфиры, полученные из простейших карбоновых кислот, обычно называют в соответствии с более традиционными, так называемыми «тривиальными названиями », например как формиат, ацетат, пропионат и бутират, в отличие от метаноата, этаноата, пропаноата и бутаноата номенклатуры IUPAC. С другой стороны, сложные эфиры, полученные из более сложных карбоновых кислот, чаще называют с использованием систематического названия IUPAC, основанного на названии кислоты, за которым следует суффикс -oate. Например, гексилоктаноат сложного эфира, также известный под тривиальным названием гексил каприлат, имеет формулу CH 3 (CH 2)6CO2(CH 2)5CH3.
 Этилацетат, полученный из спирта (синий) и ацил (желтый), полученный из карбоновой кислоты
Этилацетат, полученный из спирта (синий) и ацил (желтый), полученный из карбоновой кислоты . Химические формулы сложных органических эфиров обычно имеют вид RCO 2 R ', где R и R' представляют собой углеводородные части карбоновой кислоты и спирта, соответственно. Например, бутилацетат (систематически бутилэтаноат), полученный из бутанола и уксусной кислоты ( систематически этановая кислота) будет записано как CH 3CO2C4H9. Альтернативные представления являются обычными, включая BuOAc и CH 3 COOC 4H9.
Циклические эфиры называются лактонами, независимо от того, получены ли они из органическая или неорганическая кислота. Одним из примеров органического лактона является γ-валеролактон.
Необычным классом органических сложных эфиров являются ортоэфиры, которые имеют формулу RC (OR ′) 3. Trie тилортоформиат (HC (OC 2H5)3) является производным, исходя из его названия (но не его синтеза) из ортоформиновой кислоты (HC (OH) 3) и этанол.
 Сложный эфир фосфорной кислоты
Сложный эфир фосфорной кислоты Сложные эфиры также могут быть производными неорганических кислот.
Неорганические кислоты, которые существуют в виде таутомеров, образуют различные сложные эфиры
Неорганические кислоты, которые являются нестабильными или трудноуловимыми, образуют стабильные сложные эфиры.
В принципе, все металлы и металлоиды алкоксиды, из которых известны многие сотни, можно классифицировать как сложные эфиры гипотетических кислот.
Сложные эфиры содержат карбонил центр, который дает углы 120 ° C – C – O и O – C – O. В отличие от амидов, сложные эфиры являются структурно гибкими функциональными группами, поскольку вращение вокруг связей C – O – C имеет низкий барьер. Их гибкость и низкая полярность проявляются в их физических свойствах; они, как правило, менее жесткие (более низкая точка плавления) и более летучие (более низкая температура кипения), чем соответствующие амиды. pKa альфа -водорода на сложных эфирах составляет около 25.
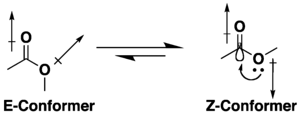
Многие сложные эфиры имеют потенциал для конформационной изомерии, но они имеют тенденцию принимать конформацию s-цис (или Z), а не альтернативу s-транс (или E), из-за комбинации гиперконъюгации и дипольная минимизация эффектов. На предпочтение Z-конформации влияет природа заместителей и растворителя, если он присутствует. Лактоны с небольшими кольцами ограничиваются s-транс (то есть E) конформацией из-за их циклической структуры.
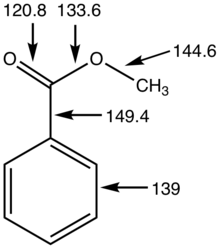 Метрические детали для метилбензоата, расстояния в пикометрах.
Метрические детали для метилбензоата, расстояния в пикометрах. Сложные эфиры более полярны, чем простые эфиры, но менее полярны, чем спирты. Они участвуют в водородных связях как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от их родительских спиртов. Эта способность участвовать в водородных связях придает некоторую растворимость в воде. Из-за отсутствия способности отдавать водородные связи сложные эфиры не самоассоцируются. Следовательно, сложные эфиры более летучие, чем карбоновые кислоты с аналогичной молекулярной массой.
Сложные эфиры обычно идентифицируются с помощью газовой хроматографии с учетом их летучести. ИК-спектры сложных эфиров показывают интенсивную резкую полосу в диапазоне 1730–1750 см, относящуюся к ν C = O. Этот пик изменяется в зависимости от функциональных групп, присоединенных к карбонилу. Например, бензольное кольцо или двойная связь в сочетании с карбонилом уменьшит волновое число примерно на 30 см.
Сложные эфиры широко распространены по природе и широко используются в промышленности. В природе жиры, как правило, представляют собой триэфиры, полученные из глицерина и жирных кислот. Сложные эфиры отвечают за аромат многих фруктов, в том числе яблок, дурианов, груш, бананов, ананасов, и клубника. Ежегодно промышленным способом производится несколько миллиардов килограммов полиэфиров, важными продуктами являются полиэтилентерефталат, сложные эфиры акрилата и ацетат целлюлозы.
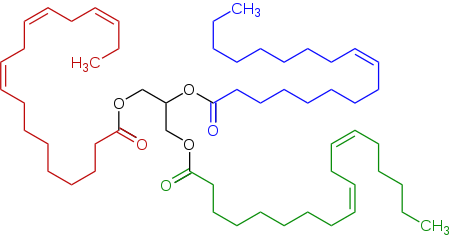 Типичный триглицерид, содержащийся в льняном масле, триэфир (триглицерид ), производный линолевой кислоты, альфа-линоленовой кислоты и олеиновой кислоты.
Типичный триглицерид, содержащийся в льняном масле, триэфир (триглицерид ), производный линолевой кислоты, альфа-линоленовой кислоты и олеиновой кислоты.Этерификация - это общее название химической реакции, в которой два реагента (обычно спирт и кислота) образуют сложный эфир в качестве продукта реакции. Сложные эфиры распространены в органической химии и биологических материалах и часто имеют приятный характерный фруктовый запах. Это приводит к их широкому использованию в индустрии ароматизаторов и ароматизаторов. Сложноэфирные связи также встречаются во многих полимерах.
Классическим синтезом является этерификация Фишера, который включает обработку карбоновой кислоты спиртом в наличие агента дегидратации :
Константа равновесия для такого реакции составляет около 5 для типичных сложных эфиров, например этилацетата. В отсутствие катализатора реакция протекает медленно. Серная кислота является типичным катализатором этой реакции. Также используются многие другие кислоты, такие как полимерные сульфоновые кислоты. Поскольку этерификация в значительной степени обратима, выход сложного эфира можно повысить, используя принцип Ле Шателье :
Известны реагенты, которые вызывают дегидратацию смесей спиртов и карбоновых кислот. Одним из примеров является этерификация по Стеглиху, которая представляет собой способ образования сложных эфиров в мягких условиях. Этот метод популярен в синтезе пептидов, где субстраты чувствительны к суровым условиям, таким как высокая температура. DCC (дициклогексилкарбодиимид ) используется для активации карбоновой кислоты для дальнейшей реакции. 4-диметиламинопиридин (DMAP) используется в качестве катализатора переноса ацила .

Другим методом дегидратации смесей спиртов и карбоновых кислот является реакция Мицунобу :
Карбоновые кислоты могут быть этерифицированный с использованием диазометана :
Используя этот диазометан, смеси карбоновых кислот могут быть превращены в их метиловые эфиры почти количественные выходы, например, для анализа с помощью газовой хроматографии. Метод полезен в специализированных операциях органического синтеза, но считается слишком опасным и дорогим для крупномасштабных применений.
Карбоновые кислоты этерифицируются обработкой эпоксидами, давая β-гидроксиэфиры:
Эту реакцию используют при производстве смол винилэфирной смолы из акриловая кислота.
Спирты реагируют с ацилхлоридами и ангидридами кислот с образованием сложных эфиров:
Реакции необратимы, что упрощает работу. Поскольку ацилхлориды и ангидриды кислот также реагируют с водой, предпочтительны безводные условия. Аналогичное ацилирование аминов с образованием амидов менее чувствительно, потому что амины более сильные нуклеофилы и реагируют быстрее, чем вода. Этот метод используется только для лабораторных процедур, так как он дорогостоящий.
Хотя соли карбоксилат-анионов широко не используются для этерификации, они могут быть алкилирующим агентом с алкилгалогенидами с образованием сложных эфиров. В случае использования алкилхлорида йодидная соль может катализировать реакцию (реакция Финкельштейна ). Карбоксилатная соль часто образуется in situ. В сложных случаях можно использовать карбоксилат серебра, поскольку ион серебра координируется с галогенидом, способствуя его уходу и улучшая скорость реакции. Эта реакция может иметь проблемы с доступностью анионов и, следовательно, может быть выиграна от добавления катализаторов межфазного переноса или высокополярных апротонных растворителей, таких как ДМФ.
Переэтерификация, которая включает замену одного сложного эфира на другой, широко практикуется:
Подобно гидролизу, переэтерификация катализируется кислотами и основаниями. Реакция широко используется для разложения триглицеридов, например при производстве сложных эфиров жирных кислот и спиртов. Поли (этилентерефталат) получают переэтерификацией диметилтерефталата и этиленгликоля:
Подмножеством переэтерификации является алкоголиз дикетена. Эта реакция дает 2-кетоэфиры.
Алкены подвергаются «гидроэтерификации » в присутствии катализаторов карбонила металла. Сложные эфиры пропионовой кислоты коммерчески производятся этим методом:
Препарат метилпропионата является одним из иллюстративных примеров.
Карбонилирование метанола дает метилформиат, который является основным коммерческим источником муравьиной кислоты. Реакция катализируется метоксидом натрия :
В присутствии катализаторы на основе палладия, этилен, уксусная кислота и кислород реагируют с образованием винилацетата :
Прямые маршруты к этому же сложному эфиру невозможны, поскольку виниловый спирт нестабилен.
Карбоновые кислоты также добавляются через алкины, давая те же продукты.
Кремневольфрамовая кислота используется для производства этилацетата путем алкилирования уксусной кислоты этиленом:
Реакция Тищенко включает диспропорционирование альдегида в присутствии безводного основания с образованием сложного эфира. Катализаторы представляют собой алкоксиды алюминия или алкоксиды натрия. Бензальдегид реагирует с бензилоксидом натрия (полученным из натрия и бензилового спирта ) с образованием бензилбензоата. Метод используется при производстве этилацетата из ацетальдегида.
Сложные эфиры реагируют с нуклеофилы у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов (аминов, алкоксидов, источников гидридов, литийорганических соединений и т. Д.). Связи С – Н, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород в сложных эфирах является слабоосновным, в меньшей степени, чем карбонильный кислород в амидах из-за резонансного донорства электронной пары из азота в амидах, но образует аддукты.
Этерификация обратимая реакция. Сложные эфиры подвергаются гидролизу в кислотных и основных условиях. В кислых условиях реакция является обратной реакцией этерификации Фишера. В основных условиях гидроксид действует как нуклеофил, а алкоксид представляет собой уходящую группу. Эта реакция, омыление, является основой мыловарения.

Алкоксидная группа также может быть замещена более сильными нуклеофилами, такими как аммиак или первичные или вторичные амины с образованием амидов : (реакция аммонолиза)
Эта реакция обычно не является обратимой. Вместо аминов можно использовать гидразины и гидроксиламин. Сложные эфиры могут быть преобразованы в изоцианаты через промежуточные гидроксамовые кислоты в перегруппировке Лоссена.
Источники углеродных нуклеофилов, например реактивы Гриньяра и литийорганические соединения, легко добавляется к карбонилу.
По сравнению с кетонами и альдегидами сложные эфиры относительно устойчивы к восстановлению. Введение каталитического гидрирования в начале 20 века было прорывом; сложные эфиры жирных кислот гидрируются до жирных спиртов.
Типичным катализатором является хромит меди. До разработки каталитического гидрирования сложные эфиры восстанавливали в большом масштабе с использованием восстановления Буво-Блана. В этом методе, который в значительной степени устарел, используется натрий в присутствии источников протонов.
Специально для тонкого химического синтеза алюмогидрид лития используется для восстановления сложных эфиров до двух первичных спиртов. Соответствующий реагент борогидрид натрия медленен в этой реакции. DIBAH восстанавливает сложные эфиры до альдегидов.
Прямое восстановление с образованием соответствующего простого эфира затруднено, поскольку промежуточное соединение полуацеталь имеет тенденцию разлагаться с образованием спирта. и альдегид (который быстро восстанавливается с образованием второго спирта). Реакция может быть осуществлена с использованием триэтилсилана с различными кислотами Льюиса.
Что касается альдегидов, атомы водорода на углероде, прилегающем («α к») карбоксильная группа в сложных эфирах, достаточно кислая, чтобы претерпевать депротонирование, что, в свою очередь, приводит к множеству полезных реакций. Для депротонирования требуются относительно сильные основания, такие как алкоксиды. Депротонирование дает нуклеофильный енолят, который может дополнительно реагировать, например, конденсация Клайзена и ее внутримолекулярный эквивалент, конденсация Дикмана. Это превращение используют в синтезе сложного эфира малоновой кислоты, где сложный диэфир малоновой кислоты взаимодействует с электрофилом (например, алкилгалогенидом ) и впоследствии декарбоксилируется. Другой вариант - алкилирование Фратера – Зеебаха.
Как класс, сложные эфиры служат в качестве защитных групп для карбоновых кислот. Защита карбоновой кислоты полезна при синтезе пептидов для предотвращения самореакций бифункциональных аминокислот. Метиловые и этиловые эфиры обычно доступны для многих аминокислот; трет-бутиловый эфир обычно бывает более дорогим. Однако трет-бутиловые эфиры особенно полезны, потому что в сильно кислых условиях трет-бутиловые эфиры подвергаются элиминированию с образованием карбоновой кислоты и изобутилена, что упрощает обработку.
Многие сложные эфиры имеют характерный фруктовый запах, и многие из них естественным образом присутствуют в эфирных маслах растений. Это также привело к их обычному использованию в искусственных ароматизаторах и ароматизаторах, имитирующих эти запахи.
| Викицитатник содержит цитаты, относящиеся к: Эфир |