 Молекулярная диффузия с микроскопической и макроскопической точки зрения. Изначально молекулы растворенных веществ находятся на левой стороне барьера (фиолетовая линия), а на правой - нет. Барьер удаляется, и растворенное вещество диффундирует, заполняя весь контейнер. Вверху: одна молекула движется случайным образом. В центре: при увеличении количества молекул наблюдается четкая тенденция к тому, что растворенное вещество заполняет контейнер все более и более равномерно. Внизу: с огромным количеством молекул растворенного вещества случайность становится необнаружимой: растворенное вещество, кажется, плавно и систематически перемещается из областей с высокой концентрацией в области с низкой концентрацией. Этот плавный поток описывается законами Фика.
Молекулярная диффузия с микроскопической и макроскопической точки зрения. Изначально молекулы растворенных веществ находятся на левой стороне барьера (фиолетовая линия), а на правой - нет. Барьер удаляется, и растворенное вещество диффундирует, заполняя весь контейнер. Вверху: одна молекула движется случайным образом. В центре: при увеличении количества молекул наблюдается четкая тенденция к тому, что растворенное вещество заполняет контейнер все более и более равномерно. Внизу: с огромным количеством молекул растворенного вещества случайность становится необнаружимой: растворенное вещество, кажется, плавно и систематически перемещается из областей с высокой концентрацией в области с низкой концентрацией. Этот плавный поток описывается законами Фика. Законы диффузии Фика описывает диффузию и были получены путем Адольфа Фика в 1855. Они могут быть использованы для решения для коэффициента диффузии, D. Первый закон Фика можно использовать для вывода его второго закона, который, в свою очередь, идентичен уравнению диффузии.
Процесс диффузии, подчиняющийся законам Фика, называется нормальной диффузией или диффузией Фика; в противном случае это называется аномальной диффузией или нефиковской диффузией.
В 1855 году физиолог Адольф Фик впервые сообщил о своих теперь хорошо известных законах, управляющих переносом массы посредством диффузии. Работа Фика была вдохновлена более ранними экспериментами Томаса Грэхема, в которых не были предложены фундаментальные законы, благодаря которым Фик стал известен. Закон Фика аналогичен отношениям, обнаруженным в ту же эпоху другими выдающимися учеными: закону Дарси (гидравлический поток), закону Ома (перенос заряда) и закону Фурье (перенос тепла).
Эксперименты Фика (по образцу Грэма) касались измерения концентраций и потоков соли, диффундирующей между двумя резервуарами через водяные трубки. Примечательно, что работа Фика в первую очередь касалась диффузии в жидкостях, потому что в то время диффузия в твердых телах не считалась вообще возможной. Сегодня законы Фика составляют основу нашего понимания диффузии в твердых телах, жидкостях и газах (при отсутствии движения объемной жидкости в последних двух случаях). Когда процесс диффузии не следует законам Фика (что происходит, среди прочего, в случаях диффузии через пористые среды и диффузии набухающих пенетрантов), это называется нефики.
Первый закон Фика связывает диффузный поток с градиентом концентрации. Он постулирует, что поток идет из областей с высокой концентрацией в области с низкой концентрацией, с величиной, которая пропорциональна градиенту концентрации (пространственная производная), или, упрощенно говоря, концепция, что растворенное вещество будет перемещаться из области высокой концентрации в область низкой концентрации через градиент концентрации. В одном (пространственном) измерении закон может быть записан в различных формах, где наиболее распространенная форма (см.) Находится в молярной основе:
куда
D пропорционален квадрату скорости диффундирующих частиц, который зависит от температуры, вязкости жидкости и размера частиц согласно соотношению Стокса – Эйнштейна. В разбавленных водных растворах коэффициенты диффузии большинства ионов близки и имеют значения, которые при комнатной температуре находятся в диапазоне(0.6-2) × 10 -9 м 2 / с. Для биологических молекул коэффициенты диффузии обычно находятся в диапазоне от 10 -11 до 10 -10 м 2 / с.
В двух или более измерениях мы должны использовать ∇, оператор del или градиента, который обобщает первую производную, получая
где J обозначает вектор диффузионного потока.
Движущей силой одномерной диффузии является величина - ∂ φ/∂ x, который для идеальных смесей является градиентом концентрации.
Другая форма первого закона - записать его с первичной переменной как массовая доля ( y i, например, в кг / кг), тогда уравнение изменится на:
куда
Обратите внимание, что это находится за пределами оператора градиента. Это потому что:
где ρ si - парциальная плотность i- го вида.
Помимо этого, в химических системах, отличных от идеальных растворов или смесей, движущей силой диффузии каждого вида является градиент химического потенциала этого вещества. Тогда первый закон Фика (одномерный случай) можно записать
куда
Движущая сила закона Фика может быть выражена как разница в летучести:
Fugacity имеет единицы Па. - парциальное давление компонента i в паровой или жидкой фазе. При парожидкостном равновесии поток испарения равен нулю, потому что.
Ниже приведены четыре варианта закона Фика для бинарных газовых смесей. Они предполагают: термодиффузия незначительна; сила тела на единицу массы одинакова для обоих видов; и либо давление постоянно, либо оба вещества имеют одинаковую молярную массу. В этих условиях Ref. подробно показано, как уравнение диффузии из кинетической теории газов сводится к этой версии закона Фика:
где V i - скорость диффузии компонента i. С точки зрения видового потока это
Если, кроме того, это сводится к наиболее распространенной форме закона Фика,
Если (вместо или в дополнение к) оба вида имеют одинаковую молярную массу, закон Фика принимает следующий вид:
где - мольная доля вида i.
Второй закон Фика предсказывает, как диффузия вызывает изменение концентрации во времени. Это уравнение в частных производных, которое в одном измерении гласит:
куда
В двух или более измерениях мы должны использовать лапласиан Δ = 2, который обобщает вторую производную, получая уравнение
Второй закон Фика имеет ту же математическую форму, что и уравнение тепла, и его фундаментальное решение такое же, как и ядро тепла, за исключением переключения теплопроводности с коэффициентом диффузии:
Второй закон Фика может быть выведен из первого закона Фика и сохранения массы в отсутствие каких-либо химических реакций:
Считая коэффициент диффузии D постоянным, можно поменять порядок дифференцирования и умножить на константу:
и, таким образом, получают форму уравнений Фика, как было указано выше.
Для случая диффузии в двух или более измерениях второй закон Фика принимает вид
которое аналогично уравнению теплопроводности.
Если коэффициент диффузии не является постоянным, а зависит от координаты или концентрации, второй закон Фика дает
Важным примером является случай, когда φ находится в установившемся состоянии, то есть концентрация не изменяется со временем, так что левая часть приведенного выше уравнения тождественно равна нулю. В одном измерении с постоянным D решением для концентрации будет линейное изменение концентраций вдоль x. В двух или более измерениях мы получаем
которое является уравнением Лапласа, решения которого математики называют гармоническими функциями.
Второй закон Фика - это частный случай уравнения конвекции-диффузии, в котором нет адвективного потока и нет чистого объемного источника. Его можно вывести из уравнения неразрывности :
где j - полный поток, а R - чистый объемный источник для φ. Предполагается, что единственным источником потока в этой ситуации является диффузионный поток:
Подставляя определение диффузионного потока к уравнению неразрывности и предполагая, что источника нет ( R = 0), мы приходим ко второму закону Фика:
Если бы поток был результатом как диффузионного, так и адвективного потоков, то результатом было бы уравнение конвекции-диффузии.
Простым случаем диффузии со временем t в одном измерении (взятом как ось x) от границы, расположенной в позиции x = 0, где концентрация поддерживается на значении n 0, является
где erfc - дополнительная функция ошибок. Это тот случай, когда коррозионные газы диффундируют через окислительный слой к поверхности металла (если предположить, что концентрация газов в окружающей среде постоянна, а диффузионное пространство, то есть слой продуктов коррозии, является полубесконечным, начиная с 0 на поверхности и бесконечно глубоко растекаясь в материале). Если, в свою очередь, диффузионное пространство бесконечно (продолжающееся как через слой с n ( x, 0) = 0, x gt; 0, так и через слой с n ( x, 0) = n 0, x ≤ 0), то решение вносится только с коэффициентом1/2перед n 0 (поскольку теперь диффузия происходит в обоих направлениях). Этот случай справедлив, когда некоторый раствор с концентрацией n 0 контактирует со слоем чистого растворителя. (Bokstein, 2005) Длина 2 √ Dt называется диффузионной длиной и дает меру того, насколько далеко концентрация распространилась в x- направлении за счет диффузии во времени t (Bird, 1976).
В качестве быстрого приближения функции ошибок можно использовать первые 2 члена ряда Тейлора:
Если D зависит от времени, длина диффузии становится
Эта идея полезна для оценки длины диффузии в цикле нагрева и охлаждения, где D изменяется в зависимости от температуры.
Другой простой случай диффузии - это броуновское движение одной частицы. Среднеквадратичное смещение частицы от ее исходного положения составляет:
где - размерность броуновского движения частицы. Например, диффузия молекулы через клеточную мембрану толщиной 8 нм представляет собой одномерную диффузию из-за сферической симметрии; Однако диффузия молекулы от мембраны к центру эукариотической клетки представляет собой трехмерную диффузию. Для цилиндрического кактуса диффузия от фотосинтетических клеток на его поверхности к его центру (оси его цилиндрической симметрии) является двумерной диффузией.
Квадратный корень из MSD,, часто используется как характеристика того, как далеко переместилась частица по истечении времени. МСД симметрично распределен в одномерном, двухмерном и трехмерном пространстве. Таким образом, распределение вероятностей величины MSD в 1D является гауссовым, а в 3D - распределением Максвелла-Больцмана.
В формулах Чепмена-Энскога для диффузии в газах включают в себя одни и те же сроки. Эти физические модели диффузии отличаются от тестовых моделей ∂ t φ i = Σ j D ij Δ φ j, которые действительны для очень малых отклонений от равномерного равновесия. Ранее такие члены были введены в уравнение диффузии Максвелла – Стефана.
Для анизотропных многокомпонентных коэффициентов диффузии необходим тензор четвертого ранга, например D ij, αβ, где i, j относятся к компонентам, а α, β = 1, 2, 3 соответствуют пространственным координатам.
Уравнения, основанные на законе Фика, обычно используются для моделирования процессов переноса в пищевых продуктах, нейронах, биополимерах, фармацевтических препаратах, пористых почвах, динамике популяций, ядерных материалах, физике плазмы и процессах легирования полупроводников. Теория вольтамперометрических методов основана на решениях уравнения Фика. С другой стороны, в некоторых случаях «фикианское» описание неадекватно. Например, в науке о полимерах и пищевых продуктах требуется более общий подход для описания переноса компонентов в материалах, претерпевающих стеклование. Еще одна общая структура - это диффузионные уравнения Максвелла-Стефана для многокомпонентного массопереноса, из которых можно получить закон Фика как предельный случай, когда смесь чрезвычайно разбавлена и каждый химический компонент взаимодействует только с объемной смесью, а не с ней. другие виды. Чтобы учесть присутствие нескольких видов в неразбавленной смеси, используются несколько вариаций уравнений Максвелла – Стефана. См. Также недиагональные связанные транспортные процессы ( отношение Онзагера ).
Когда две смешивающиеся жидкости контактируют и происходит диффузия, макроскопическая (или средняя) концентрация изменяется в соответствии с законом Фика. В мезоскопическом масштабе, то есть между макроскопическим масштабом, описываемым законом Фика, и молекулярным масштабом, где происходят случайные молекулярные блуждания, нельзя пренебрегать флуктуациями. Такие ситуации можно успешно моделировать с помощью флуктуирующей гидродинамики Ландау-Лифшица. В этой теоретической схеме диффузия обусловлена флуктуациями, размеры которых варьируются от молекулярного до макроскопического масштаба.
В частности, флуктуирующие уравнения гидродинамики включают член Фика с заданным коэффициентом диффузии, а также уравнения гидродинамики и стохастические члены, описывающие флуктуации. При вычислении флуктуаций пертурбативным подходом приближение нулевого порядка является законом Фика. Первый порядок дает флуктуации, и получается, что флуктуации вносят вклад в диффузию. Это представляет собой своего рода тавтологию, поскольку явления, описываемые приближением более низкого порядка, являются результатом приближения более высокого порядка: эта проблема решается только путем перенормировки флуктуирующих уравнений гидродинамики.
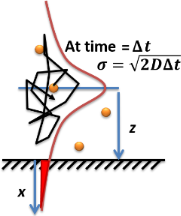 Схема молекулярной диффузии в растворе. Оранжевые точки - это молекулы растворенного вещества, молекулы растворителя не нарисованы, черная стрелка - это пример траектории случайного блуждания, а красная кривая - функция вероятности диффузионного гауссова уширения из закона диффузии Фика. :Инжир. 9
Схема молекулярной диффузии в растворе. Оранжевые точки - это молекулы растворенного вещества, молекулы растворителя не нарисованы, черная стрелка - это пример траектории случайного блуждания, а красная кривая - функция вероятности диффузионного гауссова уширения из закона диффузии Фика. :Инжир. 9 Скорость адсорбции или абсорбции разбавленного растворенного вещества на поверхности или границе раздела в растворе (газе или жидкости) может быть рассчитана с использованием законов диффузии Фика. Накопленное количество молекул, адсорбированных на поверхности, выражается уравнением Ленгмюра-Шефера на кратковременном пределе путем интегрирования уравнения диффузии по времени:
где - площадь поверхности, - числовая концентрация молекулы в объеме раствора.
Уравнение Ленгмюра-Шефера может быть расширено до уравнения Уорда-Торда, чтобы учесть «обратную диффузию» отклоненных молекул с поверхности:
где - объемная концентрация, - подповерхностная концентрация (которая является функцией времени в зависимости от модели реакции адсорбции) и является фиктивной переменной.
В пределе ультракороткого времени, в порядке времени диффузии a 2 / D, где a - радиус частицы, диффузия описывается уравнением Ланжевена. Со временем уравнение Ланжевена сливается с уравнением Стокса – Эйнштейна. Последнее подходит для состояния разбавленного раствора, в котором рассматривается дальняя диффузия. В соответствии с теоремой флуктуации-диссипации, основанной на уравнении Ланжевена в долгосрочном пределе, и когда частица значительно плотнее окружающей жидкости, зависящая от времени константа диффузии равна:
куда
Для отдельной молекулы, такой как органические молекулы или биомолекулы (например, белки) в воде, экспоненциальный член пренебрежимо мал из-за небольшого произведения mμ в пикосекундной области.
Когда интересующей областью является размер молекулы (в частности, длинной цилиндрической молекулы, такой как ДНК), уравнение скорости адсорбции представляет собой частоту столкновения двух молекул в разбавленном растворе, при этом одна молекула имеет определенную сторону, а другая - не стерическую. зависимость, т. е. молекула (случайная ориентация) ударилась с одной стороны о другую. Константу диффузии необходимо обновить до относительной постоянной диффузии между двумя диффундирующими молекулами. Эта оценка особенно полезна при изучении взаимодействия между небольшой молекулой и более крупной молекулой, такой как белок. В эффективной константе диффузии преобладает меньшая, вместо нее можно использовать константу диффузии.
Вышеупомянутое уравнение скорости столкновения также полезно для предсказания кинетики самосборки молекул на поверхности. В объемном растворе молекулы ориентированы случайным образом. Предполагая, что 1/6 молекул имеет правильную ориентацию относительно участков связывания на поверхности, то есть 1/2 направления z в трех измерениях x, y, z, таким образом, интересующая концентрация составляет всего 1/6 от объемной концентрации. Поместив это значение в уравнение, вы сможете рассчитать теоретическую кинетическую кривую адсорбции с использованием модели адсорбции Ленгмюра. В более жесткой картине 1/6 можно заменить стерическим фактором геометрии привязки.
Первый закон приводит к следующей формуле:
в котором,
Первый закон Фика также важен для уравнений переноса излучения. Однако в этом контексте он становится неточным, когда постоянная диффузии мала и излучение ограничивается скоростью света, а не сопротивлением материала, через который проходит излучение. В этой ситуации можно использовать ограничитель потока.
Скорость обмена газа через жидкую мембрану можно определить, используя этот закон вместе с законом Грэма.
В условиях разбавленного раствора, когда диффузия берет на себя управление, проницаемость мембраны, упомянутая в предыдущем разделе, может быть теоретически рассчитана для растворенного вещества с использованием уравнения, упомянутого в последнем разделе (используйте с особой осторожностью, потому что уравнение выводится для плотных растворенных веществ, в то время как биологические молекулы не плотнее воды):
куда
Технологии изготовления интегральных схем, модельные процессы, такие как химическое осаждение из паровой фазы, термическое окисление, влажное окисление, легирование и т. Д., Используют уравнения диффузии, полученные из закона Фика.
В некоторых случаях решения получают для граничных условий, таких как диффузия с постоянной концентрацией источника, ограниченная концентрация источника или диффузия по движущейся границе (когда глубина перехода продолжает перемещаться в подложку).