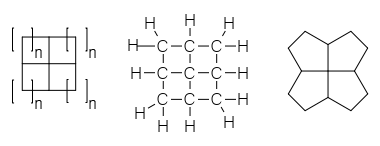
 Fenestranes, слева направо: общий фенестран, [4.4.4.4] фенестран с показанные атомы углерода и [5.5.5.5] фенестран
Fenestranes, слева направо: общий фенестран, [4.4.4.4] фенестран с показанные атомы углерода и [5.5.5.5] фенестран A фенестран в органической химии представляют собой тип химического соединения с центральным четвертичным атомом углерода которая служит общей вершиной для четырех слитых карбоциклов. Их можно дважды рассматривать как спиросоединения. Из-за присущей им деформации и нестабильности фенестраны представляют теоретический интерес для химиков. Название, предложенное в 1972 году Власиосом Георгием и Мартином Зальцманом, происходит от слова латинского, означающего окно, fenestra. Джорджиан имел в виду, что «фенестран» относится исключительно к [4.4.4.4] фенестрану, скелетная структура которого похожа на окна, а Кеннет Б. Виберг назвал эту конкретную структуру «оконным стеклом». Термин фенестран с тех пор стал обобщенным для обозначения всего класса молекул, которые имеют различные другие размеры кольца. Грузия рекомендует розетан для этого сорта на основании структурного вида розетки цветов.
 Фенестран может иметь различное количество атомов в кольцах.
Фенестран может иметь различное количество атомов в кольцах.  [3.3.3.3] Фенестран - это наименьшая возможная структура. См. Раздел § Пирамиданы для обсуждения его геометрии.
[3.3.3.3] Фенестран - это наименьшая возможная структура. См. Раздел § Пирамиданы для обсуждения его геометрии. Структуры этого класса химикатов могут быть названы в соответствии с количеством атомов в каждом кольце в дополнение к систематической номенклатуре из правил именования IUPAC. Самым маленьким членом семейства, состоящим из четырех конденсированных циклопропановых колец, является [3.3.3.3] фенестран, который имеет систематическое название тетрацикло [2.1.0.0.0] пентан и также называется пирамиданом. Следующий симметричный член, [4.4.4.4] фенестран, имеет четыре конденсированных кольца циклобутана и имеет систематическое название тетрацикло [3.3.1.0.0] нонан. Кольца не обязательно должны быть одного размера друг с другом, поэтому [4.4.4.5] фенестран имеет три циклобутановых кольца и одно циклопентановое кольцо. Другие структурные модификации меняют название, как обычно, в систематической номенклатуре, так что [4.6.4.6] фенэстрадиен имеет два циклобутановых кольца и два циклогексановых кольца в чередующемся порядке и два звена алкена в кольцевой структуре.
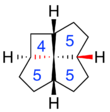 c, t, c, c- [4.5.5.5] фенестран, с выделенными размерами колец и одним транс- кольцевым слиянием.
c, t, c, c- [4.5.5.5] фенестран, с выделенными размерами колец и одним транс- кольцевым слиянием. Помимо размеров колец, фенестран может иметь различные комбинации цис- и транс-геометрия при каждом слиянии колец. Эти детали обозначаются префиксами «c» и «t» к имени структуры, перечисленными в том же порядке, что и размеры кольца. Например, c, t, c, c- [4.5.5.5] фенестран имеет транс-конфигурацию в одном из слияний циклопентан / циклопентан, но цис-конфигурацию в другом слиянии циклопентан / циклопентан и в обоих слияниях бутанепентан / циклопентан.
В крайнем случае центральный атом углерода, который обычно имел бы тетраэдрическую молекулярную геометрию с четырьмя связями, полностью уплощается. На изображении молекулярной орбитали для результирующей квадратной плоской геометрии метана две из трех sp-гибридизированных атомных орбиталей углерода образуют регулярные связи с двумя атомами водорода, как в плоском алкене. Третья sp-орбиталь взаимодействует в трехцентровой двухэлектронной связи с двумя оставшимися атомами водорода, используя только электроны водорода. Два дополнительных углеродных валентных электрона расположены на p-орбитали, перпендикулярной плоскости молекулы. Четыре связи C – H равны из-за резонанса. In silico расчеты показывают, что для этого процесса требуется от 95 до 250 ккал / моль (от 400 до 1050 кДж / моль).
Одним из наиболее напряженных фенестранов, которые были выделены, является [4.4.4.5] фенестран с валентными углами у центрального атома углерода около 130 ° (на основе рентгеновской кристаллографии ) по сравнению со стандартом 109,45 ° для тетраэдрических атомов. Длины углерод-углеродных связей также отличаются от длин нормальных алканов. В то время как связь C – C в этане составляет 155 пм, в этом фенестране связи, идущие от центрального атома углерода, укорачиваются до 149 пм, а связи по периметру удлиняются до 159. pm.
A дитерпен, называемый лауренен, содержащий [5.5.5.7] фенестрановую кольцевую систему, был первым открытым природным фенестраном. Первым когда-либо синтезированным фенестраном был [4.5.5.6] фенестран:
 синтез фенестрана 1972
синтез фенестрана 1972 Пирамидан ([3.3.3.3] фенестран) представляет собой минимально возможный фенестран, и он никогда не был синтезирован. Если бы центральный углерод был тетраэдрическим, он имел бы форму спиропентадиена, но с дополнительными связями между двумя циклопропильными кольцами, а не двойными связями внутри них. Аналогичные герма- и станнапирамиданы с триметилсилильными группами, связанными с углами, Ge [C 4 (SiMe 3)4] и Sn [C 4 (SiMe 3)4], с другой стороны, были синтезированы. Они принимают квадратную пирамидальную геометрию, аналогичную тригональной пирамиде тетраэдрана, с германием или атом олова в вершине. Этот атом имеет геометрию перевернутого тетраэдра. Согласно анализу ядерного магнитного резонанса, четыре атома углерода в основании пирамиды ведут себя как ароматическое кольцо.
В одном исследовании [4.5.5.5] фенестран был синтезирован с одним атомом углерода, замененным на азот, потому что соединения аза- и их соли более может образовывать кристаллические соединения, подходящие для рентгеноструктурного анализа, чем низкомолекулярные алканы. На стадии 1 алкилгалогенид 1-йод-3-бутен 1 превращается в цианоцинк. купрат 2(путем трансметалляции цинкорганического йодида е с цианидом меди ), который на следующей стадии реагирует с 1-нитроциклопентеном 3 в виде нуклеофильного присоединения, в результате чего нитронат 4захватывается в промежуточное соединение селена 5. пероксид водорода окисление соединения 5 дает нитроалкен 6 в виде смеси син- и анти-изомеров. [4 + 2] циклоприсоединение с н-бутил енольным эфиром в присутствии триметилалюминия дает нитронат 7и второй [3+ 2] циклоприсоединение путем нагревания в присутствии карбоната калия дает нитрозо ацеталь 8. Гидрирование с помощью никеля Ренея дает диол 9, который по двойной реакции Мицунобу (с аминным донором протонов) дает азафенестран 10 в виде борановой соли.
 Синтез азафенестрана 2006
Синтез азафенестрана 2006 В соли борана валентный угол N – C – C составляет 126 °.
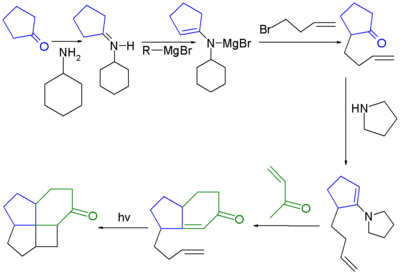
Одно исследование описывает необычную 8π дисротационную - 6π конротаторную электроциклическую каскадную реакцию, направленную на минимизацию количества шагов требуется для синтеза фенестрана.
 Fenestrane Hulot 2008
Fenestrane Hulot 2008