 | |
| Имена | |
|---|---|
| Другие имена (3α, 4β, 7α) -12,13- эпокси-3,4,7,15-тетрагидрокситрихотек-9-ан-8-он | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.150.573 |
| KEGG | |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C15H20O7 |
| Молярная масса | 312,318 г · моль |
| Внешний вид | твердое вещество |
| Плотность | 1,6 ± 0,1 г / см³ |
| Точка плавления | 222–223 ° C |
| Точка кипения | 585,1 ± 50 ° C |
| Растворимость в воде | 3,54 * 10 ^ 5 мг / л при 25 ° C |
| Растворимость | растворим в полярных органических растворителях |
| Кислотность (pK a) | 11.78 |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H225, H300, H302, H312, H332, H310, H319, H330 |
| Меры предосторожности GHS | P210, P241, P260, P262, P264, P270, P271, P280, P284, P301 + 310, P302 + 350, P304 + 340, P310, P320, P321, P322, P330, P361, P363, P403 + 233, P405, P501 |
| NFPA 704 (огненный алмаз) |  3 1 0 3 1 0 |
| Температура вспышки | 5 ° C (41 ° F; 278 K) |
| Самовоспламенение. температура | 525 ° C (977 ° F; 798 K) |
| Пороговое значение (TLV) | 20 ppm (34 мг / м) Кожа |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 19,5 мг / кг (крысы, перорально), 38,9 мг / кг (мышь, перорально) |
| НИОШ ( Пределы воздействия на здоровье в США): | |
| PEL (допустимо) | 40 ppm (70 мг / м) |
| REL (рекомендовано) | 20 ppm (34 мг / м) |
| Если не указано иное, данные приводятся для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Ниваленол (NIV) представляет собой микотоксин группы трихотеценов. В природе он встречается в основном у грибов вида Fusarium. Вид Fusarium относится к наиболее распространенным грибам, продуцирующим микотоксины, в регионах с умеренным климатом в северном полушарии, что делает их значительным риском для индустрии производства пищевых культур.
Грибы распространены в различных сельскохозяйственных продуктах (зерновые культуры) и в продуктах их дальнейшей переработки (солод, пиво и хлеб). «Виды Fusarium вторгаются и растут на сельскохозяйственных культурах и могут продуцировать ниваленол во влажных и прохладных условиях».
Симптомы, наблюдаемые после воздействия ниваленола, включают «отказ от корма, рвота, желудочно-кишечное и кожное раздражение или некроз и иммунологическая дисфункция », а также гематотоксичность, приводящая к низкому количеству лейкоцитов.
В период 1946-1963 годов несколько случаев интоксикации из-за употребления зараженных фузариозом зерен (болезнь Зерна Скрэбби) были зарегистрированы в Японии, Корее и Индии. Не было сообщений о смертельных случаях, а были только легкие симптомы, такие как тошнота, рвота, диарея и боль в животе. В этих случаях может быть выделен F.graminaerum, что указывает на загрязнение ниваленолом или дезоксиниваленолом.
За тот же период две вспышки, охватившие более 100 случаев, были зарегистрированы в Индии и Китае. Эти вспышки также не были летальными.
Хорошо задокументированная острая вспышка болезни в Индии в 1987 году затронула около 50 000 тысяч человек. Несколько токсинов Fusarium, в которых присутствовали ниваленол (0,03–0,1 мг / кг в 2 из 24 образцов), дезоксиниваленол (0,34–8,4 мг / кг в 11 из 24 образцов) и ацетилдезоксиниваленол (0,6 –2,4 мг / кг в 4 из 24 образцов) были обнаружены в поврежденной дождем пшенице, используемой для производства хлеба. Опять не было летальных случаев, и зарегистрированные симптомы: боль в животе, диарея, кровавый стул и рвота. Эти случаи показывают, что основная возникающая опасность ниваленола исходит от зараженных Fusarium злаков и в основном связана с путем переваривания неконтролируемой пшеницы или других зерен, которые далее обрабатываются или попадают в пищевую цепь другим путем.
Ниваленол, а также дезоксиниваленол и токсин Т-2 использовались в качестве боевых биологических агентов в Лаосе и Камбоджа, а также в Афганистане. Утверждается, что Советский Союз предоставил микотоксины и сам использовал их в Афганистане. Все три соединения можно было идентифицировать в растительности на пораженных участках, тогда как токсин Т-2 также можно было обнаружить в образцах мочи и крови жертв.
Наиболее задокументированное использование трихотеценов в военных действиях спор о желтом дожде, он описывает ряд нападений в Юго-Восточной Азии, а также в Лаосе и Афганистане, в ходе которых использовался «желтый дождь », как описывают свидетели. Токсины были доставлены в виде облака желтой пыли или капель. В статье Л. Р. Эмбера, опубликованной в 1984 г. в «Новости химической инженерии», очень подробно описывается использование трихотецена микотоксинов в качестве биологического оружия в Юго-Восточной Азии. В нем можно найти отчеты выживших и очевидцев, а также военнопленных и советских информаторов, а также информацию о присутствии советских техников и лабораторий. Это привело к выводу, что эти токсины использовались в Юго-Восточной Азии и Афганистане. Однако российское правительство отказывается давать заявления по этим доказательствам. Кроме того, было показано, что образцы, взятые на месте атак, содержат эти токсины, в то время как сайты, которые не были атакованы, не показывают никаких признаков токсинов в них.
Несмотря на то, что остается сомнительным, являются ли все свидетельские показания надежными источниками доказательств, зарегистрированные симптомы типичны для отравления трихотеценами.
. трихотеценами использовались в качестве оружия, такие как распыление в виде аэрозоля, дыма, капель или пыли от самолетов, ракет, портативных устройств или артиллерии.
В 2000 г. опубликовано научное заключение о ниваленоле. был выпущен Научным комитетом по пищевым продуктам (SCF). Временная переносимая суточная доза (t-TDI) в размере 0–0,7 мкг / кг м.т. в день была назначена после оценки общей токсичности, а также гематоксичности и иммунотоксичности. Этот t-TDI был подтвержден SCF в 2002 году.
В 2010 году Комиссия по безопасности пищевых продуктов Японии (FSCJ) выпустила t-TDI 0,4 мкг / кг. ч / д в день.
В период с 2001 по 2011 год Европейское агентство по безопасности пищевых продуктов (EFSA) собрало данные о 15774 случаях появления ниваленола в 18 европейских странах для оценки. Это привело к установлению TDI на уровне 1,2 мкг / кг массы тела в день. В этих исследованиях было обнаружено, что ниваленол не является генотоксичным, но хорошо гематотоксичным и иммунотоксичным.
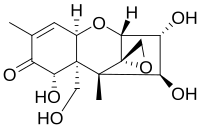
Ниваленол как часть семейства микотоксинов имеет общую структуру, присущую всем членам этого семейства токсинов. Это включает основную структуру кольца циклогексена и кольца тетрагидропирана, соединенных по C6 и C11. Кроме того, этильная группа соединяет тетрагидропиран у C2 и C5, а кето группа присоединяется к циклогексену у C8. Группа эпоксида, ответственная за реакционную способность для большинства частей, присоединена по C12 и C13 в тетрагидропиране. Только остальные группы в положениях C3, C4, C7, C15 различаются для различных микотоксинов. В случае ниваленола каждая из четырех оставшихся групп представляет собой замещенную гидроксильную группу, которая увеличивает реакционную способность в присутствии гидрофильных соединений или подгрупп соответственно благодаря их полярным характеристикам. В кислой среде кето группа также способна реагировать с протоном, способствующим полярности и реакционной способности. Но в целом группа эпоксида имеет решающее значение для реакционной способности молекулы.
Ниваленол, дезоксиниваленол и Т2-токсин представляют собой три структурных и сходных синтезированных микотоксина, встречающихся в природе в грибах (например, Fusarium ).
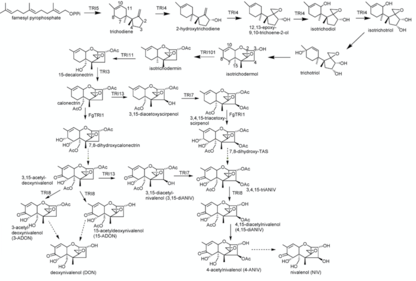 Пути синтеза ниваленола и дезоксиниваленола
Пути синтеза ниваленола и дезоксиниваленола Синтез ниваленола представляет собой 16 Он может отличаться от стадии 11 до стадии 14 в зависимости от порядка, в котором катализируются реакции, контролирующие триходиенсинтазы TRI1, TRI13 и TRI7. В качестве исходного соединения используется фамесил пирофосфат для синтеза ниваленола. Реакция его циклизации до триходиена катализируется терпен циклазой триходиенсинтазой (Tri5). Эта реакция сопровождается несколькими реакциями окисления, катализируемыми цитохромом P450 монооксигеназа (кодируется TRI4). Таким образом, гидроксильные группы были замещены на атомы углерода C2, C3 и C 11, и один кислород был добавлен к C12 и C13, облегчая образование эпоксидной группы. Это приводит к промежуточному изотрихотриолу.
В следующей реакции трихотриол был получен посредством сдвига гидроксильной группы C11 изотрихотриола к C9, аналогично сдвигу двойной связи с C9 = C10 на C10 = C11. Трихотриол реагирует в неферментативной реакции циклизации со своим изомером изотриходермолом. В реакции гидроксильная группа на C2 циклопентана связывается с C11 циклогексена, образуя тетрагидропирановое кольцо. Сдвинутая OH-группа у C9 теряется во время реакции. ацетилтрансфераза (кодируемая TRI101) катализирует ацетилирование C3OH-группы изотриходермола, образуя изотрихдермин.
Изотриходермин превращается в 15-декалонецитрин из-за замещения (кодируемого TRI11) одного водорода на один гидроксил у C15, который затем ацетилируется с помощью TRI3. Такое же замещение и последующие реакции ацетилирования снова происходят у C4 под контролем TRI13 и TRI7. TRI1 в F.sporotrichiodies дополнительно катализирует добавление четвертой ОН-группы у С8 и пятой ОН-группы у С7, в которой затем удаляется водород и образуется кетогруппа.
На последней стадии эстераза, контролируемая TRI8, катализирует деацетилирование по C3, C4 и C15, в результате чего получается конечный продукт - ниваленол. Частично альтернативный синтез может происходить, когда катализаторы TRI1 и TRI13, TRI7 используются в противоположном порядке. Затем добавление гидроксильных групп в C7 и C8, контролируемое TRI1, происходит с калонектрином в качестве реагента. В этой реакции образуется 7,8-дигидроксикалонектрин. Кроме того, он самопроизвольно реагирует с 3,15-ацетил-дезоксиниваленолом через отщепление водорода и образование группы кето- у C8. Присоединение гидроксильной группы к C4, контролируемое TRI13, происходит и ацетилируется с помощью TRI7. Это дает 3,4,15-триацетилниваленол (3,4,15-триАНИВ), из которого снова происходит тот же синтез, что описан выше.
Ниваленол вызывает изменение в ряде различных биологических путей. Наиболее известным и, вероятно, важным является путь NF-κB. NF-κB представляет собой фактор транскрипции, который можно найти почти во всех клетках человека, и он регулирует экспрессию своих генов-мишеней путем связывания со специфическими мотивами геномной ДНК на регуляторных элементах. Тесты in vitro показали, что ниваленол может изменять экспрессию цитокинов, которые являются важными молекулами-регуляторами иммунной системы. Ниваленол индуцировал секрецию ИЛ-8, медиатора воспаления. При обработке ингибитором NF-κB секреция IL-8 снижалась. Другим важным фактором, на который влияет ниваленол, является MCP-1 / CCL2, этот цитокин играет роль в регуляции подвижности мононуклеарных лейкоцитарных клеток. Ниваленол вызывает снижение секреции CCL2 и, таким образом, снижение подвижности моноцитов. Это частично объясняет иммуносупрессивную природу ниваленола. Опять же, этот эффект снижается ингибированием NF-κB, которое показывает, что ниваленол и NF-κB взаимодействуют, оказывая влияние на клетку.
Было показано, что пока дезоксиниваленол индуцирует секрецию хемокинов, которые также являются иммуно-релевантными молекулами-посредниками, ниваленол действительно ингибирует их секрецию. Ниваленол также усиливает экспрессию провоспалительных генов в макрофагах, оказывая смешанное действие на разные типы клеток. Это происходит даже на цитотоксических уровнях.
Другой механизм цитотоксичности ниваленола - это апоптотическая цитотоксичность, показывающая, что ниваленол более токсичен, чем его часто встречающийся вместе микотоксин партнер дезоксиниваленол, вызывая повреждение ДНК и апоптоз. Также известно, что ниваленол влияет на пролиферацию лейкоцитов человека. Было показано, что ниваленол может изменять скорость пролиферации лейкоцитов человека в зависимости от дозы. Известно, что более низкие концентрации усиливают пролиферацию лейкоцитов, в то время как более высокие концентрации снижают пролиферацию дозозависимым образом.
 Структура де-эпоксиниваленола
Структура де-эпоксиниваленола Ниваленол у мышей метаболизируется не только через печень, но и, в меньшей степени за счет микробной детоксикации в кишечнике. Таким образом, особенно разрушается группа эпоксида как наиболее токсичная часть молекулы. Это происходит за счет удаления кислорода из группы эпоксида, что приводит к двойной углерод-углеродной связи между C12 и C13. Эта двойная связь неполярна и очень устойчива, что приводит к менее реакционной форме ниваленола, называемой деэпоксиниваленолом. Таким образом, полученный деэпоксинированный ниваленол гораздо менее токсичен, как и любой деэпоксинированный триходиен, и может выделяться с мочой, не оказывая более значительных токсических эффектов (почти не токсичен).
В моче подопытных мышей и свиней было обнаружено 80% деэпоксидированного соединения и только 7% фактического ниваленола, показывающих высокую скорость метаболизма триходиенов. Таким образом, наблюдалась низкая концентрация азота в белках с низким содержанием мочевины, тогда как концентрация холестерина была выше нормы. Это говорит о том, что ниваленол присутствует и позже распадается в печени, поскольку печень отвечает за сегрегацию холестерина в кровоток. Более высокое количество холестерина в крови приводит затем к большему количеству отфильтрованного почками холестерина и, в конечном итоге, к повышенной концентрации в мочевине.
Предполагается, что пониженная концентрация амидов вызвана процессом разложения реакционноспособной эпоксидной группы. Таким образом, эпоксиды часто реагируют с амидами или амидными группами путем добавления гидроксильной группы к первичному или вторичному амину. Как следствие, эпоксидная группа разлагается, и для синтеза белков или мочевины присутствует меньше азота.
Ниваленол еще не нашел применения в лечебных целях, и поэтому у него нет известных побочных эффектов, кроме описанных токсических эффектов. Однако стоит отметить, что он может быть интересен для исследования из-за его иммуносупрессивного действия.
Поскольку ниваленол является микотоксическим продуктом определенных видов Fusarium, он часто обнаруживается в инфицированной пшенице и зерне. Поскольку необработанная пшеница и зерновые продукты часто используются в качестве корма для сельскохозяйственных животных, они подвержены более высокому риску потребления ниваленола.
Исследования токсичности свиней, получавших ниваленол в дозе 0,05 мг / кг массы тела два раза в день, не показали летальных эффектов. Большая часть ниваленола секретировалась с фекалиями и не попадала в кровоток, несмотря на тот факт, что ниваленол все еще оставался за пределами кишечника после 16 часов кормления. Кроме того, в течение первых трех дней метаболиты ниваленола в кале или моче не обнаруживались. После недели воздействия 2,5 или 5 мг ниваленола на кг массы тела два раза в день наблюдалась микробиологическая адаптация, поскольку метаболиты ниваленола (деэпоксидированный ниваленол) можно было обнаружить в кале и моче.
У крыс и мышей было выявлено токсическое действие ниваленола с побочными эффектами в виде задержки роста и лейкопении, уже отмеченных при самых низких дозах 0,7 мг / кг массы тела в день. Смертельные дозы зависели от пути введения / приема ниваленола. Поскольку ниваленол обычно поглощается с кормом, в качестве стандарта можно использовать LD50 орального введения, которое составляет 38,9 мг / кг веса тела в день для мышей и 19,5 мг / кг веса тела в день для крыс. LD50 внутривенно, внутрибрюшинно и подкожно (SC) составляет от 7 до 7,5 мг / кг массы тела в сутки.
Токсичность ниваленола для людей по большей части еще неизвестна, но ее исследовали на клетках мышей, крыс и хомяков. Таким образом, токсичность была разделена на следующие темы: острая / подострая, субхроническая, хроническая и канцерогенная, генотоксичность, исследования токсичности для развития и исследования репродуктивной функции, иммунотоксичность / гематотоксичность и влияние на нервную систему.
Было обнаружено, что пероральный LD50 ниваленола составил 38,9 мг / кг м.т. у мышей, тогда как внутрибрюшинный, подкожный и внутривенный пути воздействия дали LD50 значения 5–10 мг / кг массы тела. У мышей уже в течение 3 дней наибольшее количество смертей произошло после перорального воздействия из-за выраженной заложенности и кровотечения в кишечнике, при острой токсичности также включаются лимфоидные органы. Ниваленол, введенный в течение 24 дней в более низких дозах (примерно 3,5 мг / кг массы тела), показал значительную эритропению и небольшую лейкопению.
субхроническую токсичность Токсичность проверяли при кормлении мышей суточной дозой от 0 до 3,5 мг ниваленола / кг массы тела в течение 4 или 12 недель. По наблюдениям через 4 недели наблюдалось снижение массы тела и потребления пищи. Снижение массы тела можно объяснить статистическим уменьшением массы органов тимуса, селезенки и почек. В то время как время потребления было меньше для самок мышей по сравнению с самцами. Через 12 недель потребление токсина привело к снижению относительной массы органов как у мужчин, так и у женщин. При этом была затронута только печень, и никаких гистопатологических изменений не наблюдалось.
Самок мышей кормили разными дозами ниваленола (0, 0,7, 1,4 или 3,5 мг ниваленола / кг массы тела) в течение одного или двух лет, чтобы выяснить, является ли ниваленол хроническим токсичным и / или канцерогенным. Также во время этого исследования наблюдалось снижение живой массы и потребления корма. Абсолютный вес как печени, так и почек был уменьшен за счет двух самых высоких доз. У мышей, которых кормили в течение одного года ниваленолом (также в более низких дозах), наблюдалась тяжелая лейкопения, тогда как у мышей, которых кормили в течение двух лет, не было различий в количестве лейкоцитов. Также «не было обнаружено гистопатологических изменений, включая опухоли в печени, тимусе, селезенке, почках, желудке, надпочечниках, гипофизе, яичниках, костном мозге, лимфатическом узле, головном мозге и тонком кишечнике с пейеровым пластырем или без него». Самые низкие дозы (0,7 мг ниваленола / кг массы тела) подавляли рост и вызывали лейкопению. «На основании этих исследований нельзя было установить уровень наблюдаемых побочных эффектов (NOAEL ). IARC (1993) пришел к выводу, что нет достаточных доказательств канцерогенности ниваленола у экспериментальных животных. Данных о людях не было. был сделан вывод о том, что канцерогенность не поддается классификации (группа 3) ».
Было обнаружено, что ниваленол влияет на гены клеток китайского хомячка V79 (CHO) за счет незначительного увеличения частоты хромосомных аберраций. обмен сестринскими хроматидами. ДНК была повреждена как в клетках СНО, так и у мышей. У мышей (которым вводили 20 мг ниваленола / кг веса тела перорально или 3,7 мг / кг веса тела внутрибрюшинно) ДНК почек, костного мозга, желудка, тощей кишки и толстой кишки была повреждена. На ДНК тимуса и печени не повлияло. В органах с повреждением ДНК при гистопатологическом исследовании не обнаружено некротических изменений. Можно сделать вывод, что адекватная оценка генотоксичности не допускается на основании имеющихся данных.
Для исследований развития и репродукции беременным мышам вводили разные количества очищенного ниваленола на 7–15 дни беременности и для одного дополнительного исследования с плесневым рисом, содержащим ниваленол. Исследования показали, что токсин эмбриотоксичен для мышей. Доказательств тератогенности предоставлено не было. «LOAEL в исследованиях репродукции с ниваленолом, вводимым перорально, составлял 1,4 мг / кг массы тела, вводимого с кормом на протяжении всей беременности, и 5 мг / кг массы тела при введении через желудочный зонд на 7-15 дни». Данные по другим видам и о репродуктивных эффектах у взрослых самцов и самок пока не предоставлены.
Острая токсичность ниваленола вызывает токсичность для костного мозга и лимфоидных органов. Длительное воздействие может привести к эритропении и / или лейкопении. У мышей также наблюдалось, что ниваленол увеличивал присутствие сывороточного IgA, «что сопровождалось иммунопатологическими изменениями в почках, аналогичными человеческому IgA-нефропатии ». бластогенез в культивируемых человеческих лимфоцитах, пролиферация мужских и женских лимфоцитов человека, стимулированная фитогеамагглютином и лопатой, и выработка иммуноглобулина, индуцированная семенами, подавляются ниваленолом. Эффекты ниваленола находятся в том же диапазоне, что и те же дозы дезоксиниваленола, тогда как токсин Т-2 в 100 раз более токсичен. Дополнительный эффект дает комбинация ниваленола с токсином Т-2, 4,15-диацетоксисцирпенолом или дезоксиниваленолом.
О нервной системе данных нет