| Нанохлоропсис | |
|---|---|
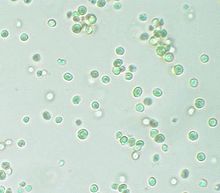 | |
| Нанохлоропсис под световым микроскопом | |
| Научная классификация | |
| Домен: | Eukaryota |
| Clade : | SAR |
| Тип: | Ochrophyta |
| Класс: | Eustigmatophyceae |
| Порядок: | Eustigmatales |
| Семья: | |
| Род: | Nannochloropsis. DJ Hibberd, 1981 |
| Типовой вид | |
| Nannochloropsis oculata. (Droop 1955) Hibberd 1981 | |
Nannochloropsis - род из водорослей, включающий шесть известных видов. Род в текущей таксономической классификации был впервые назван Хиббердом (1981). виды в основном известны из морской среды, но встречаются также в пресной и солоноватой воде. Все виды представляют собой небольшие неподвижные сферы, которые не проявляют каких-либо отчетливых морфологических особенностей, которые можно различить с помощью световой или электронной микроскопии. Характеристика в основном осуществляется с помощью анализа последовательности гена rbcL и 18S рРНК.
Водоросли рода Nannochloropsis отличаются от других родственных микроводоросли тем, что они содержат хлорофилл а и полностью лишены хлорофилла b и хлорофилла с. Кроме того, они способны создавать высокие концентрации ряда пигментов, таких как астаксантин, зеаксантин и кантаксантин. Они имеют диаметр примерно от 2 до 3 микрометров и очень простую ультраструктуру с уменьшенными структурными элементами по сравнению с соседними таксонами.
Наннохлоропсис считается многообещающей водорослью для промышленного применения из-за его способности накапливать высокие уровни полиненасыщенных жирных кислот. Более того, он показывает многообещающие особенности, которые могут позволить генетические манипуляции, направленные на генетическое улучшение существующих масляных штаммов. Различные виды Nannochloropsis действительно трансфицируются, и были доказательства того, что некоторые штаммы способны выполнять гомологичную рекомбинацию. В настоящее время он в основном используется в качестве источника калорийной пищи для личинок рыб и коловраток. Тем не менее, это вызвало растущий интерес также к исследованию производства биотоплива из фотосинтезирующих организмов. (см. Нанохлорпсис и биотопливо ). Наннохлоропсис фактически используется в качестве пищевой добавки для питания человека, и его также подают в ресторане «A Poniente» в Эль-Пуэрто-де-Санта-Мария (Кадис, Испания ) рядом с естественной средой, где Nannochloropsis gaditana был впервые выделен и все еще растет.
В настоящее время признаны следующие виды:
Научное сообщество получило геномную последовательность различных штаммов Nannochloropsis, принадлежащих к двум видам : N. gaditana и N. oceanica. портал генома на основе N. gaditana B-31 геном позволяет получить доступ к большей части геномной информации, которая касается этого микроорганизма, кроме того, для геномов N. также доступны специальные веб-страницы. gaditana CCMP526 и Н. oceanica CCMP1779.
геномы секвенированных штаммов Nannochloropsis имели длину от 28,5 до 29 Мега оснований, они имели высокую плотность генов, уменьшенную содержание интрона, короткие межгенные области и очень ограниченное присутствие повторяющихся последовательностей. Гены двух видов имеют большое сходство.
Анализ геномов показал, что эти микроводоросли имеют набор генов для синтеза и включения в клеточную стенку целлюлозы и сульфатированных фуканов, и что они способны накапливать углерод в полимерах β-1,3- и β-1,6-связанной глюкозы, называемых хризоламинарином. Анализ ЯМР целых клеток водорослей, которые культивировались при автотрофном росте, сообщает о наличии целлюлозы в клеточной стенке и подвижный хризоламинарин, вероятно, накопившийся в растворе в вакуолях внутри клетки.
Сравнение липидных метаболических генов N. gaditana и красных / зеленых / коричневых водорослей и диатомеи предоставили некоторую информацию об образце продуцирования липидов культурами Nannochloropsis. Сравнения действительно выявили наличие расширенного репертуара некоторых из генов, участвующих в сборке TAG у Nannochloropsis. Многочисленные липазы TAG, которые могут влиять на метаболизм TAG посредством деградации TAG или ремоделирования липидов, были идентифицированы у наннохлоропсиса, многие из них относятся к к семейству генов , которое, по-видимому, не входит в состав Nannochloropsis.
Анализ геномных данных показал наличие у обоих видов Nannochloropsis регуляторных РНК и, в частности, миРНК.
В геномах Nannochloropsis были обнаружены различные ортологи известных чувствительных к синему свету белков, что указывает на возможную циркадную регуляцию.
Исследовательское сообщество из Циндао Институт биоэнергетики и технологии биопроцессов (QIBEBT [1] ), Китайская академия наук секвенировал и сравнил шесть геномов наннохлоропсиса , которые включают два штамма N. oceanica ( IMET1 и CCMP531) и по одному штамму от каждого из четырех других признанных видов : N. salina (CCMP537), N. gaditana (CCMP526, о котором сообщалось ранее), N. oc ulata (CCMP525) и N. granulata (CCMP529). Они обнаружили, что шесть геномов имеют общие маслянистые черты, такие как доза гена экспансия выбранных липидного биосинтеза генов по сравнению с зелеными водорослями Хламидомонада. Наиболее ярким примером увеличения дозы гена является диацилглицерин ацилтрансфераза (DGAT), которая катализирует последнюю стадию синтеза триацилглицерина (TAG). У наннохлоропсиса 13 генов DGAT, что составляет самую высокую генную дозу в известных геномах.
Посредством всестороннего филогенетического анализа исследователи предположили, что среди 11 DGAT-2 один ген может происходить от красных водорослей вторичного эндосимбионта, четыре из зеленых водорослей родственных эндосимбионтов, а остальные шесть из генома эукариот-хозяев. Кроме того, большая часть (15,3%) генов TAG, связанных с биосинтезом , была приобретена Nannochloropsis посредством горизонтального переноса генов (HGT) от бактерий. Таким образом, объединение множественных геномов и горизонтальный генетический обмен вместе с избирательным наследованием генов синтеза липидов и потерей видоспецифичных генов привели к огромному генетическому аппарату маслянистости и широкому геномному дивергенция среди современных Nannochloropsis spp.
При культивировании в нормальных условиях роста в стандартной среде f / 2 с добавлением азота клетки Nannochloropsis имеют содержание масла около 30%. их сухой массы. Это масло можно использовать для производства биодизеля. Для производства биодизеля необходимо увеличить содержание масла в культурах Nannochloropsis. Было показано, что биосинтез жирных кислот у N. oceanica интегрирован с регуляцией пути биосинтеза холестерина, что указывает на новые подходы генной инженерии или химической биологии для увеличения производства масла в микроводорослях. С другой стороны, наблюдались различные условия культивирования для увеличения среднего содержания масла на клетку, поддерживая, однако, только медленные темпы роста культур (см. Соответствующий раздел Нанохлорпсис и биотопливо ) и снижая общую продуктивность. Среди этих условий лишение азота было одним из наиболее изученных. Исследования изучали поведение культур при азотном стрессе в различных условиях культивирования, а также физиологический и молекулярный ответ клеток на лишение азота.
Было показано, что различные штаммы Nannochloropsis накапливают до 60–70% своей общей биомассы в виде липидов при ограничении азота. В этом состоянии изменяется не только количество липидов, но и их состав. Было обнаружено, что триацилглицерины в значительной степени увеличивают истощение азота, в то время как другие липиды, в основном полярные глицеролипиды, свободные жирные кислоты и диацилглицерины., немного уменьшится. Увеличение содержания триацилглицеринов в обеднении азота намного больше, чем уменьшение других глицеролипидов, подтверждая гипотезу о том, что клетки активно синтезируют новые триацилглицерины, а не просто трансформируют существующие липиды в триацилглицерины.
Пока триацилглицерины накапливаются, а липидные капли увеличиваются, происходят другие важные морфологические изменения. хлоропласты стали меньше, и количество липидов, характерных для фотосинтетических мембран, значительно уменьшилось. Выход фотосинтеза снижается в клетках с обедненным азотом, но его все еще достаточно для обеспечения выживания и роста клеток. Если фотосинтез действительно подавлен, клетки наннохлоропсиса перестают расти, что указывает на то, что они полагаются на фотосинтетическое преобразование солнечной энергии, а не на запасенные углеводы или липиды в качестве источника энергии.
Нанохлоропсис, культивируемый в нормальных условиях роста и лишенный источника азота, продолжает расти в течение 4–5 дней. Анализ экспрессии гена показывает, что механизмы ассимиляции азота и перераспределения активируются в клетках при дефиците азота и позволяют выжить за счет частичной реорганизации клеточного метаболизма. Гены, ответственные за включение свободного аммония в глутамат (L-глутамин + 2-оксоглутарат + NADPH + H ← → 2 L-глутамат + NADP), активируются. Их повышающая регуляция увеличивает способность клеток ассимилировать минимальное количество аммония, в конечном итоге присутствующего в среде, и, что более важно, позволяет им ассимилировать внутриклеточный аммоний, который может высвобождаться в результате процессов деградации. Транскриптомные данные культур Nannochloropsis, лишенных азота, показывают, что различные ферменты, ответственные за процессы деградации, которые высвобождают аммоний, действительно регулируются вверх. Более того, увеличивается экспрессия генов, кодирующих белки, участвующие в контролируемой деградации белков, вместе с другими генами, участвующими в образовании цитозольных секвестрирующих везикул, используемых для деградации и рециклинга клеточных компонентов.
Механизм гена экспрессия хлоропласта и митохондрии подавляется у Nannochloropsis в ответ на истощение азота.
Corteggiani Carpinelli и соавторы (2013) сообщают о полном анализе экспрессия гена культур Nannochloropsis, выращенных в нормальных условиях и при отсутствии азота в течение 3 и 6 дней. Данные об аналогичных условиях были также собраны Radakovits et al. (2012) и Vieler et al. (2012). Все эти данные показывают, что гены, участвующие в биосинтезе жирных кислот и триацилглицерина, всегда присутствуют в клетках в большом количестве, и их экспрессия не коррелирует с количеством масла. накоплено. Также экспрессия генов, участвующих в деградации триацилглицеринов, не подвергается значительному подавлению по мере накопления триацилглицеринов. Общий вывод, сделанный на основании экспериментальных данных, состоит в том, что наннохлоропсис постоянно продуцирует триацилглицерины и что метаболическая реорганизация, которая следует за лишением азота, увеличивает поток субстратов по этому пути, что, в свою очередь, способно поддерживать увеличенный метаболический поток. Corteggiani Carpinelli и соавторы (2013) выдвигают гипотезу о том, что в их экспериментальных условиях фотосинтез является основным источником энергии, а подавление метаболической активности митохондрий является определяющим фактором увеличение количества субстратов, которые входят в путь биосинтеза жирных кислот. Если доступно больше предшественников, синтезируется больше жирных кислот, и, как следствие, больше триацилглицеринов продуцируется и накапливается в клетках в виде капелек масла.
Донг и др. (2013) сообщают о количественной оценке содержания различных белков в культурах Nannochloropsis, выращенных с добавкой CO2 и лишенных азота. Несмотря на разные экспериментальные условия, также протеомное исследование, по-видимому, подтверждает гипотезу о том, что накопление триацилглицеринов происходит из-за увеличения метаболического потока через путь биосинтеза жирных кислот.. Авторы выдвигают гипотезу о том, что в их экспериментальных условиях деградация запасных сахаров и повышающая регуляция гликолиза ответственны за увеличение количества субстратов по пути .
Совсем недавно Ли и соавторы (2014) собрали обширные экспериментальные данные на культурах Nannochloropsis oculata IMET1, выращенных в среде с достаточным содержанием азота и обедненной азотом среде. Согласно их анализу, это катаболизм углеводов и белков вместе с повышающей регуляцией генов, приписываемых различным пути (путь цитозольного гликолиза, который производит пируват ; обход PDHC, который дает дополнительный ацетил-КоА ; и связывание TCA реакции с митохондриальным β-окислением ), которые должны быть заявлены для увеличения поступления предшественников углерода в путь биосинтеза жирных кислот. Тем не менее, авторы предполагают, что не повышенный синтез жирных кислот приводит к накоплению масла внутри клеток, а скорее повышающая регуляция генов, участвующих в набор триацилглицеринов, который определяет конечную концентрацию масла. Другими словами, при истощении азотных запасов это повышающая регуляция уровня транскрипта ключевых генов в сборке триацилглицерина, а не в биосинтез жирных кислот, что приводит к ускоренному производству триацилглицерина.
В 2017 году в исследовании, совместно финансируемом ExxonMobil и Synthetic Genomics, был достигнут прорыв в процентном содержании липидов у Nannochloropsis gaditana благодаря применению конвейера обратной генетики CRISPR-Cas9 и азотного голодания - улучшение разделения общего углерода на липиды От 20% (дикий тип) до 40-45% (мутантный тип).