| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1,4-диоксан | |||
| Систематическое название ИЮПАК 1,4-диоксациклогексан | |||
| Другие названия [1,4] Диоксан- пара- диоксан [6] -краун-2 Диоксид диэтилена Диэтиленовый эфир Диоксан | |||
| Идентификаторы | |||
| Количество CAS | |||
| 3D модель ( JSmol ) | |||
| Ссылка на Beilstein | 102551 | ||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.004.239 | ||
| Номер ЕС | |||
| КЕГГ | |||
| PubChem CID | |||
| Номер RTECS | |||
| UNII | |||
| Номер ООН | 1165 | ||
| Панель управления CompTox ( EPA) | |||
ИнЧИ
| |||
Улыбки
| |||
| Характеристики | |||
| Химическая формула | С 4 Н 8 О 2 | ||
| Молярная масса | 88,106 г моль -1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Мягкий эфироподобный | ||
| Плотность | 1,033 г / мл | ||
| Температура плавления | 11,8 ° С (53,2 ° F, 284,9 К) | ||
| Точка кипения | 101,1 ° С (214,0 ° F, 374,2 К) | ||
| Растворимость в воде | Смешиваемый | ||
| Давление газа | 29 мм рт. Ст. (20 ° C) | ||
| Магнитная восприимчивость (χ) | −52,16 10 −6 см 3 / моль | ||
| Термохимия | |||
| Стандартная мольная энтропия ( S | 196,6 Дж / К моль | ||
| Std энтальпия формации (Δ F H ⦵298) | −354 кДж / моль | ||
| Std энтальпии сгорания (Δ с Н ⦵298) | −2363 кДж / моль | ||
| Опасности | |||
| Основные опасности | Канцероген | ||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| Формулировки опасности GHS | H225, H315, H319, H332, H336, H351, H370, H372, H373 | ||
| Меры предосторожности GHS | Р201, Р202, Р210, Р233, Р240, Р241, P242, P243, P260, P261, P264, P270, P271, P280, P281, P302 + 352, P303 + 361 + 353, Р304 + 312, Р304 + 340, P305 + 351 + 338, P307 + 311, P308 + 313, P312, P314, P321 | ||
| NFPA 704 (огненный алмаз) |  2 3 1 2 3 1 | ||
| точка возгорания | 12 ° С (54 ° F, 285 К) | ||
| самовоспламенения температуру | 180 ° С (356 ° F, 453 К) | ||
| Пределы взрываемости | 2,0–22% | ||
| Смертельная доза или концентрация (LD, LC): | |||
| LD 50 ( средняя доза ) | |||
| ЛК 50 ( средняя концентрация ) | |||
| LC Lo ( самый низкий опубликованный ) | 1000–3000 частей на миллион (морская свинка, 3 часа) 12022 частей на миллион (кошка, 7 часов) 2085 частей на миллион (мышь, 8 часов) | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
| PEL (Допустимо) | TWA 100 частей на миллион (360 мг / м 3) [кожа] | ||
| REL (рекомендуется) | Ca C 1 ppm (3,6 мг / м, 3) [30 минут] | ||
| IDLH (Непосредственная опасность) | Ca [500 частей на миллион] | ||
| Родственные соединения | |||
| Родственные соединения | Оксан Триоксан Тетроксан Пентоксан | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| | |||
| Ссылки на инфобоксы | |||
1,4-диоксан ( / д aɪ ɒ к с eɪ п / ) представляет собой гетероциклическое органическое соединение, классифицируются как эфир. Это бесцветная жидкость со слабым сладким запахом, похожим на запах диэтилового эфира. Это соединение часто называют просто диоксаном, потому что другие изомеры диоксана ( 1,2- и 1,3- ) встречаются редко.
Диоксан используется в качестве растворителя для различных практических применений, а также в лаборатории, а также в качестве стабилизатора для транспортировки хлорированных углеводородов в алюминиевых контейнерах.
Диоксана получают путем катализируемой кислоту дегидратации из диэтиленгликоля, который, в свою очередь, получает из гидролиза из окиси этилена.
В 1985 году мировые мощности по производству диоксана составляли от 11 000 до 14 000 тонн. В 1990 году общий объем производства диоксана в США составлял от 5 250 до 9 150 тонн.
Молекула диоксана центросимметрична, что означает, что она принимает конформацию стула, типичную для родственников циклогексана. Однако молекула является конформационно гибкой, и конформация лодочки легко принимается, например, при хелатировании катионов металлов. Диоксан напоминает меньший по размеру краун-эфир только с двумя этиленоксильными звеньями.
В 1980-х годах большая часть производимого диоксана использовалась в качестве стабилизатора 1,1,1-трихлорэтана для хранения и транспортировки в алюминиевых контейнерах. Обычно алюминий защищен слоем оксида пассивирующего, но когда эти слои нарушены, металлический алюминий реагирует с трихлорэтан, чтобы дать трихлорид алюмини, который, в свою очередь катализирует дегидрогалогенирование оставшегося трихлорэтана к винилиденхлориду и хлористому водород. Диоксан «отравляет» эту реакцию катализа, образуя аддукт с трихлоридом алюминия.
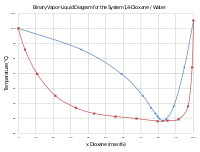 Бинарная фазовая диаграмма для системы 1,4-диоксан / вода
Бинарная фазовая диаграмма для системы 1,4-диоксан / вода Диоксан используется во множестве применений в качестве универсального апротонного растворителя, например для красок, клеев и сложных эфиров целлюлозы. В некоторых процессах он заменяет тетрагидрофуран (THF) из-за его более низкой токсичности и более высокой температуры кипения (101 ° C по сравнению с 66 ° C для THF).
Хотя диэтиловый эфир нерастворим в воде, диоксан смешивается и фактически гигроскопичен. При стандартном давлении смесь воды и диоксана в соотношении 17,9: 82,1 по массе представляет собой положительный азеотроп, который кипит при 87,6 ° C.
Атомы кислорода являются основными по Льюису, поэтому диоксан способен сольватировать многие неорганические соединения и служит хелатирующим диэфирным лигандом. Он образует аддукты 1: 1 с различными кислотами Льюиса, такими как I 2, фенолы, спирты и бис (гексафлорацетилацетонато) медь (II). Он классифицируется как жесткий базовый, и его базовые параметры в модели ECW составляют E B = 1,86 и C B = 1,29. Он реагирует с реактивами Гриньяра с осаждением дигалогенида магния. Таким образом, диоксан используется для поддержания равновесия Шленка. Диметилмагний получают следующим образом:
Диоксан используется в качестве внутреннего стандарта для спектроскопии ядерного магнитного резонанса в оксиде дейтерия.
Диоксан имеет LD 50 5170 мг / кг для крыс. Раздражает глаза и дыхательные пути. Воздействие может вызвать повреждение центральной нервной системы, печени и почек. В исследовании смертности 1978 г., проведенном среди рабочих, подвергшихся воздействию 1,4-диоксана, наблюдаемое число смертей от рака существенно не отличалось от ожидаемого. Диоксан классифицируется Национальной токсикологической программой как «канцероген для человека». Он также классифицируется IARC как канцероген группы 2B : возможно, канцерогенный для человека, поскольку он известен как канцероген для других животных. Агентство по охране окружающей среды США классифицирует диоксан в качестве вероятного человека канцерогена (наблюдая рост заболеваемости рака в контролируемых исследованиях на животных, но не в эпидемиологических исследованиях рабочих с использованием соединения), и известный раздражитель (с не поддающимся неблагоприятных - воздействует на уровень 400 миллиграммов на кубический метр) в концентрациях, значительно превышающих те, которые содержатся в коммерческих продуктах. В соответствии с Постановлением 65 штата Калифорния диоксан классифицируется в штате Калифорния США как вызывающий рак. Исследования на животных на крысах показывают, что наибольший риск для здоровья связан с вдыханием паров в чистом виде. Штат Нью-Йорк принял первый в стране стандарт питьевой воды для 1,4-диоксана и установил максимальный уровень загрязнения 1 часть на миллиард.
Он также имеет низкую токсичность для водных организмов и может разлагаться различными путями. Проблемы усугубляются тем, что диоксан хорошо растворяется в воде, плохо связывается с почвой и легко выщелачивается в грунтовые воды. Он также устойчив к естественным процессам биоразложения. Благодаря этим свойствам, факел диоксана может быть больше (и иметь более низкий градиент), чем связанный с ним шлейф растворителя.
Как и некоторые другие эфиры, диоксан соединяется с атмосферным кислородом при длительном контакте с воздухом с образованием потенциально взрывоопасных пероксидов. Перегонка этих смесей опасна. Хранение под металлическим натрием может снизить риск взрыва.
Диоксан повлиял на запасы грунтовых вод в нескольких районах. Диоксан на уровне 1 мкг / л (~ 1 ppb) был обнаружен во многих местах в США. В американском штате Нью-Гэмпшир в 2010 году он был обнаружен на 67 участках, в диапазоне концентраций от 2 частей на миллиард до более 11 000 частей на миллиард. Тридцать из этих полигонов представляют собой свалки твердых отходов, большинство из которых были закрыты в течение многих лет.
В качестве побочного продукта процесса этоксилирования, пути к некоторым ингредиентам, содержащимся в очищающих и увлажняющих продуктах, диоксан может загрязнять косметику и продукты личной гигиены, такие как дезодоранты, духи, шампуни, зубные пасты и жидкости для полоскания рта. Процесс этоксилирования делает очищающие средства, такие как лауретсульфат натрия и лауретсульфат аммония, менее абразивными и обеспечивают улучшенные характеристики пенообразования. 1,4-Диоксан содержится в небольших количествах в некоторых косметических средствах, но это еще не регулируемое вещество, используемое в косметике как в Китае, так и в США. Исследования обнаружили это химическое вещество в этоксилированном сырье и в готовых косметических продуктах. Экологическая рабочая группа (ЭРГ) обнаружила, что 97% от релаксанты волос, 57% детские мыл и 22 процентов всех продуктов в неглубоко, их базах данных для косметических продуктов, загрязнены 1,4-диоксана.
С 1979 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) проводит испытания косметического сырья и готовой продукции на содержание 1,4-диоксана. 1,4-Диоксан присутствовал в этоксилированных сырых ингредиентах на уровнях до 1410 частей на миллион (~ 0,14% масс) и на уровнях до 279 частей на миллион (~ 0,03% масс) в готовых косметических продуктах. Уровни 1,4-диоксана, превышающие 85 частей на миллион (~ 0,01% масс.) В детских шампунях, указывают на необходимость тщательного контроля за сырьем и готовой продукцией. Хотя FDA рекомендует производителям удалять 1,4-диоксан, это не требуется федеральным законом.
9 декабря 2019 года в Нью-Йорке был принят законопроект о запрете продажи косметики с содержанием 1,4-диоксана более 10 ppm с конца 2022 года. Закон также запретит продажу средств бытовой химии и средств личной гигиены, содержащих более 2 частей на миллион 1,4-диоксана на конец 2022 года.
 Три изомера диоксана
Три изомера диоксана