Ингибиторы c-Met представляют собой класс малых молекул, которые ингибируют ферментативная активность c-Met тирозинкиназы, рецептора фактора роста гепатоцитов / фактора рассеяния (HGF / SF). Эти ингибиторы могут иметь терапевтическое применение при лечении различных типов рака.
Многие ингибиторы c-Met в настоящее время проходят клинические испытания. Кризотиниб и кабозантиниб были первыми, одобренными США. FDA. Кризотиниб получил ускоренное одобрение в 2011 году для лечения пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого, а кабозантиниб был одобрен в 2012 году для лечения медуллярного рака щитовидной железы и также начал клинические испытания для лечения нескольких других типов рака.
c-Met стимулирует рассеяние клеток, инвазию, защиту от апоптоза и ангиогенеза. c-Met представляет собой рецепторную тирозинкиназу, которая может вызывать широкий спектр различных видов рака, таких как почечный, желудочный и мелкоклеточный рак легких., опухоли центральной нервной системы, а также несколько сарком, когда их активность не регулируется. Нацеливание на АТФ сайт связывания c-Met с помощью небольших молекул ингибиторов является одной из стратегий ингибирования тирозинкиназы.
 Рис. 3. K252a, первый низкомолекулярный ингибитор Met, растворенный в комплексе с нефосфорилированным доменом Met киназы. Между шарниром Met и пирралокарбазолом образуются две ключевые водородные связи.
Рис. 3. K252a, первый низкомолекулярный ингибитор Met, растворенный в комплексе с нефосфорилированным доменом Met киназы. Между шарниром Met и пирралокарбазолом образуются две ключевые водородные связи. В начале 1980-х годов MET был описан как белок продукт трансформирующего онкогена.
 Рис. 1. SU11274, a Ингибитор c-Met первого поколения (ядро индолин-2-она в красном кружке).
Рис. 1. SU11274, a Ингибитор c-Met первого поколения (ядро индолин-2-она в красном кружке).  Рис. 2. PHA665752, ингибитор c-Met второго поколения.
Рис. 2. PHA665752, ингибитор c-Met второго поколения. Первые попытки идентифицировать АТФ- конкурентный ингибиторы c-Met в 2002 г. привели к открытию K252a, стауроспорин -подобного ингибитора, который блокирует c-Met. K252a была первой структурой, которая была решена в комплексе с нефосфорилированным доменом киназы MET. Он образует две водородные связи между шарниром и субъединицей пирралокарбазола.
Позже была разработана серия более селективных ингибиторов c-Met, в которых ядро индолин-2-она (обведено на рисунке 1)) присутствовал в нескольких ингибиторах киназ. SU-11274 был образован путем замены в 5-положении индолинона и добавления 3,5-диметил пиррольной группы, в результате был получен PHA-665752 - ингибитор второго поколения с лучшей эффективностью и активностью.
Интерес к этой области стремительно вырос с 2007 года, и в середине 2009 года было опубликовано более 70 патентных заявок.
В фармацевтической промышленности были предприняты интенсивные усилия. принятие c-Met в качестве подходящей мишени для лечения рака. Было опубликовано 20 кристаллических структур с лигандами и без них, и в 2010 году клинически испытано около дюжины низкомолекулярных ингибиторов c-Met.
Рецепторные тирозинкиназы ( RTK) являются жизненно важным элементом в регуляции многих внутриклеточных путей передачи сигналов. Met-тирозинкиназа является рецептором для фактора роста гепатоцитов (HGF), также известного как фактор рассеяния (SF). HGF в основном экспрессируется на эпителиальных клетках и мезенхимальных клетках, например гладкомышечных клетках и фибробластах ). HGF обычно активен при заживлении ран, регенерации печени, развитии эмбриона и нормального млекопитающего, органный морфогенез.
нарушение регуляции c-Met может быть обусловлено к сверхэкспрессии, амплификации гена, мутации, лиганд-зависимой ауто- или паракринной петле или несвоевременной активации RTK. Все эти факторы влияют на выживаемость клеток, их пролиферацию и подвижность. Они также приводят к раку и устойчивости к лечению от них. Пациенты с аберрантной активностью c-Met обычно имеют неблагоприятный прогноз, агрессивное заболевание, повышенное метастазирование и сокращенную выживаемость. Вот почему нацеливание на сигнальный путь HGF / c-MET не было принято в качестве лечения рака, и несколько различных терапевтических подходов проходят клинические испытания. Для нацеливания на c-Met использовались различные подходы, каждый из которых сосредоточен на одном из последовательных этапов, которые регулируют активацию c-Met антителами, пептидными агонистами, рецепторами-ловушками и другими биологическими ингибиторы или ингибиторы малых молекул.
 Рисунок 4. Схематическая структура некоторых возможностей ингибирования Met: Антитела и антагонисты (такие как NK4) связываются с внеклеточным доменом. Фрагменты Met внеклеточного домена также могут связываться с HGF и действовать как ловушка Met. Низкомолекулярные ингибиторы связываются с внутриклеточной киназой Met. Функциональные домены Met: P в кружке (фосфатная группа), SS (дисульфидная связь ), Sema-домен (семафорин-подобный), PSI (плексины, семафорины, интегрины), IPT-домен (иммуноглобулин-подобные, плексины, Факторы транскрипции) и PTK (протеин-тирозинкиназа).
Рисунок 4. Схематическая структура некоторых возможностей ингибирования Met: Антитела и антагонисты (такие как NK4) связываются с внеклеточным доменом. Фрагменты Met внеклеточного домена также могут связываться с HGF и действовать как ловушка Met. Низкомолекулярные ингибиторы связываются с внутриклеточной киназой Met. Функциональные домены Met: P в кружке (фосфатная группа), SS (дисульфидная связь ), Sema-домен (семафорин-подобный), PSI (плексины, семафорины, интегрины), IPT-домен (иммуноглобулин-подобные, плексины, Факторы транскрипции) и PTK (протеин-тирозинкиназа).  Рис. 5. Топографические особенности сайта связывания Met ATP. A: тирозин в петле активации, B: гидрофобный суб-карман C: центральный гидрофобный участок, D: шарнирный участок, E: гидрофобный суб-карман.
Рис. 5. Топографические особенности сайта связывания Met ATP. A: тирозин в петле активации, B: гидрофобный суб-карман C: центральный гидрофобный участок, D: шарнирный участок, E: гидрофобный суб-карман. Подсемейство c-Met RTK отличается в структура для многих других семейств RTK: зрелая форма имеет внеклеточную α-цепь (50 кДа) и трансмембранную β-цепь (140 кДа), которые связаны между собой дисульфидной связью. Бета-цепь содержит внутриклеточный домен тирозинкиназы и хвост на С-конце, который жизненно важен для стыковки субстратов и передачи сигналов ниже по течению.
HGF является естественным лигандом с высокой аффинностью для Встретились. Его N-концевой участок связывается с Met, и димеризация рецептора, а также аутофосфорилирование двух тирозинов происходит в петле активации (A-петля) в киназном домене Met.
Фосфорилирование происходит в тирозинах рядом с С-концом, создавая многофункциональный сайт стыковки, который привлекает адаптерные белки и приводит к передаче сигналов ниже по течению. Передача сигналов опосредуется Ras / Mapk, PI3K / Akt, c-Src и STAT3 / 5 и включает пролиферацию клеток, снижение апоптоза, изменение функции цитоскелета и многое другое.
Киназный домен обычно состоит из двухлепестковой структуры, в которой доли соединены шарнирной областью, смежной с очень консервативным сайтом связывания АТФ.
Используя информацию из сокристаллической структуры PHA-66752 и c-Met, был разработан селективный ингибитор PF-2341066. В 2010 году он проходил фазу I / II клинических испытаний. Замена ряда соединений 4-феноксихинолина на группу ацил тиомочевина привела к соединениям с активностью c-Met, например хинолин. Это был ключевой шаг в развитии ингибитора c-Met в том смысле, что связывание ацила дает концевой арильной группе способность проникать в глубокий гидрофобный карман и, таким образом, усиливает эффективность соединений. Были найдены альтернативы связи ацилтиомочевины, которые имеют группу пиримидона, как в AM7.
AM7 и SU11274 предложили первое доказательство того, что относительно селективные ингибиторы c-Met могут быть идентифицированы и что ингибирование приводит к противоопухолевому эффекту in vivo. Когда сравнивали сокристаллические структуры AM7 и SU11274 с c-Met, было обнаружено, что они разные: SU-11274 связывается рядом с шарнирной областью с U-образной конформацией; но AM7 связывается с c-Met в расширенной конформации, которая охватывает область от шарнирной области до C-спирали. Затем он связывается в гидрофобном кармане. c-Met принимает неактивную, нефосфорилированную конформацию с AM7, которая может связываться как с фосфорилированными, так и с нефосфорилированными конформациями киназы.
Из-за этих двух разных типов связывания низкомолекулярные ингибиторы Met были разделены на два класса ; I класс (SU-11274-подобный) и II класс (AM7-подобный). Однако существует другой тип низкомолекулярных ингибиторов, который не входит ни в один из двух классов; неконкурентный ингибитор АТФ, который связывается иначе, чем два других.
Низкомолекулярные ингибиторы различаются по селективности, либо очень специфичны, либо обладают широкой селективностью. Они являются либо АТФ-конкурентными, либо неконкурентными.
Несмотря на то, что эти два класса структурно различаются, у них действительно есть общие свойства: они оба связываются шарнирная область киназы (хотя они занимают разные части активного сайта c-Met), и все они стремятся имитировать пурин АТФ. BMS-777607 и PF-02341066 имеют 2-аминопиридиновую группу, AMG-458 имеет хинолиновую группу, а MK-2461 имеет трициклическую ароматическую группу.
Ингибиторы класса I имеют много различных структур, относительно селективны, имеют U-образную конформацию и связываются с петлей активации c-Met.
 Рис. 6. SAR ингибиторов Met класса I с различными группами замещения. Ar символизирует ароматическую группу (на этом рисунке слева направо: хинолин, азаиндол, бензотиазид, бензильные группы (с различными группами R, такими как -OH) и метоксифенил)). X символизирует линкер между ядром и арильной группой (слева направо: метил, дифторметил, метокси, амино и группы серы). R1 символизирует различные группы, которые были добавлены к C-7 (сверху вниз: N-связанный хлорфенол, N-гидроксиэтилпиразол и пиразол). Атомы в положениях 1, 5, 8 и 9 во многих тестируемых аналогах представляют собой атомы C или N.
Рис. 6. SAR ингибиторов Met класса I с различными группами замещения. Ar символизирует ароматическую группу (на этом рисунке слева направо: хинолин, азаиндол, бензотиазид, бензильные группы (с различными группами R, такими как -OH) и метоксифенил)). X символизирует линкер между ядром и арильной группой (слева направо: метил, дифторметил, метокси, амино и группы серы). R1 символизирует различные группы, которые были добавлены к C-7 (сверху вниз: N-связанный хлорфенол, N-гидроксиэтилпиразол и пиразол). Атомы в положениях 1, 5, 8 и 9 во многих тестируемых аналогах представляют собой атомы C или N. Обнаружен ряд триазолотриазинов, которые показали большие перспективы в качестве ингибиторов c-MET. Взаимосвязь структурной активности (SAR) подразумевает необходимость наличия арильной группы, связанной с кольцом триазина, и подходящего акцептора водородной связи (например, гидроксильной группы), присоединенного к подвесное бензильное кольцо, но похоже, что фенол действует как связующее звено (с Met1160) и что триазин взаимодействует с Tyr1230. Обнаружен и исследован ряд подобных аналогов. Структурно подобный ряд ингибиторов c-Met, в которых фенольный элемент, связывающий шарнир, был связан с ариламинотриазолопиридазином или арил-триазолотиапиридазином. Одноатомный линкер был более эффективным, чем двухатомный линкер, и такое замещение в бензильном положении, по-видимому, допустимо. Описаны соединения с гетероциклическими шарнирно-связывающими элементами (хинолин, пиридин, азаиндол), связанными с конденсированными, насыщенными азотом гетероароматическими соединениями (триазолопиридазины, триазолопиразины и триазолотриазины). Подробности см. На рисунке 4.
, которые содержат дифторметильный линкер и биодоступную группу хинолина, проходили клинические испытания фазы I для распространенные и устойчивые солидные опухоли в 2010 г.
, АТФ-конкурентное и исключительно селективное соединение, имеет группу N-гидроксиэтилпиразола, связанную с C-7 соединения. В 2010 году он проходил фазу I клинических испытаний.
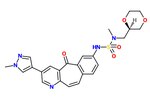 Рис. 7. MK2461, уникальный ингибитор c-Met
Рис. 7. MK2461, уникальный ингибитор c-Met Был исследован SAR уникального каркаса ингибитора киназы с мощной ингибирующей активностью c-Met. Пиридиновый азот необходим для ингибирующей активности и снижения активности насыщения центрального кольца. Доказано, что планарность молекулы важна для максимальной эффективности. Циклические эфиры уравновешивают приемлемую клеточную активность и фармакокинетические характеристики. Следующие элементы считаются ключевыми в процессе оптимизации:
1) Арильные группы в 7-положении, как если бы для максимизации гидрофобной упаковки и планарности,
2) Сильный SAR при добавлении группы сульфонамида и
3) Относительно плоский SAR групп, подверженных воздействию растворителя.
Часто онкогенные мутации c-Met вызывают устойчивость к низкомолекулярным ингибиторам. Таким образом, аналог MK-2461 был протестирован против множества мутантов c-Met, но оказался не менее эффективным против них. Это дает молекуле большое преимущество при лечении опухолей, вызванных нарушением регуляции c-Met. В 2010 году MK-2461 проходил фазу испытаний повышения дозы I.
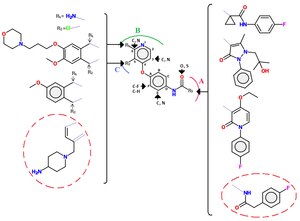 Рис. 8. Обычный каркас для ингибиторов Met класса II. Атомы в положениях F, E, 6 и 3 во многих тестируемых аналогах были группами C, C-F или N. Атом О амида может быть замещен атомом S. Группы R представляют некоторые из групп, которые были протестированы против MET с различными группами замещения (слева сверху вниз: амидные, хлорные, арилоксицинолиновые группы, метоксифенил и пирролотриазины с концевой аминогруппой. Правая сторона сверху вниз : Фторфенилмалонамид с циклопропильной группой, гидроксиметилфенилпиразолон, этоксифторфенилпиридон и фторфенилоксаламид).A: группа R3 застревает в гидрофобном кармане c-MET, B: пиридиновая группа связывается с шарнирной областью и C: Группа R2 обычно связывается с рибозным карманом, в котором обычно связывается рибоза АТФ.
Рис. 8. Обычный каркас для ингибиторов Met класса II. Атомы в положениях F, E, 6 и 3 во многих тестируемых аналогах были группами C, C-F или N. Атом О амида может быть замещен атомом S. Группы R представляют некоторые из групп, которые были протестированы против MET с различными группами замещения (слева сверху вниз: амидные, хлорные, арилоксицинолиновые группы, метоксифенил и пирролотриазины с концевой аминогруппой. Правая сторона сверху вниз : Фторфенилмалонамид с циклопропильной группой, гидроксиметилфенилпиразолон, этоксифторфенилпиридон и фторфенилоксаламид).A: группа R3 застревает в гидрофобном кармане c-MET, B: пиридиновая группа связывается с шарнирной областью и C: Группа R2 обычно связывается с рибозным карманом, в котором обычно связывается рибоза АТФ. Ингибиторы класса II обычно не так селективны, как ингибиторы класса I. Группы мочевины также являются общей характеристикой ингибиторов класса II., либо в циклической, либо в ациклической формах. Ингибиторы класса II содержат ряд различных молекул, общий каркас которых можно увидеть на рисунке 4.
Серия ингибиторов хинолинового c-Met с ацилтиомочевинной связью. Было обнаружено несколько серий аналогов с альтернативными шарнирными связывающими группами (например, замена хинолиновой группы), заменой связи тиомочевины (например, малонамид, оксаламид, пиразолоны) и ограничением фрагмента структуры ациклической ацилтиомочевины различными ароматические гетероциклы. Дальнейшее уточнение включало блокирование p-положения бокового фенильного кольца с помощью атома фтора. Примеры взаимодействий между c-Met и небольшими молекулами (отмеченными красным кружком) класса II следующие: каркас c-Met ложится в карман АТФ тремя ключевыми водородными связями, концевой амин взаимодействует с карманом рибозы (АТФ), концевая 4-фторфенильная группа ориентирована в гидрофобном кармане, а пирролотриазин играет роль группы, связывающей шарнир.
В клинических испытаниях фазы II GSK 1363089 (XL880, форетиниб) хорошо переносился. Это привело к незначительному регрессу или стабилизации заболевания у пациентов с папиллярной карциномой почек и низкодифференцированным раком желудка.
- мощный низкомолекулярный ингибитор c-MET, обладающий более чем 100-кратной селективностью в отношении c-MET через панель из 55 киназ. Кроме того, AMG 458 обладал 100% биодоступностью у разных видов, а собственный период полувыведения увеличивался у высших млекопитающих.
 Тивантиниб (ARQ197), ингибитор c-Met
Тивантиниб (ARQ197), ингибитор c-Met Тивантиниб (ARQ197) представляет собой селективный, пероральный биодоступный, клинически продвинутый низкомолекулярный и хорошо переносимый ингибитор c-MET, который является в настоящее время проходит 3-ю фазу клинических испытаний у пациентов с немелкоклеточным раком легкого. ARQ197 представляет собой неконкурентный с АТФ ингибитор аутофосфорилирования c-MET с высокой селективностью в отношении нефосфорилированной конформации киназы. Тивантиниб обрезает взаимодействия между ключевыми каталитическими остатками. Структура тивантиниба в комплексе с киназным доменом c-Met показывает, что ингибитор связывает конформацию, которая отличается от опубликованных структур киназы. Тивантиниб сильно подавляет аутоактивацию c-Met, избирательно воздействуя на неактивную форму киназы между N- и C-долями и занимая сайт связывания АТФ.
С момента открытия Met и HGF большой интерес исследователей сосредоточился на их роли в развитии рака. Путь Met является одним из наиболее часто нерегулируемых путей при раке человека. Более глубокое понимание способов связывания и структурного дизайна приближает нас к использованию других белковых взаимодействий и связывающих карманов, создавая ингибиторы с альтернативными структурами и оптимизированными профилями.
Таблица 1. Примеры низкомолекулярных ингибиторов c-Met в клинических испытаниях ( 2010). СНД: структура не раскрывается; RON: Recepteur d'origine nantais ALK: киназа анапластической лимфомы ; VEGFR2 : рецептор сосудистого эндотелиального фактора роста 2; MiT: опухоли с фактором транскрипции микрофтальмии; PDAC: протоковая аденокарцинома поджелудочной железы; НМРЛ: немелкоклеточная карцинома легкого; ГЦК: гепатоцеллюлярная карцинома; MTC: медуллярная карцинома щитовидной железы; ГБМ: глиобластома; ПКР: почечно-клеточная карцинома; HNSCC: плоскоклеточная каинома головы и шеи; IND: новый исследуемый препарат.
СНД: структура не раскрывается; RON: Recepteur d'origine nantais ALK: киназа анапластической лимфомы ; VEGFR2 : рецептор сосудистого эндотелиального фактора роста 2; MiT: опухоли с фактором транскрипции микрофтальмии; PDAC: протоковая аденокарцинома поджелудочной железы; НМРЛ: немелкоклеточная карцинома легкого; ГЦК: гепатоцеллюлярная карцинома; MTC: медуллярная карцинома щитовидной железы; ГБМ: глиобластома; ПКР: почечно-клеточная карцинома; HNSCC: плоскоклеточная каинома головы и шеи; IND: новый исследуемый препарат. По состоянию на 2010 год более десятка ингибиторов пути Met с различными профилями селективности киназы от высокоселективного до многоцелевого были изучены в клинике, и был достигнут хороший прогресс (см. Таблицу 1). (например, XL184 (кабозантиниб), XL880, ARQ197 )
Использование ингибиторов c-Met с другими терапевтическими агентами может иметь решающее значение для преодоления потенциальной устойчивости, а также для улучшение общего клинического эффекта. Ингибиторы метаболического пути могут использоваться в комбинации с другими видами лечения, включая химиотерапию -, радио - или иммунотерапию, а также различные ингибиторы метаболического пути, например, с биологическими антагонистами HGF и Met или антителами против HGF и MET. Тем не менее, риск накопленной токсичности и взаимодействия с другими лекарственными средствами сохраняется.
В 2011 г. PF -02341066 (теперь называемый кризотиниб) был одобрен US FDA для некоторых немелкоклеточных форм рака легких.
В 2012 году XL184 / кабозантиниб получил одобрение FDA для лечения медуллярного рака щитовидной железы, а в 2016 году он получил одобрение FDA и ЕС для лечения рака почки.
Тепотиниба (MSC 2156119J) сообщили о клинических испытаниях фазы II. l результаты по раку легких.