 Гливек, препарат, используемый для лечения нескольких раковых заболеваний, продается Novartis, одной из крупнейших фармацевтических компаний в мире.
Гливек, препарат, используемый для лечения нескольких раковых заболеваний, продается Novartis, одной из крупнейших фармацевтических компаний в мире.фармацевтическая промышленность открывает, разрабатывает, производит и продает лекарства или фармацевтические препараты для использования в качестве лекарств для введения (или самостоятельного введения) пациентам с целью вылечить их, вакцинировать их, или облегчить симптомы. Фармацевтические компании могут продавать непатентованные или фирменные лекарства и медицинские устройства. Они подпадают под действие множества законов и нормативных актов, регулирующих патентование, тестирование, безопасность, эффективность и маркетинг лекарств.
Современная фармацевтическая промышленность началась с местных аптекарей, которые расширили свою традиционную роль, распространяя ботанические препараты, такие как морфин и хинин, до оптового производства. в середине 1800-х годов и открытиями в результате прикладных исследований. Преднамеренное открытие лекарств на растениях началось с выделения между 1803 и 1805 годами морфина - обезболивающего и вызывающего сон агента - из опиума немецким помощником аптекаря Фридрихом Сертюрнером, который назвал это здание в честь греческого бога снов Морфея. К концу 1880-х годов немецкие производители красителей усовершенствовали очистку отдельных органических соединений от смол и других минеральных источников, а также разработали элементарные методы органического химического синтеза. Развитие синтетических химических методов позволило ученым систематически изменять структуру химических веществ, а развитие новой науки фармакологии расширило их возможности по оценке биологических эффектов этих структурных изменений.
К 1890-м годам было обнаружено глубокое влияние экстрактов надпочечников на многие различные типы тканей, что положило начало поискам как механизм химической сигнализации и попытки использовать эти наблюдения для разработки новых лекарств. Повышение артериального давления и сосудосуживающее действие экстрактов надпочечников представляли особый интерес для хирургов как кровоостанавливающих агентов и как средство для лечения шока, и ряд компаний разработали продукты на основе экстрактов надпочечников, содержащие активные вещества различной степени чистоты. В 1897 году Джон Абель из Университета Джона Хопкинса идентифицировал действующее начало как эпинефрин, который он выделил в нечистом состоянии в виде сульфатной соли. Промышленный химик Джокити Такамине позже разработал метод получения адреналина в чистом виде и передал лицензию на эту технологию Parke-Davis. Компания Parke-Davis продавала адреналин под торговым названием Адреналин. Инъекционный адреналин оказался особенно эффективным для острого лечения приступов астмы, и его ингаляционная версия продавалась в США до 2011 года (Primatene Mist ). К 1929 году адреналин был разработан в виде ингалятора для лечения заложенности носа.
Несмотря на высокую эффективность, потребность в инъекции ограничивала использование адреналина и перорально активных производных. Сходное по структуре соединение, эфедрин (фактически более похожее на норэпинефрин ) было идентифицировано японскими химиками на заводе Ма Хуанг и продано Eli Lilly в качестве перорального средства для лечения астмы. Следуя работе Генри Дейла и Джорджа Баргера из Burroughs-Wellcome, академический химик Гордон Аллес синтезировал амфетамин и испытал его на пациентах с астмой в 1929 году. Доказано, что лекарство оказывает лишь умеренное противоастматическое действие, но вызывает ощущение возбуждения и сердцебиения. Амфетамин был разработан Смитом, Кляйном и Френчем в качестве назального деконгестанта под торговым названием Бензедрин ингалятор. Амфетамин в конечном итоге был разработан для лечения нарколепсии, постэнцефалитный паркинсонизм и повышение настроения при депрессии и других психиатрических показаниях. Он получил одобрение Американской медицинской ассоциации в качестве нового и неофициального средства правовой защиты для этих целей в 1937 году и оставался обычным средством от депрессии до разработки трициклических антидепрессантов в 1960-х.
 Диэтилбарбитуровая кислота была первым продаваемым барбитуратом. Он был продан компанией Bayer под торговым названием Veronal
Диэтилбарбитуровая кислота была первым продаваемым барбитуратом. Он был продан компанией Bayer под торговым названием Veronal . В 1903 году Герман Эмиль Фишер и Джозеф фон Меринг раскрыли свое открытие, что диэтилбарбитуровая кислота, образующаяся в результате реакции диэтилмалоновой кислоты, оксихлорид фосфора и мочевина вызывает сон у собак. Открытие было запатентовано и лицензировано Bayer Pharmaceuticals, которая продавала соединение под торговым названием Веронал в качестве снотворного, начиная с 1904 года. Систематические исследования влияния структурных изменений на потенцию и Продолжительность действия привела к открытию фенобарбитала в компании Bayer в 1911 году и открытию его мощного противоэпилептического действия в 1912 году. Фенобарбитал был одним из наиболее широко используемых препаратов для лечения эпилепсии в течение 1970-х годов и по состоянию на 2014 год остается в списке основных лекарств Всемирной организации здравоохранения. В 1950-е и 1960-е годы возросло понимание способности барбитуратов и амфетаминов вызывать привыкание и возможности злоупотребления, что привело к усилению ограничений на их использование и усилению государственного контроля над лицами, назначающими лекарства. Сегодня амфетамин в значительной степени ограничен использованием для лечения синдрома дефицита внимания и фенобарбитала для лечения эпилепсии.
Серия экспериментов, проведенных с конца 1800-х годов. к началу 1900-х годов выяснилось, что диабет вызван отсутствием вещества, обычно вырабатываемого поджелудочной железой. В 1869 г. Оскар Минковски и Джозеф фон Меринг обнаружили, что диабет может быть вызван у собак хирургическим удалением поджелудочной железы. В 1921 году канадский профессор Фредерик Бантинг и его ученик Чарльз Бест повторили это исследование и обнаружили, что инъекции экстракта поджелудочной железы обращают вспять симптомы, вызванные удалением поджелудочной железы. Вскоре было продемонстрировано, что экстракт работает на людях, но развитие инсулиновой терапии как рутинной медицинской процедуры было отложено из-за трудностей с получением материала в достаточном количестве и с воспроизводимой чистотой. Исследователи обратились за помощью к промышленным сотрудникам из Eli Lilly and Co., основываясь на опыте компании в крупномасштабной очистке биологических материалов. Химик Джордж Б. Уолден из Eli Lilly and Company обнаружил, что тщательное регулирование pH экстракта позволяет получить относительно чистый сорт инсулина. Под давлением Университета Торонто и потенциальным патентным вызовом со стороны академических ученых, которые независимо разработали аналогичный метод очистки, было достигнуто соглашение о неисключительном производстве инсулина несколькими компаниями. До открытия и широкого распространения инсулинотерапии ожидаемая продолжительность жизни диабетиков составляла всего несколько месяцев.
Разработка лекарств лечение инфекционных заболеваний было основным направлением ранних исследований и разработок; в 1900 году пневмония, туберкулез и диарея были тремя основными причинами смерти в Соединенных Штатах, а смертность в первый год жизни превышала 10%.
В 1911 году арсфенамин, первый синтетический противоинфекционный препарат, разработанный Полем Эрлихом и химиком Альфредом Бертхаймом из Института экспериментальной терапии в Берлине. Препарат получил коммерческое название Сальварсан. Эрлих, отмечая как общую токсичность мышьяка, так и избирательное поглощение некоторых красителей бактериями, предположил, что краситель, содержащий мышьяк, с аналогичными свойствами избирательного поглощения может быть использован для лечения бактериальных инфекций. Арсфенамин был приготовлен в рамках кампании по синтезу ряда таких соединений, и было обнаружено, что он проявляет частично избирательную токсичность. Арсфенамин оказался первым эффективным средством для лечения сифилиса, болезни, которая до того времени была неизлечимой и неумолимо приводила к серьезным кожным язвам, неврологическим повреждениям и смерти.
Систематический подход Эрлиха Изменение химической структуры синтетических соединений и измерение влияния этих изменений на биологическую активность широко применялись учеными-промышленниками, в том числе учеными из Bayer Йозефом Кларером, Фрицем Мицшем и Герхардом Домагком. Эта работа, также основанная на тестировании соединений, доступных в немецкой красильной промышленности, привела к разработке пронтозила, первого представителя сульфонамидного класса антибиотиков <72.>. По сравнению с арсфенамином, сульфаниламиды обладали более широким спектром активности и были гораздо менее токсичными, что делало их полезными для инфекций, вызванных патогенами, такими как стрептококки. В 1939 году Домагк получил Нобелевскую премию по медицине за это открытие. Тем не менее, резкое снижение смертности от инфекционных заболеваний, имевшее место до Второй мировой войны, было, прежде всего, результатом улучшения мер общественного здравоохранения, таких как чистая вода и менее тесное жилье, а также воздействия противоинфекционных препаратов и вакцины имели большое значение в основном после Второй мировой войны.
В 1928 году Александр Флеминг обнаружил антибактериальные эффекты пенициллина, но его использование для лечения болезней человека ждало разработка методов его крупносерийного производства и очистки. Они были разработаны консорциумом фармацевтических компаний под руководством правительства США и Великобритании во время Второй мировой войны.
Ранний прогресс в разработке вакцин произошел в течение всего этого периода, в основном в форме академических и финансируемых государством базовых программ. исследования, направленные на выявление патогенов, вызывающих общие инфекционные заболевания. В 1885 году Луи Пастер и Пьер Поль Эмиль Ру создали первую вакцину от бешенства. Первые вакцины против дифтерии были произведены в 1914 году из смеси дифтерийного токсина и антитоксина (полученного из сыворотки инокулированного животного), но безопасность вакцины прививка была маргинальной и не получила широкого распространения. В 1921 году в Соединенных Штатах было зарегистрировано 206 000 случаев дифтерии, в результате которых погибло 15 520 человек. В 1923 году параллельные усилия Гастона Рамона из Института Пастера и Александра Гленни из Wellcome Research Laboratories (более поздняя часть GlaxoSmithKline ) привели к открытию, что более безопасный вакцина может быть произведена путем обработки токсина дифтерии формальдегидом. В 1944 г. Морис Хиллеман из Squibb Pharmaceuticals разработал первую вакцину против японского энцефелита. Позже Хиллеман перебрался в Merck, где сыграл ключевую роль в разработке вакцин против кори, эпидемического паротита, ветряной оспы, краснуха, гепатит A, гепатит B и менингит.
 В 1937 году более 100 человек умерли после приема внутрь раствор антибактериального сульфаниламида, приготовленный в токсичном растворителе диэтиленгликоле
В 1937 году более 100 человек умерли после приема внутрь раствор антибактериального сульфаниламида, приготовленный в токсичном растворителе диэтиленгликоле . До 20-го века лекарства обычно производились небольшими производителями с небольшим регулирующим контролем над производством или заявлениями о безопасности и эффективности. Поскольку такие законы действительно существовали, их исполнение было слабым. В Соединенных Штатах усиление регулирования вакцин и других биологических препаратов было вызвано вспышками столбняка и смертями, вызванными распространением зараженной противооспенной вакцины и дифтерийного антитоксина. Закон о контроле за биологическими препаратами 1902 года требовал, чтобы федеральное правительство выдавало предпродажное разрешение на каждое биологическое лекарство, а также на процесс и установку, производящую такие лекарства. За этим последовал в 1906 году Закон о пищевых продуктах и лекарствах, который запрещал межгосударственное распространение фальсифицированных продуктов и лекарств с неправильным брендом. Наркотик считался недействительным, если он содержал алкоголь, морфин, опиум, кокаин или некоторые другие потенциально опасные наркотики или наркотики, вызывающие привыкание, и если на его этикетке не было указано количество или пропорция таких наркотиков. Попытки правительства использовать закон для преследования производителей за необоснованные заявления об эффективности были подорваны постановлением Верховного суда, ограничивающим правоохранительные полномочия федерального правительства случаями неправильного определения ингредиентов препарата.
В 1937 году более 100 человек умер после приема внутрь «эликсир сульфаниламид » производства SE Компания Massengill из Теннесси. Продукт был приготовлен на основе диэтиленгликоля, высокотоксичного растворителя, который в настоящее время широко используется в качестве антифриза. Согласно действовавшим в то время законам, судебное преследование производителя было возможно только при условии, что продукт был назван «эликсиром», что буквально означало раствор в этаноле. В ответ на этот эпизод Конгресс США принял Федеральный закон о пищевых продуктах, лекарствах и косметических средствах 1938 года, который впервые требовал предпродажной демонстрации безопасности перед тем, как лекарство могло быть продано, и прямо запрещал ложные терапевтические заявления.
Последствия Второй мировой войны увидел взрыв в открытии новых классов антибактериальных препаратов, включая цефалоспорины (разработанные Эли Лилли на основе плодотворной работы Джузеппе Бротцу и Эдварда Абрахама ), стрептомицин (обнаружен в ходе исследовательской программы, финансируемой компанией Merck в лаборатории Селмана Ваксмана), тетрациклины (обнаружены в Lederle Laboratories, теперь являются частью Pfizer ), эритромицин (обнаружен в Eli Lilly and Co.) и их распространение на все более широкий спектр бактериальных патогенов. Стрептомицин, обнаруженный в ходе исследовательской программы, финансируемой компанией Merck, в лаборатории Селмана Ваксмана в Рутгерсе в 1943 году, стал первым эффективным средством от туберкулеза. На момент открытия санатории для изоляции больных туберкулезом были повсеместным явлением в городах в развитых странах, и 50% из них умирали в течение 5 лет после поступления.
Отчет Федеральной торговой комиссии, выпущенный в 1958 году. попытался количественно оценить влияние разработки антибиотиков на американское общественное здоровье. В отчете установлено, что за период 1946–1955 гг. Произошло снижение на 42% случаев заболеваний, при которых антибиотики были эффективны, и только на 20% - для тех, при которых антибиотики были неэффективны. В отчете делается вывод, что «похоже, что использование антибиотиков, ранняя диагностика и другие факторы ограничили распространение эпидемии и, следовательно, количество этих заболеваний». В исследовании дополнительно изучались уровни смертности от восьми распространенных заболеваний, для которых антибиотики предлагали эффективную терапию (сифилис, туберкулез, дизентерия, скарлатина, коклюш, менингококковые инфекции и пневмония), и было обнаружено снижение на 56% за тот же период. Среди них следует отметить снижение смертности от туберкулеза на 75%.
 Случаи кори, зарегистрированные в Соединенных Штатах до и после введения вакцины.
Случаи кори, зарегистрированные в Соединенных Штатах до и после введения вакцины. 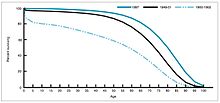 Процент выживших по возрасту в 1900, 1950, и 1997.
Процент выживших по возрасту в 1900, 1950, и 1997. В период 1940–1955 годов темпы снижения уровня смертности в США ускорились с 2% в год до 8% в год, а затем вернулись к историческому уровню 2% в год. год. Резкий спад в первые послевоенные годы был приписан быстрой разработке новых методов лечения и вакцин от инфекционных заболеваний, которые произошли в эти годы. Разработка вакцины продолжала ускоряться, и самым заметным достижением этого периода стала разработка Джонаса Солка вакцины против полиомиелита в 1954 году при финансировании некоммерческого Национального фонда детского паралича. Процесс вакцины никогда не был запатентован, а вместо этого был предоставлен фармацевтическим компаниям для производства недорогого генерика. В 1960 году Морис Хиллеман из Merck Sharp Dohme идентифицировал вирус SV40, который, как позже было показано, вызывает опухоли у многих видов млекопитающих. Позже было установлено, что SV40 присутствовал в качестве контаминанта в партиях вакцины против полиомиелита, которую вводили 90% детей в Соединенных Штатах. Загрязнение, по-видимому, произошло как из исходного клеточного материала, так и из ткани обезьяны, используемой для производства. В 2004 году Институт рака США объявил, что пришел к выводу, что SV40 не связан с раком у людей.
Другие известные новые вакцины того периода включают вакцины против кори (1962, Джон Франклин Эндерс из Детского медицинского центра Бостона)., позже уточненный Морисом Хиллеманом в Merck), краснухе (1969, Hilleman, Merck) и эпидемическом паротите (1967, Hilleman, Merck). Заболеваемость краснухой, синдромом врожденной краснухи, корью и эпидемическим паротитом в Соединенных Штатах снизилась более чем на 95% в сразу после широко распространенной вакцинации. За первые 20 лет лицензированной вакцинации против кори в США было предотвращено около 52 миллионов случаев заболевания, 17 400 случаев умственной отсталости и 5200 смертей.
Гипертензия является фактором риска атеросклероза, сердечной недостаточности, ишемической болезни сердца, инсульта, почечной заболевание и заболевание периферических артерий, и является наиболее важным фактором риска для сердечно-сосудистой заболеваемости и смертности, в промышленно развитых странах. До 1940 года примерно 23% всех смертей среди людей старше 50 были связаны с гипертонией. Тяжелые случаи гипертонии лечили хирургическим путем.
Ранние разработки в области лечения гипертонии включали блокаторы симпатической нервной системы иона четвертичного аммония, но эти соединения никогда не применялись широко из-за их тяжелых побочных эффектов, поскольку длительное время Долгосрочные последствия высокого кровяного давления для здоровья еще не установлены, и потому, что они должны вводиться путем инъекции.
В 1952 году исследователи из Ciba открыли первый доступный для приема внутрь сосудорасширяющий препарат - гидралазин. Основным недостатком монотерапии гидралазином было то, что она со временем теряла свою эффективность (тахифилаксия ). В середине 1950-х годов Карл Х. Бейер, Джеймс М. Спрэг, Джон Э. Бэр и Фредерик К. Новелло из Merck and Co. открыли и разработали хлоротиазид, который остается наиболее широко используемый сегодня гипотензивный препарат. Это развитие было связано со значительным снижением уровня смертности среди людей с гипертонией. В 1975 году изобретатели получили награду Ласкера в области общественного здравоохранения за «спасение бесчисленных тысяч жизней и облегчение страданий миллионов жертв гипертонии».
A 2009 Cochrane В обзоре сделан вывод, что тиазидные гипотензивные препараты снижают риск смерти (RR 0,89), инсульта (RR 0,63), ишемической болезни сердца (RR 0,84) и сердечно-сосудистых событий (RR 0,70) у людей с высоким кровяным давлением. В последующие годы были разработаны и получили широкое применение в комбинированной терапии другие классы антигипертензивных препаратов, включая петлевые диуретики (Lasix / furosemide, Hoechst Pharmaceuticals, 1963), бета-блокаторы (ICI Pharmaceuticals, 1964) ингибиторы АПФ и блокаторы рецепторов ангиотензина. Ингибиторы АПФ снижают риск нового начала заболевания почек [ОР 0,71] и смерти [ОР 0,84] у пациентов с диабетом, независимо от того, есть ли у них гипертония.
До второго мира Во время войны контроль рождаемости был запрещен во многих странах, а в Соединенных Штатах даже обсуждение методов контрацепции иногда приводило к судебному преследованию в соответствии с законами Комстока. Таким образом, история разработки оральных контрацептивов тесно связана с движением за ограничение рождаемости и усилиями активистов Маргарет Сэнджер, Мэри Деннетт и Эмма Гольдман. Основано на фундаментальных исследованиях, выполненных Грегори Пинкусом, и методах синтеза прогестерона, разработанных Карлом Джерасси в Syntex и Фрэнком Колтоном в GD Searle Co., первый пероральный контрацептив, Эновид, был разработан E.D. Searle and Co. и одобрено Управлением по контролю за продуктами и лекарствами в 1960 году. Первоначальная формула содержала чрезмерно высокие дозы гормонов и вызывала серьезные побочные эффекты. Тем не менее, к 1962 году 1,2 миллиона американских женщин принимали противозачаточные таблетки, а к 1965 году их число увеличилось до 6,5 миллионов. Доступность удобной формы временных противозачаточных средств привела к кардинальным изменениям в социальных обычаях, включая расширение диапазона вариантов образа жизни, доступных женщинам, уменьшение зависимости женщин от мужчин в применении противозачаточных средств, поощрение отсрочки вступления в брак и увеличение числа добрачных союзов.
 Порок развития ребенка, рожденного от матери, принимавшей талидомид во время беременности.
Порок развития ребенка, рожденного от матери, принимавшей талидомид во время беременности. В США возникла потребность в пересмотре Закона о FDC из слушаний в Конгрессе, проведенных сенатором Эстес Кефовер из Теннесси в 1959 году. Слушания охватили широкий круг вопросов политики, включая злоупотребления рекламой, сомнительную эффективность лекарств и необходимость более строгого регулирования отрасли. В то время как импульс к принятию нового законодательства временно не стал предметом расширенных дебатов, возникла новая трагедия, которая подчеркнула необходимость более всеобъемлющего регулирования и стала движущей силой для принятия новых законов.
12 сентября 1960 г. американский лицензиат, компания William S. Merrell из Цинциннати, подал заявку на новый лекарственный препарат кевадон (талидомид ), седативное средство, которое продавалось в Европе с тех пор. 1956. Медицинский сотрудник FDA, отвечающий за изучение соединения, Фрэнсис Келси, считал, что данные, подтверждающие безопасность талидомида, неполны. Фирма продолжала оказывать давление на Келси и FDA, чтобы они одобрили заявку до ноября 1961 года, когда лекарство было снято с немецкого рынка из-за его связи с серьезными врожденными аномалиями. Несколько тысяч новорожденных в Европе и других странах пострадали от тератогенного эффекта талидомида. Без одобрения FDA фирма распространила Кевадон среди более чем 1000 врачей под предлогом использования в исследовательских целях. В ходе этого «исследования» более 20 000 американцев получили талидомид, в том числе 624 беременных пациентки, и около 17 известных новорожденных пострадали от воздействия препарата.
Трагедия с талидомидом возродила законопроект Кефовера об усилении регулирования лекарственных средств это застопорилось в Конгрессе, и Поправка Кефовера-Харриса вступила в силу 10 октября 1962 года. Отныне производители должны были доказывать FDA, что их лекарства были эффективны, а также безопасны, прежде чем они могли поступить на рынок США. FDA получило полномочия регулировать рекламу рецептурных лекарств и устанавливать надлежащую производственную практику. Закон требовал, чтобы все препараты, введенные в период с 1938 по 1962 год, были эффективными. Совместное исследование FDA и Национальной академии наук показало, что почти 40 процентов этих продуктов оказались неэффективными. Аналогичное всестороннее исследование препаратов, отпускаемых без рецепта, началось десятью годами позже.
В 1971 году Акира Эндо, японский биохимик, работавший на Фармацевтическая компания Sankyo определила мевастатин (ML-236B), молекулу, продуцируемую грибком Penicillium citrinum, в качестве ингибитора HMG-CoA редуктазы, критического фермента, используемого организмом для производства холестерина. Испытания на животных показали очень хороший ингибирующий эффект, как и в клинических испытаниях, однако долгосрочное исследование на собаках обнаружило токсические эффекты при более высоких дозах, и в результате мевастатин считался слишком токсичным для человеческое использование. Мевастатин никогда не продавался из-за его побочных эффектов в виде опухолей, разрушения мышц, а иногда и смерти лабораторных собак.
П. Рой Вагелос, главный научный сотрудник, а затем генеральный директор Merck Co, проявил интерес и совершил несколько поездок в Японию, начиная с 1975 года. К 1978 году компания Merck выделила ловастатин (мевинолин, MK803) из гриба Aspergillus terreus, впервые поступившего на рынок в 1987 году как Mevacor.
В апреле 1994 года результаты спонсируемого компанией Merck исследования Scandinavian Simvastatin Survival Study, были объявлены. Исследователи протестировали симвастатин, позже проданный компанией Merck как Zocor, на 4444 пациентах с высоким уровнем холестерина и сердечными заболеваниями. По прошествии пяти лет исследование пришло к выводу, что у пациентов наблюдалось снижение уровня холестерина на 35%, и их шансы умереть от сердечного приступа снизились на 42%. В 1995 году Zocor и Mevacor заработали Merck более 1 миллиарда долларов США. Эндо был награжден Премией Японии 2006 года и Премией Ласкера-Дебейки за клинические медицинские исследования в 2008 году. За свои «новаторские исследования нового класса молекул» для «снижения холестерина»,
Открытие лекарств - это процесс открытия или разработки потенциальных лекарств. В прошлом большинство лекарств было открыто либо путем выделения активного ингредиента из традиционных лекарств, либо с помощью случайного открытия. Современная биотехнология часто фокусируется на понимании метаболических путей, связанных с болезнью состоянием или патогеном, и манипулировании этими путями с помощью молекулярных биология или биохимия. Многочисленные открытия новых лекарств традиционно выполнялись университетами и исследовательскими институтами.
Разработка лекарств относится к действиям, предпринимаемым после того, как соединение идентифицировано как потенциальное лекарство, с целью определения его пригодности в качестве лекарства. Цели разработки лекарственного средства заключаются в определении подходящего состава и дозирования, а также в установлении безопасности. Исследования в этих областях обычно включают комбинацию исследований in vitro, исследований in vivo и клинических испытаний. Стоимость разработки на поздних стадиях означает, что это обычно делается более крупными фармацевтическими компаниями.
Часто крупные транснациональные корпорации демонстрируют вертикальную интеграцию, участвуя в широком спектре открытий и разработок лекарств, производство и контроль качества, маркетинг, продажи и распространение. С другой стороны, более мелкие организации часто сосредотачиваются на определенном аспекте, таком как обнаружение кандидатов в лекарства или разработка рецептур. Часто соглашения о сотрудничестве между исследовательскими организациями и крупными фармацевтическими компаниями заключаются для изучения потенциала новых лекарственных субстанций. В последнее время транснациональные компании все больше полагаются на контрактные исследовательские организации для управления разработкой лекарств.
Открытие и разработка лекарств очень дороги; из всех соединений, исследованных для использования на людях, только небольшая часть в конечном итоге одобрена в большинстве стран назначенными правительством медицинскими учреждениями или советами, которые должны одобрить новые лекарства, прежде чем они могут быть проданы в этих странах. В 2010 году FDA одобрило 18 NME (новых молекулярных объектов) и три биопрепаратов, или 21 всего, что ниже 26 в 2009 году и 24 в 2008 году. С другой стороны, их было всего 18 Всего в 2007 г. было получено разрешение, а в 2006 г. - 22. С 2001 г. Центр по оценке и исследованию лекарственных средств получал в среднем 22,9 утверждения в год. Это одобрение было получено только после значительных инвестиций в доклинические разработки и клинические испытания, а также приверженности постоянному мониторингу безопасности. Лекарства, которые не проходят через этот процесс, часто влекут за собой большие затраты, но не приносят взамен никакой прибыли. Если принять во внимание стоимость этих неудачных лекарств, то стоимость разработки нового успешного лекарственного препарата (новое химическое соединение, или NCE) оценивается примерно в 1,3 миллиарда долларов США (не включая маркетинг расходы ). Однако в 2012 году профессора Лайт и Лексчин сообщили, что уровень одобрения новых лекарств был относительно стабильным в среднем от 15 до 25 на протяжении десятилетий.
Исследования и инвестиции в отрасли достигли рекордных 65,3 миллиарда долларов. 2009. В то время как стоимость исследований в США в период с 1995 по 2010 год составляла около 34,2 миллиарда долларов, доходы росли быстрее (за это время выручка выросла на 200,4 миллиарда долларов).
Исследование консалтинговой фирмы Bain Компания сообщила, что затраты на открытие, разработку и запуск (с учетом маркетинговых и других коммерческих расходов) нового препарата (вместе с перспективными лекарствами, которые потерпели неудачу) выросли за пятилетний период почти до 1,7 миллиарда долларов в 2003 году. По данным Forbes, к 2010 году затраты на разработку составили от 4 до 11 миллиардов долларов на лекарство.
Некоторые из этих оценок также учитывают альтернативные издержки инвестирования капитала за много лет до того, как будут реализованы доходы. (см. Временная стоимость денег ). Из-за очень долгого времени, необходимого для открытия, разработки и утверждения фармацевтических препаратов, эти затраты могут составлять почти половину общих расходов. Прямым следствием цепочки создания добавленной стоимости фармацевтической промышленности является то, что крупные транснациональные фармацевтические корпорации склонны все больше отдавать на аутсорсинг риски, связанные с фундаментальными исследованиями, что в некоторой степени меняет отраслевую экосистему, поскольку биотехнологические компании играют все более важную роль, а общие стратегии меняются соответствующим образом. Некоторые одобренные лекарственные средства, такие как препараты, основанные на переработке существующего активного ингредиента (также называемые удлинением линии), намного дешевле в разработке.
Из-за неоднократных обвинений и выводов о том, что некоторые клинические испытания, проводимые или финансируемые фармацевтическими компаниями, могут сообщать только о положительных результатах для предпочтительного лекарства, отрасль стала гораздо более внимательно изучаться независимыми группы и правительственные учреждения.
В ответ на конкретные случаи, когда не были опубликованы неблагоприятные данные исследований, спонсируемых фармацевтическими компаниями, Pharmaceutical Research and Manufacturers of America опубликовали новые руководящие принципы, призывающие компании к сообщать обо всех выводах и ограничивать финансовое участие исследователей в фармацевтических компаниях. Конгресс США подписал закон, который требует, чтобы клинические испытания фазы II и фазы III были зарегистрированы спонсором на веб-сайте clinictrials.gov, управляемом Национальным институтом здравоохранения.
Исследователи лекарств, не нанятые непосредственно фармацевтическими компаниями, часто обращаются к компаниям за грантами, а компании часто обращаются к исследователям за исследованиями, которые сделают их продукты привлекательными. Спонсируемые исследователи получают вознаграждение от фармацевтических компаний, например, в виде поддержки расходов на проведение конференций / симпозиумов. Сценарии лекций и даже журнальные статьи, представленные академическими исследователями, на самом деле могут быть «написаны призраком» фармацевтическими компаниями.
Расследование, проведенное ProPublica, показало, что по крайней мере 21 врачу заплатили более 500000 долларов. за выступления и консультации производителей лекарств с 2009 года, при этом половина наиболее высокооплачиваемых специалистов работает в психиатрии, и около 2 миллиардов долларов в общей сложности выплачено врачам за такие услуги. AstraZeneca, Johnson Johnson и Eli Lilly заплатили миллиарды долларов федеральными расчетами по обвинениям в том, что они платили врачам за продвижение лекарств для неразрешенного использования. Некоторые известные медицинские школы ужесточили правила принятия преподавателями таких платежей фармацевтическими компаниями.
В отличие от этой точки зрения, статья и соответствующая редакционная статья в New England Journal of Medicine в мае В 2015 году подчеркивалась важность взаимодействия фармацевтов и врачей для разработки новых методов лечения и утверждалось, что моральное возмущение по поводу злоупотреблений в отрасли неоправданно заставило многих переоценить проблемы, вызванные финансовым конфликтом интересов. В статье отмечается, что крупные медицинские организации, такие как Национальный центр развития трансляционных наук при Национальных институтах здравоохранения, Совет советников президента по науке и технологиям, Всемирный экономический форум, Фонд Гейтса, Wellcome Trust и Food and Drug Администрация поощряла более тесное взаимодействие между врачами и промышленностью, чтобы принести большую пользу пациентам.
Врачи без границ предупредили, что высокие цены и монополия на лекарства, тесты и вакцины продлят пандемию и унесут жизни. Они призвали правительства предотвратить спекуляцию, используя принудительные лицензии по мере необходимости, как это уже было сделано в Канаде, Чили, Эквадоре, Германии и Израиле.
20 февраля позвонили 46 законодателям США. правительству США не предоставлять монопольные права при выделении налогоплательщикам денег на разработку любых вакцин и средств лечения коронавируса, чтобы избежать предоставления исключительного контроля над ценами и доступностью частным производителям.
 Алекс Азар выступает на брифинге для прессы, на котором было объявлено об этом что Майк Пенс взял на себя ответные меры на коронавирус (видео )
Алекс Азар выступает на брифинге для прессы, на котором было объявлено об этом что Майк Пенс взял на себя ответные меры на коронавирус (видео )26 февраля 2020 г., министр здравоохранения и социальных служб США (бывший генеральный директор фармацевтической компании Алекс Азар дал показания перед комитетом Палаты представителей по энергетике и торговле. На этой встрече Азар неоднократно отказывался сказать, что какая-либо вакцина или лечение от коронавируса будет доступен для всех американцев, а не только для тех, кто достаточно богат, чтобы платить. Представители, допрашивающие его, раскритиковали его позицию. Через несколько часов президент Трамп, который, как говорили, скептически относился к способности секретаря справиться с этой работой, внезапно передал ответственность за пандемию вице-президенту Майку Пенсу. Некоторые придавали большое значение тому факту, что президент отказался от объяснений Азара прессе, что он остается министром здравоохранения и социальных служб; это было сообщил, что Трамп уволил его во время кризиса не для виду.
2 марта представитель США Ян Шаковски написал Алексу Азару: «Вы должны понимать, что Палата представителей откажется от и это неприемлемо, если доллары налогоплательщиков использовались для разработки вакцины от COVID-19, а права на производство и продажу этой вакцины были впоследствии переданы фармацевтическому производителю по эксклюзивной лицензии без условий ценообразования или доступа, что позволяло компании взимать что бы он ни пожелал, и, по сути, продавая вакцину обратно общественности, которая заплатила за ее разработку ».
 Трамп вместе с Азаром подписывает Закон о дополнительных ассигнованиях на готовность к коронавирусу и реагирование на него 6 марта
Трамп вместе с Азаром подписывает Закон о дополнительных ассигнованиях на готовность к коронавирусу и реагирование на него 6 марта Закон о дополнительных ассигнованиях на готовность к коронавирусу и реагирование на него от 6 марта 2020 изначально разрешал правительству США вводить принудительное лицензирование в случаях, когда цены завышены; после лоббирования это было удалено, и было добавлено положение, запрещающее правительству США принимать какие-либо меры в отношении доступности, если это может задержать доступность вакцины против коронавируса или лечения. Наблюдатели разошлись во мнениях относительно того, поможет ли законопроект или затруднит доступность.
Regeneron Pharmaceuticals заключила сделку с правительством США Управлением перспективных биомедицинских исследований и разработок, согласно которому правительство будет финансировать 80% затраты Regeneron на разработку и производство препаратов для лечения коронавируса, а Regeneron сохранит за собой право устанавливать цены и контролировать производство. Эта сделка подверглась критике в New York Times. Такие сделки не редкость для рутинной разработки лекарств на американском фармацевтическом рынке.
Американская фармацевтическая компания Gilead искала и получила статус орфанного лекарства для ремдесивира из США Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 23 марта 2020 г. Это положение предназначено для поощрения разработки лекарств, затрагивающих менее 200 000 американцев, путем предоставления производителям усиленных и расширенных юридических монопольных прав, а также с освобождением от налогов и государственных сборов. Ремдесивир - кандидат для лечения COVID-19; на момент предоставления статуса менее 200000 американцев были заражены COVID-19, но их число быстро росло, поскольку пандемия COVID-19 достигла США, и вскоре пересечение порога считалось неизбежным. Ремдесивир был разработан компанией Gilead с бюджетом более 79 миллионов долларов США. В мае 2020 года Gilead объявила, что бесплатно предоставит федеральному правительству первые 940 000 доз ремдесивира. После бурной реакции общественности компания Gilead отказалась от статуса "орфанного препарата" ремдесивиру 25 марта. Gilead сохраняет патенты на ремдесивир сроком на 20 лет в более чем 70 странах. В мае 2020 года компания также объявила, что ведет переговоры с несколькими компаниями по производству дженериков о предоставлении прав на производство ремдесивира для развивающихся стран и с Патентным пулом лекарственных средств для обеспечения более широкого доступа к генерикам.
Производитель диагностических тестов в США Cepheid Inc получил разрешение FDA на экстренное использование для теста COVID-19 под названием Xpert Xpress SARS-CoV- 2. В тесте используются те же машины, которые обычно используются для тестирования на туберкулез и ВИЧ, а также на другие заболевания, и он дает результаты за 45 минут, быстрее, чем некоторые другие тесты. Cepheid объявила, что в развивающихся странах будет взимать 19,80 долларов США за тест. Врачи без границ заявили, что эта цена недоступна в странах, где люди живут менее чем на два доллара в день. Они подсчитали, что стоимость проведения теста для Cepheid составляет всего 3 доллара, и назвали предложенную цену спекуляцией, прося Cepheid получить более умеренную прибыль, продав тесты по 5 долларов США каждый. Группа действий по лечению (TAG) поддержала этот запрос, заявив, что разработка тестов, их покупка и глобальное развертывание осуществлялись за счет государственных средств, в то время как владельцы Cepeid получили прибыль в размере 3 миллиардов долларов США. 2019. TAG также запустил кампанию «Время за 5 долларов». Аналогичные тесты на вирус гепатита C (другой РНК-вирус ) стоят от 50 центов США (для пятиминутных тестов на антитела ) до 5 долларов США (для более сложного генома. тесты, аналогичные цефеидам). Широко распространенное тестирование с помощью этих дешевых тестов имело решающее значение для ликвидации гепатита С в Египте, и аналогичные методы массового тестирования в регионах успешно использовались против COVID-19.
В Соединенных Штатах, Новые фармацевтические продукты должны быть одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) как безопасные и эффективные. Этот процесс обычно включает подачу заявки на исследуемый новый лекарственный препарат с достаточными доклиническими данными для поддержки проведения испытаний на людях. После утверждения IND могут быть проведены три фазы постепенно увеличивающихся клинических испытаний на людях. В фазе I обычно изучается токсичность на здоровых добровольцах. Фаза II может включать фармакокинетику и дозирование у пациентов, а фаза III представляет собой очень большое исследование эффективности в целевой популяции пациентов. После успешного завершения фазы III тестирования в FDA подается Заявка на новый препарат. FDA проверяет данные, и, если продукт рассматривается как имеющий положительную оценку пользы и риска, выдается разрешение на продажу продукта в США.
Часто требуется четвертый этап надзора после утверждения. к тому, что даже самые крупные клинические испытания не могут эффективно предсказать распространенность редких побочных эффектов. Постмаркетинговый надзор обеспечивает тщательный контроль за безопасностью лекарства после выхода на рынок. В некоторых случаях может потребоваться ограничить показания к определенным группам пациентов, а в других - полностью исключить вещество с рынка.
FDA предоставляет информацию об одобренных лекарствах на сайте Orange Book.
В Великобритании Агентство по регулированию лекарственных средств и товаров медицинского назначения утверждает и оценивает лекарства для использования. Обычно утверждение в Великобритании и других европейских странах происходит позже, чем в США. Затем Национальный институт здравоохранения и повышения квалификации (NICE) для Англии и Уэльса решает, разрешит ли и как Национальная служба здравоохранения (NHS) (в смысле оплаты) их использования. Британский национальный фармакологический справочник - это основное руководство для фармацевтов и клиницистов.
Во многих западных странах за пределами США возникло «четвертое препятствие» анализа экономической эффективности, прежде чем можно было предоставить новые технологии. При этом основное внимание уделяется «цене эффективности» (например, стоимости за QALY ) рассматриваемых технологий. В Англии и Уэльсе NICE решает, будут ли лекарства и технологии доступны в NHS и при каких обстоятельствах, в то время как аналогичные договоренности существуют с Шотландским консорциумом лекарственных средств в Шотландии и Консультативным комитетом по фармацевтическим льготам в Австралии. Если продукт должен быть одобрен, он должен преодолеть порог рентабельности. Лечение должно отражать «соотношение цены и качества» и приносить пользу обществу.
Существуют особые правила для некоторых редких заболеваний («орфанных болезней») в нескольких крупных регулирующих территориях, регулирующих лекарства. Например, заболевания, затрагивающие менее 200 000 пациентов в Соединенных Штатах или более крупные группы населения при определенных обстоятельствах, подпадают под действие Закона о лекарствах для сирот. Поскольку медицинские исследования и разработка лекарств для лечения таких заболеваний невыгодны с финансовой точки зрения, компании, которые поступают таким образом, вознаграждаются снижением налогов, освобождением от платы и эксклюзивностью на рынке этого лекарства в течение ограниченного времени (семь лет), независимо от того, защищено ли лекарство. патентами.
| Компания | Продажи фармацевтических препаратов. (млн долларов США) |
|---|---|
| Pfizer | 45 083 |
| GlaxoSmithKline | 40,156 |
| Sanofi-Aventis | 38,555 |
| Roche | 27,290 |
| AstraZeneca | 26,475 |
| Johnson Johnson | 23,267 |
| Novartis | 22,576 |
| Merck Co | 20,375 |
| Wyeth | 16,884 |
| Лилли | 15,691 |
| Bristol-Myers Squibb | 13861 |
| Boehringer Ingelheim | 13860 |
| Amgen | 13 858 |
| Abbott Laboratories | 12395 |
| Bayer | 10162 |
| Такеда | 8716 |
| Schering-Plough | 8,561 |
| Teva | 7,821 |
| Genentech | 7640 |
| Астеллас | 7,390 |
| Ново Нордиск | 7,087 |
| Дайичи Санкё | 6,790 |
| Бакстер Интернэшнл | 6,461 |
| Merck KGaA | 5,643 |
| Eisai | 4,703 |
В 2011 году глобальные расходы на рецептурные лекарства превысили 954 миллиарда долларов, несмотря на то, что рост в Европе и Северной Америке несколько замедлился. На Соединенные Штаты приходится более трети мирового фармацевтического рынка, годовой объем продаж которых составляет 340 миллиардов долларов, за ними следуют ЕС и Япония. Развивающиеся рынки, такие как Китай, Россия, Южная Корея и Мексика, опередили этот рынок, увеличившись на 81 процент.
Десять самых продаваемых лекарств в 2013 году составили 75,6 миллиарда долларов продаж, включая противовоспалительный препарат Хумира - самый продаваемый препарат в мире с продажами в 10,7 миллиарда долларов. Вторым и третьим по популярности оказались Enbrel и Remicade соответственно. В тройку самых продаваемых лекарств в США в 2013 году вошли Abilify (6,3 миллиарда долларов), Nexium (6 миллиардов долларов) и Humira (5,4 миллиарда долларов). Самый продаваемый препарат, Lipitor, приносил в среднем 13 миллиардов долларов в год и принес 141 миллиард долларов за все время своего существования до истечения срока действия патента Pfizer в ноябре 2011 года.
IMS Health публикует анализ тенденций, ожидаемых в фармацевтическая промышленность в 2007 году, включая увеличение прибыли в большинстве секторов, несмотря на потерю некоторых патентов, и появление новых «блокбастеров» на горизонте.
В зависимости от ряда факторов, компания может подать заявку и получить патент на препарат или процесс производства препарата, предоставляя эксклюзивные права, как правило, на срок около 20 лет. Однако только после тщательного изучения и тестирования, которое занимает в среднем от 10 до 15 лет, государственные органы дадут компании разрешение на маркетинг и продажу препарата. Патентная защита позволяет владельцу патента возмещать затраты на исследования и разработки за счет высокой маржи препарата. По истечении срока патентной защиты лекарственного средства генерик обычно разрабатывается и продается конкурирующей компанией. Разработка и одобрение дженериков обходятся дешевле, что позволяет продавать их по более низкой цене. Часто владелец фирменного препарата представляет непатентованную версию до истечения срока действия патента, чтобы получить фору на рынке дженериков. Таким образом, реструктуризация стала обычным делом из-за истечения срока действия патентов на продукты, выпущенные в «золотую эру» отрасли в 1990-х годах, и неспособности компаний разработать достаточное количество новых продуктов-блокбастеров для замещения упущенных доходов.
В США стоимость рецептов увеличивалась с 1995 по 2005 год на 3,4 миллиарда в год, т.е. на 61 процент. Розничные продажи рецептурных лекарств подскочили на 250 процентов с 72 миллиардов долларов до 250 миллиардов долларов, в то время как средняя цена рецептурных препаратов увеличилась более чем вдвое с 30 долларов до 68 долларов.
Реклама распространены в медицинских журналах, а также в более распространенных СМИ. В некоторых странах, особенно в США, им разрешено размещать рекламу непосредственно для широкой публики. Фармацевтические компании обычно нанимают продавцов (часто называемых «фармацевтическими представителями» или, как более старый термин, «медперсоналом») для непосредственного и личного маркетинга врачам и другим поставщикам медицинских услуг. В некоторых странах, особенно в США, фармацевтические компании также используют лоббистов, чтобы влиять на политиков. Маркетинг рецептурных лекарств в США регулируется федеральным Законом о маркетинге рецептурных препаратов 1987 года.
В книге Плохая фармацевтика также обсуждается влияние представителей лекарственных средств., как фармацевтические компании нанимают авторов-призраков для написания статей для ученых для публикации, насколько на самом деле независимы академические журналы, как фармацевтические компании финансируют непрерывное обучение врачей и как группы пациентов часто финансируются промышленностью.
С 1980-х годов стали важны новые методы маркетинга рецептурных лекарств для потребителей. Медийная реклама, ориентированная на потребителей, была легализована в Руководстве FDA для индустрии по широковещательной рекламе, ориентированной на потребителей.
Споры вокруг фармацевтического маркетинга и влияния нарастают. Были обвинения и выводы о влиянии на врачей и других медицинских работников через фармацевтических представителей, включая постоянное предоставление маркетинговых «подарков» и предвзятой информации медицинским работникам; широко распространенная реклама в журналах и на конференциях; финансирование независимых организаций здравоохранения и кампаний по укреплению здоровья; лоббирование врачей и политиков (больше, чем в любой другой отрасли в США); спонсорство медицинских школ или обучение медсестер; спонсорство продолжающихся образовательных мероприятий, влияющих на учебную программу; и наем врачей в качестве оплачиваемых консультантов в медицинские консультативные советы.
Некоторые группы защиты, такие как No Free Lunch и AllTrials, критикуют влияние маркетинга лекарств на врачей, потому что они говорят, что врачи склонны выписывать продаваемые лекарства. даже когда другие могут быть дешевле или лучше для пациента.
Были подобные обвинения в разжигании болезней (чрезмерной медикаментозной терапии) с целью расширения рынка лекарств. Инаугурационная конференция по этой теме прошла в Австралии в 2006 году. В 2009 году финансируемая правительством Национальная служба прописывания запустила программу «Поиск доказательств - признание шумихи», направленную на обучение врачей общей практики о методах независимого анализа наркотиков.
Мета-анализ показал, что психиатрические исследования, спонсируемые фармацевтическими компаниями, в несколько раз чаще дадут положительные результаты, а если задействован сотрудник фармацевтической компании, эффект еще больше. Влияние также распространилось на подготовку врачей и медсестер в медицинских школах, с чем ведется борьба.
Утверждалось, что дизайн Диагностического и статистического руководства по психическим расстройствам и расширение критериев представляют собой растущую медикализацию человеческой природы или «разжигание болезней ", вызванное влиянием фармацевтических компаний на психиатрию. Возникла вероятность прямого конфликта интересов, отчасти потому, что примерно половина авторов, которые выбрали и определили психические расстройства DSM-IV, имели или ранее имели финансовые отношения с фармацевтической промышленностью.
В США, начиная с 2013 года, в соответствии с Отчетами о финансовой прозрачности врачей (часть Закона о солнечном свете) Центры услуг Medicare и Medicaid должны собирать информацию от соответствующих производителей и групповых закупочных организаций, чтобы сообщать информацию о своих финансовых отношениях с врачи и больницы. Данные публикуются на веб-сайте Центров услуг Medicare и Medicaid. Ожидается, что отношения между врачами и фармацевтической промышленностью станут полностью прозрачными.
В отчете, подготовленном Центром отзывчивой политики, более 1100 лоббистов работали в той или иной степени на фармацевтического бизнеса в 2017 году. В первом квартале 2017 года производители товаров для здоровья и фармацевтическая промышленность потратили 78 миллионов долларов на лоббирование членов Конгресса США.
Бен Голдакр утверждал, что регуляторы - например, Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) в Великобритании или Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в США - продвигают интересы фармацевтических компаний. вместо интересов общества из-за постоянного обмена сотрудниками между регулирующим органом и компаниями, а также между регулирующим органом и сотрудниками компании развиваются дружеские отношения. Он утверждает, что регулирующие органы не требуют, чтобы новые лекарства предлагали улучшения по сравнению с уже имеющимися, или даже чтобы они были особенно эффективными.
Другие утверждали, что чрезмерное регулирование подавляет терапевтические инновации и что текущие затраты регулирующего органа - необходимые клинические испытания препятствуют полноценному использованию новых генетических и биологических знаний для лечения болезней человека. В отчете Совета советников президента по науке и технологиям за 2012 год содержится несколько ключевых рекомендаций по снижению нормативной нагрузки на разработку новых лекарств, в том числе 1) расширение использования FDA ускоренных процессов утверждения, 2) создание ускоренного пути утверждения для лекарств, предназначенных для использования. в узко определенных группах населения, и 3) осуществление пилотных проектов, предназначенных для оценки осуществимости нового адаптивного процесса утверждения лекарств.
Фармацевтическое мошенничество включает в себя обманы, которые приносят финансовую выгоду фармацевтическим предприятиям. Компания. Это затрагивает отдельных лиц и общественность и. Существует несколько различных схем, используемых для обмана системы здравоохранения, характерных для фармацевтической промышленности. К ним относятся: нарушения надлежащей производственной практики (GMP), внепрограммный маркетинг, мошенничество с лучшими ценами, мошенничество с CME, ценовая отчетность по программе Medicaid и готовые лекарственные препараты. Из этой суммы 2,5 миллиарда долларов было получено в результате рассмотрения дел, связанных с Законом о ложных претензиях в 2010 финансовом году. Примеры случаев мошенничества включают урегулирование GlaxoSmithKline 3 миллиарда долларов, урегулирование Pfizer 2,3 миллиарда долларов и Merck Co Расчет на 650 миллионов долларов. Ущерб от мошенничества может быть возмещен с помощью Закона о ложных исках, чаще всего в соответствии с положениями qui tam, которые вознаграждают человека за то, что он является «осведомителем », или relator (закон).
Каждая крупная компания, продающая антипсихотические препараты - Bristol-Myers Squibb, Eli Lilly and Company, Pfizer, AstraZeneca и Johnson Johnson - либо урегулировала недавние правительственные дела в соответствии с Законом о ложных исках на сотни миллионов долларов, либо в настоящее время расследуется на предмет возможного мошенничества в сфере здравоохранения. По обвинению в незаконном маркетинге в прошлом году два поселения установили рекорд по самым крупным уголовным штрафам, когда-либо наложенных на корпорации. Одно касалось антипсихотического средства Эли Лилли Зипрекса, а другое - Бекстры. В случае с Bextra правительство также обвинило Pfizer в незаконном сбыте другого антипсихотического средства, Geodon ; Pfizer урегулировал эту часть иска на сумму 301 миллион долларов, не признавая никаких правонарушений.
2 июля 2012 года GlaxoSmithKline признал себя виновным по уголовным обвинениям и согласился на выплату 3 миллиардов долларов в отношении самого крупного ущерба - дело о мошенничестве в сфере медицинского обслуживания в США и крупнейший платеж фармацевтической компании. Мировое соглашение связано с незаконным продвижением компанией рецептурных лекарств, непредставлением данных о безопасности, подкупом врачей и продвижением лекарств для целей, для которых у них не было лицензии. Были задействованы следующие препараты: Паксил, Веллбутрин, Адваир, Ламиктал и Зофран, не по назначению. -крытые использует. Эти и препараты Imitrex, Lotronex, Flovent и Valtrex были задействованы в схеме отката.
. представляет собой список из четырех крупнейших расчетов, достигнутых с фармацевтическими компаниями с 1991 по 2012 год, в порядке убывания общей суммы расчетов. Судебные иски к фармацевтической промышленности за последние два десятилетия сильно различались, в том числе мошенничество с Medicare и Medicaid, промоушн и ненадлежащая производственная практика.
| Компания | Урегулирование | Нарушение(s) | Год | Продукт(s) | Якобы нарушенные законы. (если применимо) |
|---|---|---|---|---|---|
| GlaxoSmithKline | 3 миллиарда долларов | Рекламная акция вне лейбла /. непредоставление данных по безопасности | 2012 | Avandia / Wellbutrin / Paxil | Закон о ложных исках / FDCA |
| Pfizer | 2,3 миллиарда долларов | Промоакция вне лейбла / откаты | 2009 | Bextra / Geodon /. Zyvox / Lyrica | Закон о ложных претензиях / FDCA |
| Abbott Laboratories | 1,5 миллиарда долларов | Промоакция вне лейбла | 2012 | Depakote | Закон о ложных заявлениях / FDCA |
| Eli Lilly | 1,4 миллиарда долларов | Промоакция вне лейбла | 2009 | Zyprexa | False Закон о претензиях / FDCA |
Па палатки подвергались критике в развивающихся странах, поскольку считалось, что они ограничивают доступ к существующим лекарствам. Сочетание патентов и всеобщего доступа к лекарствам потребует эффективной международной политики ценовой дискриминации. Более того, в соответствии с соглашением TRIPS Всемирной торговой организации страны должны разрешить патентование фармацевтических продуктов. В 2001 году ВТО приняла Дохинскую декларацию, в которой указывается, что соглашение ТРИПС следует читать с учетом целей общественного здравоохранения, и разрешены некоторые методы обхода фармацевтических монополий: через принудительное лицензирование или параллельный импорт, даже до истечения срока действия патента.
В марте 2001 г. 40 транснациональных фармацевтических компаний подали иски против Южной Африки за ее лекарства. Закон, который разрешил производство дженериков антиретровирусных препаратов (АРВ) для лечения ВИЧ, несмотря на то, что эти препараты были запатентованы. ВИЧ был и остается эпидемией в Южной Африке, и АРВ-препараты в то время стоили от 10 000 до 15 000 долларов США на пациента в год. Это было недоступно для большинства граждан Южной Африки, поэтому правительство Южной Африки обязалось предоставлять АРВ-препараты по ценам, близким к тем, которые люди могли себе позволить. Для этого им придется игнорировать патенты на лекарства и производить генерики внутри страны (используя принудительную лицензию) или импортировать их из-за границы. После международного протеста в пользу прав общественного здравоохранения (включая сбор 250 000 подписей организацией Médecins Sans Frontières ) правительства нескольких развитых стран (включая Нидерланды, Германию, Францию, а затем и США) поддержали Правительство ЮАР, и дело было прекращено в апреле того же года.
В 2016 году GlaxoSmithKline (шестая по величине фармацевтическая компания в мире) объявила, что она откажется от своих патентов в бедных странах, чтобы позволить независимым компаниям производить и продавать версии своих лекарств в этих областях, тем самым расширяя доступ к ним общественности. GlaxoSmithKline опубликовала список из 50 стран, в которых они больше не будут иметь патенты, что затронуло один миллиард человек во всем мире.
В 2011 году четыре из 20 крупнейших корпоративных благотворительных пожертвований и восемь из 30 крупнейших корпоративных благотворительных пожертвований поступили от производителей фармацевтической продукции. Основная часть корпоративных благотворительных пожертвований (69% по данным на 2012 год) поступает в виде безналичных благотворительных пожертвований, большинство из которых опять же являются пожертвованиями фармацевтических компаний.
Благотворительные программы и усилия фармацевтических компаний по открытию и разработке лекарств включают: