| Иммунотерапия | |
|---|---|
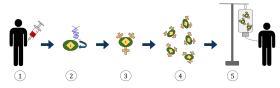 На диаграмме выше представлен процесс химерного антигенного рецептора T -клеточная терапия (CAR), это метод иммунотерапии, который получает все большее распространение в лечении рака. Конечным результатом должно быть производство оснащенных Т-клеток, которые могут распознавать инфицированные раковые клетки в организме и бороться с ними. На диаграмме выше представлен процесс химерного антигенного рецептора T -клеточная терапия (CAR), это метод иммунотерапии, который получает все большее распространение в лечении рака. Конечным результатом должно быть производство оснащенных Т-клеток, которые могут распознавать инфицированные раковые клетки в организме и бороться с ними.
| |
| MeSH | D007167 |
| Код OPS-301 | 8-03 |
| [редактировать в Викиданных ] | |
Иммунотерапия или биологическая терапия - это лечение болезни путем активации или подавления иммунной системы. Иммунотерапия, разработанная для вызова или усиления иммунного ответа, классифицируется как активационная иммунотерапия, тогда как иммунотерапия, которая снижает или подавляет, классифицируется как супрессивная иммунотерапия.
В последние годы иммунотерапия стала очень популярной. интерес для исследователей, клиницистов и фармацевтических компаний, особенно в плане лечения различных форм рака.
Иммуномодулирующие схемы часто имеют меньше побочных эффектов, чем существующие лекарства, включая меньший потенциал для создания устойчивость при лечении микробных заболеваний.
Иммунотерапия на основе клеток эффективна при некоторых видах рака. Иммунные эффекторные клетки, такие как лимфоциты, макрофаги, дендритные клетки, естественные киллерные клетки (NK-клетки), цитотоксические Т-лимфоциты (CTL) и т. Д. Работают вместе, чтобы защитить организм от рака, воздействуя на аномальные антигены, экспрессируемые на поверхности опухолевых клеток.
Терапия, такая как гранулоцитарный колониестимулирующий фактор (G-CSF), интерфероны, имиквимод и фракции клеточных мембран из бактерий имеют лицензию на медицинское использование. Прочие, включая IL-2, IL-7, IL-12, различные хемокины, синтетические цитозинфосфат-гуанозиновые (CpG) олигодезоксинуклеотиды и глюканы участвуют в клинических и доклинических исследованиях.
Иммуномодуляторы - активные агенты иммунотерапии. Это разнообразные рекомбинантные, синтетические и натуральные препараты.
| Класс | Примеры агентов |
|---|---|
| Интерлейкины | ИЛ-2, ИЛ-7, ИЛ-12 |
| Цитокины | Интерфероны, G-CSF |
| Хемокины | CCL3, CCL26, CXCL7 |
| Иммуномодулирующие имидные препараты (IMiDs) | талидомид и его аналоги (леналидомид, помалидомид и апремиласт ) |
| Прочие | цитозинфосфат-гуанозин, олигодезоксинуклеотиды, глюканы |
Раньше лечение рака было направлено на уничтожение или удаление раковых клеток и опухолей с помощью химиотерапии, хирургического вмешательства или облучения. Эти методы лечения могут быть очень эффективными и во многих случаях являются в 2018 году Нобелевская премия по физиологии и медицине была присуждена Джеймсу П. Эллисону и Тасуку Хондзё «за открытие лечения рака путем ингибирования отрицательная иммунная регуляция ». Иммунотерапия рака пытается стимулировать иммунную систему для разрушения опухолей. рейтинги используются или проходят исследования и испытания. Сообщалось о рандомизированных контролируемых исследованиях различных видов рака, приводящих к значительному увеличению выживаемости и периода без болезни, и их эффективность повышается на 20–30%, когда клеточная иммунотерапия сочетается с традиционными методами лечения.
Один из наиболее эффективных методов лечения. старейшими формами иммунотерапии рака является использование вакцины БЦЖ, которая первоначально предназначалась для вакцинации против туберкулеза, а позже было обнаружено, что она полезна при лечении рака мочевого пузыря. Иммунотерапия БЦЖ вызывает как местные, так и системные иммунные ответы. Механизмы, с помощью которых иммунотерапия БЦЖ опосредует противоопухолевый иммунитет, широко изучены, но до сих пор не до конца изучены.
Использование моноклональных антител в терапии рака было впервые представлено в 1997 году с ритуксимаб, антитело к CD20 для лечения В-клеточной лимфомы. С тех пор несколько моноклональных антител были одобрены для лечения различных гематологических злокачественных новообразований, а также солидных опухолей.
Извлечение G-CSF лимфоцитов из крови и размножение in vitro против опухолевого антигена перед повторной инъекцией клеток с соответствующими стимулирующими цитокинами. Затем клетки разрушают опухолевые клетки, которые экспрессируют антиген. Для местной иммунотерапии используется крем для усиления иммунитета (имиквимод ), который продуцирует интерферон, вызывая убийство реципиента Т-клетки для уничтожения бородавок, актинических кератозов, базальноклеточного рака, вагинальной интраэпителиальной неоплазии, плоскоклеточного рака, кожного лимфома и поверхностная злокачественная меланома. В инъекционной иммунотерапии («внутри очага поражения» или «внутри опухоли») используются инъекции эпидемического паротита, кандидоза, вакцины против ВПЧ или антигена для лечения бородавок (опухоли, индуцированные ВПЧ).
Перенос адоптивных клеток был протестирован на легких и других раковых опухолях, с наибольшим успехом, достигнутым при меланоме.
Дендритные клетки (DC) можно стимулировать для активации цитотоксической реакции на антиген. Дендритные клетки, тип антигенпрезентирующих клеток, собирают у человека, нуждающегося в иммунотерапии. Затем в эти клетки либо вводят антиген, либо опухолевый лизат, либо трансфицируют с помощью вирусного вектора, заставляя их отображать антиген. После трансфузии человеку эти активированные клетки представляют антиген эффекторным лимфоцитам (CD4 + хелперные Т-клетки, цитотоксические CD8 + Т-клетки и В-клетки ). Это инициирует цитотоксический ответ против опухолевых клеток, экспрессирующих антиген (против которых теперь примирован адаптивный ответ). противораковая вакцина Sipuleucel-T является одним из примеров этого подхода.
Современные подходы к вакцинации на основе DC в основном основаны на антигене. нагрузка на DC, созданные in vitro из моноцитов или CD34 + клеток, активация их различными лигандами TLR, комбинациями цитокинов и инъекция их обратно к пациентам. Подходы нацеливания in vivo включают введение специфических цитокинов (например, Flt3L, GM-CSF ) и нацеливание на DC антителами к рецепторам лектинов C-типа или агонистических антителах (например, анти- CD40 ), которые конъюгированы с представляющим интерес антигеном. В будущем подход может быть направлен на подмножества DC на основе их специфически экспрессируемых рецепторов лектина C-типа или рецепторов хемокинов. Другим потенциальным подходом является создание генно-инженерных DC из индуцированных плюрипотентных стволовых клеток и использование неоантиген -загруженных DC для улучшения клинического исхода.
Перенос адоптивных клеток in vitro выращивает аутологичные извлеченные Т-клетки для последующего переливания.
В качестве альтернативы Т-клетки, полученные с помощью генной инженерии, создаются путем сбора Т-клетки, а затем инфицирование Т-клеток ретровирусом , который содержит копию гена рецептора Т-клеток (TCR), который специализируется на распознавании опухолевых антигенов. Вирус интегрирует рецептор в геном Т-клеток. Клетки неспецифично размножаются и / или стимулируются. Затем клетки повторно вводят и вызывают иммунный ответ против опухолевых клеток. Метод был протестирован на рефрактерных метастатических меланомах стадии IV и распространенном раке кожи.
Независимо от того, являются ли Т-клетки генно-инженерными или нет, перед повторной инфузией требуется лимфодеплеция реципиента для устранения регуляторных Т-клеток, а также немодифицированных эндогенных лимфоциты, которые конкурируют с перенесенными клетками за гомеостатические цитокины. Лимфодеплеции можно добиться с помощью миелоаблативной химиотерапии, к которой для большего эффекта можно добавить общее облучение тела. Перенесенные клетки размножались in vivo и сохранялись в периферической крови у многих людей, иногда составляя 75% всех CD8 Т-клеток через 6–12 месяцев после инфузии. По состоянию на 2012 год клинические испытания метастатической меланомы продолжались в нескольких центрах. Клинические реакции на адоптивный перенос Т-клеток наблюдались у пациентов с метастатической меланомой, устойчивой к множественным иммунотерапевтам.
Анти-PD-1 / PD-L1 и антитела против CTLA-4 - это два типа ингибиторов контрольных точек, доступных в настоящее время для пациентов: одобрение антицитотоксического белка 4, связанного с Т-лимфоцитами (CTLA-4 ), и белка 1 против запрограммированной гибели клеток (PD- 1 ) антитела для использования человеком уже привели к значительному улучшению исходов заболеваний для различных видов рака.
Хотя эти молекулы были первоначально обнаружены как молекулы, играющие роль в активации Т-клеток или апоптоз, последующие доклинические исследования показали их важную роль в поддержании периферической иммунной толерантности.
Ингибиторы иммунных контрольных точек одобрены для лечения некоторых пациентов с различными типами рака, включая меланому, рак груди, рак мочевого пузыря, рак шейки матки эр, рак толстой кишки, рак головы и шеи или лимфома Ходжкина.
Эти методы лечения произвели революцию в иммунотерапии рака, как они показали для Впервые за многие годы исследований метастатической меланомы, которая считается одним из наиболее иммуногенных раковых опухолей человека, улучшилась общая выживаемость, при этом у растущей группы пациентов, пользующихся длительным лечением,
Терапия по усилению аутологичного иммунитета использует полученные из периферической крови собственные естественные клетки-киллеры, цитотоксические Т-лимфоциты, эпителиальные клетки и другие соответствующие иммунные клетки размножаются in vitro, а затем повторно вводятся. Терапия была протестирована против гепатита C, синдрома хронической усталости и HHV6 инфекции.
Подавление иммунитета подавляет аномальный иммунный ответ при аутоиммунных заболеваниях или снижает нормальный иммунный ответ для предотвращения отторжения пересаженных органов или клетки.
Иммунодепрессанты помогают при трансплантации органов и аутоиммунных заболеваниях. Иммунные ответы зависят от пролиферации лимфоцитов. Цитостатические препараты обладают иммунодепрессивным действием. Глюкокортикоиды являются несколько более специфическими ингибиторами активации лимфоцитов, тогда как ингибиторы иммунофилинов более специфично нацелены на активацию Т-лимфоцитов. Иммуносупрессивные антитела нацелены на этапы иммунного ответа. Другие препараты модулируют иммунные ответы и могут использоваться для индукции иммунной регуляции. В доклинических испытаниях было замечено, что регуляция иммунной системы небольшими иммуносупрессивными молекулами, такими как витамин D и дексаметазон, вводимые в режиме низких доз и подкожно, могут быть полезны для предотвращения или лечения хронического воспаления.
Организм, естественно, не атакует свои собственные ткани иммунной системой. Модели обычно идентифицируют CD4 + Т-клетки в центре аутоиммунного ответа. Затем потеря толерантности Т-клеток высвобождает В-клетки и другие иммунные эффекторные клетки к ткани-мишени. Идеальная толерогенная терапия была бы нацелена на конкретный клон (ы) Т-клеток, координирующих аутоиммунную атаку.
Терапия иммунной толерантности направлена на то, чтобы перезагрузить иммунную систему, чтобы организм перестал ошибочно атаковать собственные органы или клетки при аутоиммунном заболевании или принимают чужеродную ткань при трансплантации органов. Недавний терапевтический подход заключается в инфузии регуляторных иммунных клеток реципиентам трансплантата. Перенос регуляторных иммунных клеток может подавлять активность эффектора.
Создание иммунной толерантности снижает или устраняет необходимость в пожизненной иммуносупрессии и сопутствующих побочных эффектах. Он был протестирован на трансплантации, ревматоидном артрите, диабете 1 типа и других аутоиммунных заболеваниях.
| Метод | Подробности | ||
| Неантигенспецифические | • Моноклональные антитела | Истощающие Анти-CD52 Анти- CD4 Анти-LFA2 | Неистощающий Анти-CD4 Анти-CD3 Анти-LFA-1 CTLA4- Ig Анти-CD25 |
| • Трансплантация гемопоэтических стволовых клеток | Немиелоаблативные | Миелоаблативные | |
| • Трансплантация мезенхимальных стволовых клеток | |||
| • Регуляторная терапия Т-клетками | Неантигенспецифический | Антигенспецифический | |
| • Низкая доза ИЛ-2 для увеличения регуляторных Т-клеток | |||
| • Манипуляции с микробиомом | |||
| Антигенспецифичность | • Пептидная терапия | Подкожное, внутрикожное, слизистое (пероральное, вдыхаемое) Толерогенные дендритные клетки, липосомы и наночастицы | |
| • Измененные пептидные лиганды | |||
Иммунотерапия также может использоваться для лечения аллергия. В то время как лечение аллергии (например, антигистаминные препараты или кортикостероиды ) лечат аллергические симптомы, иммунотерапия может снизить чувствительность к аллергенам, уменьшив ее тяжесть.
Иммунотерапия может дать долгосрочные преимущества. Иммунотерапия частично эффективна для одних людей и неэффективна для других, но дает страдающим аллергией шанс уменьшить или остановить их симптомы.
Терапия показана людям с сильной аллергией или тем, кто не может избежать определенных аллергенов.
IgE-опосредованных пищевой аллергии - это глобальная проблема здоровья, которая затрагивает миллионы людей и влияет на все аспекты жизни пациента. Перспективным подходом к лечению пищевой аллергии является использование пероральной иммунотерапии (OIT). OIT заключается в постепенном воздействии увеличивающегося количества аллергена, что может привести к тому, что большинство субъектов будут переносить дозы пищи, достаточные для предотвращения реакции на случайное воздействие. Дозировки со временем увеличиваются, поскольку человек теряет чувствительность. Этот метод был опробован на младенцах для предотвращения аллергии на арахис.
Аллерген-специфическая иммунотерапия (ASIT) стала золотым стандартом для лечения аллергических заболеваний, опосредованных IgE, для большого количества аллергенов. Можно с любопытством ожидать новых разработок, которые еще больше улучшат наше понимание механизмов аллергии и улучшат ASIT для следующих поколений пациентов и врачей.
Whipworm ova (Trichuris suis) и Hookworm (Necator americanus) были протестированы на иммунологические заболевания и аллергии. Гельминтная терапия была исследована в качестве лечения рецидивирующего ремиттирующего рассеянного склероза болезни Крона, аллергии и астмы. Механизм того, как гельминты модулируют иммунный ответ, неизвестен. Предполагаемые механизмы включают переполяризацию ответа Th1 / Tdiv class="ht" и модуляцию функции дендритных клеток. Гельминты подавляют активность провоспалительных цитокинов Th1, интерлейкина-12 (IL-12), интерферона-гамма (IFN-γ) и фактора некроза опухоли-альфа (TNF-), стимулируя продукцию регуляторных цитокинов Tdiv class="ht", таких как IL-10, IL-4, IL-5 и IL-13.
Совместная эволюция с гельминтами сформировала некоторые из генов, связанных с экспрессией интерлейкина и иммунологическими нарушениями, такими как болезнь Крона, язвенный колит и глютеновая болезнь. Отношения гельминтов с людьми как хозяевами следует классифицировать как мутуалистические или симбиотические.