| бета-глюкуронидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Глюкуронидаза Гомотетрамер. (предполагаемая биологическая единица) Глюкуронидаза Гомотетрамер. (предполагаемая биологическая единица) | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 3.2.1.31 | ||||||||
| Номер CAS | 9001-45-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Обзор NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| глюкуронидаза, бета | |
|---|---|
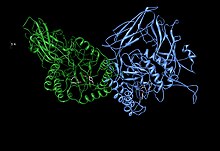 Асимметричная единица бета-глюкуронидазы, показывающая остатки активного сайта Glu451, Tyr504 и Glu540 вместе с t Потенциально поддерживающий остаток Asn450 Асимметричная единица бета-глюкуронидазы, показывающая остатки активного сайта Glu451, Tyr504 и Glu540 вместе с t Потенциально поддерживающий остаток Asn450 | |
| Идентификаторы | |
| Символ | GUSB |
| Ген NCBI | 2990 |
| HGNC | 4696 |
| OMIM | 611499 |
| RefSeq | NM_000181 |
| UniProt | P08236 |
| Другие данные | |
| Номер EC | 3.2.1.31 |
| Locus | Chr. 7 q11.21 |
Бета-глюкуронидазы являются членами семейства гликозидаз из ферментов, которые катализируют распад комплекса углеводы. Человеческая β-глюкуронидаза представляет собой тип глюкуронидазы (член семейства гликозидаз 2), который катализирует гидролиз остатков β-D- глюкуроновой кислоты с невосстанавливающего конца мукополисахариды (также упоминаемые как гликозаминогликаны ), такие как гепарансульфат. Человеческая β-глюкуронидаза находится в лизосоме. В кишечнике щеточная кайма β-глюкуронидаза превращает конъюгированный билирубин в неконъюгированную форму для реабсорбции. Бета-глюкуронидаза также присутствует в грудном молоке, что способствует неонатальной желтухе. Белок кодируется геном GUSB у человека и геном uidA у бактерий.
β-глюкуронидаза человека синтезируется в виде 80 кДа мономер (653 аминокислоты ) до протеолиза удаляет 18 аминокислот с С-концевого конца до образуют мономер 78 кДа. Бета-глюкуронидаза существует в виде гомотетрамера 332 кДа . Бета-глюкуронидаза содержит несколько примечательных структурных образований, в том числе тип бета-цилиндра, известный как цилиндр желе-ролла, и цилиндр TIM.
β-глюкуронидаза человека гомологичен ферменту Escherichia coli, β-галактозидаза. Это гомологичное отношение, а также знание того, что гликозидазы часто проводят гидролиз, катализируемый двумя кислотными остатками, позволили разработать механистическую гипотезу. Эта гипотеза предполагает, что два остатка глутаминовой кислоты Glu540 и Glu451 являются нуклеофильными и кислотными остатками, соответственно, и что тирозиновый остаток Tyr504 также участвует в катализе. В поддержку этой гипотезы экспериментальные мутации в любом из этих трех остатков приводят к значительному снижению ферментативной активности. Повышенная активность мутантного фермента E451A (где Glu451 заменен остатком аланина ) после добавления азида согласуется с Glu451 в качестве кислотно-основного остатка. Используя анализ меченых пептидов β-глюкуронидазы после гидролиза субстрата, который вступает в очень стабильную промежуточную стадию, исследователи определили, что Glu540 является нуклеофильным остатком.
Хотя конкретный тип нуклеофильное замещение, используемое β-глюкуронидазой, неясно, данные о механизмах их гомологов в семействе гликозидаз предполагают, что эти реакции являются качественно SN2 реакциями. Реакции протекают через переходное состояние с характеристиками иона оксокарбения. Первоначально эти механизмы, из-за этой оксокарбениевой характеристики переходного состояния, были предложены как SN1 реакции, протекающие через дискретный оксокарбениевый ион промежуточное соединение. Однако более поздние данные свидетельствуют о том, что эти состояния ионов оксокарбения имеют время жизни 10 фемтосекунд - 0,1 наносекунды (аналогично периоду колебаний связи ). Эти времена жизни слишком короткие, чтобы относить их к промежуточному продукту реакции. Из этих данных следует, что эти реакции, хотя и имеют вид S N 1 из-за характеристик ионов оксокарбения в их переходных состояниях, качественно должны быть реакциями S N 2.
Специфическая активность Tyr504 в каталитическом механизме неясна. На основе сравнения структурных данных гомологичного фермента ксиланазы было высказано предположение, что Tyr504 β-глюкуронидазы может стабилизировать уходящий нуклеофил (Glu540) или модулировать его активность.
В дополнение к Эти остатки, консервативный остаток аспарагина (Asn450) был предложен для стабилизации субстрата за счет действия водородной связи у 2-гидроксильной группы сахарного субстрата.

Повторяющаяся единица гепарансульфата субстрат β-глюкуронидазы

Изображение на поверхности кармана активного сайта β-глюкуронидазы с каталитическими остатками

Механизм гидролиза β-глюкуронидазой сахарного субстрата с высокоэнергетическими переходными состояниями изображен характер оксокарбениевого иона
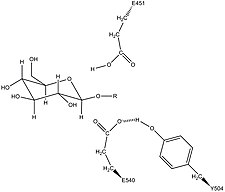
Возможная стабилизация нуклеофильного остатка Glu540 с помощью Tyr504 в β-глюкуронидазе

Прогнозируемая активность консервативного остатка Asn450 в стабилизации сахарного субстрата β-глюкуронидазы

Возможный солевой мостик между Glu35 2 и Arg216 при человеческом бета-глюкуронидазе
Дефицит бета-глюкуронидазы приводит к аутосомно-рецессивному наследственному метаболическому заболеванию, известному как Sly синдром или Мукополисахаридоз VII. Дефицит этого фермента приводит к накоплению негидролизованных мукополисахаридов у пациента. Это заболевание может быть крайне тяжелым для пациента или может привести к водянке плода до рождения. Кроме того, у выживших пациентов наблюдаются умственная отсталость, низкий рост, грубые черты лица, аномалии позвоночника, увеличение печени и селезенки. Это заболевание было смоделировано на группе мышей, а также на семье собак. Совсем недавно исследователи обнаружили семейство кошачьих, у которых наблюдается дефицит активности β-глюкуронидазы. Источник этого снижения активности был идентифицирован как мутация E351K (Glu351 мутирован до остатка лизина). Glu351 является консервативным у видов млекопитающих, что предполагает важную функцию этого остатка. Исследование структуры рентгеновского кристалла человека позволяет предположить, что этот остаток (Glu352 в человеческом ферменте), который заложен глубоко внутри ствола TIM домена, может быть важным для стабилизации третичной структуры фермента. В кристаллической структуре кажется, что Arg216, член домена желеобразного ролика белка, образует солевой мостик с Glu352; следовательно, Glu352, вероятно, участвует в стабилизации взаимодействия между двумя различными трехмерными доменами фермента.
В молекулярной биологии β-глюкуронидаза используется в качестве репортерного гена для мониторинга экспрессии гена в клетках млекопитающих и растений. Мониторинг активности β-глюкуронидазы с помощью анализа GUS позволяет определять пространственную и временную экспрессию рассматриваемого гена.