| Аденокарцинома легкого | |
|---|---|
| Другие названия | Аденокарцинома легкого |
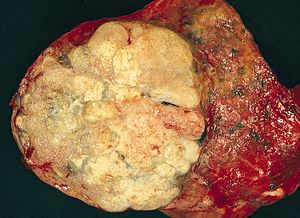 | |
| Макропатологический образец аденокарциномы легкого, удаленный в результате лобэктомии. | |
| Специальность | Онкология |
Аденокарцинома легкого является наиболее распространенным типом рака легкого, и, как и другие формы легкого рак, он характеризуется отчетливыми клеточными и молекулярными особенностями. Он классифицируется как один из нескольких немелкоклеточного рака легкого (НМРЛ), чтобы отличить его от мелкоклеточного рака легкого, который имеет другое поведение и прогноз. Аденокарцинома легкого подразделяется на несколько подтипов и вариантов. Признаки и симптомы этого конкретного типа рака легких аналогичны другим формам рака легких, и пациенты чаще всего жалуются на постоянный кашель и одышку.
Аденокарцинома чаще встречается у пациентов, которые курили сигареты в анамнезе, и является наиболее распространенной формой рака легких у молодых женщин и азиатского населения. Патофизиология аденокарциномы сложна, но обычно следует гистологической прогрессии от клеток, обнаруженных в здоровых легких, до явно дисморфных или неправильных клеток. Есть несколько различных молекулярных и генетических путей, которые способствуют этому прогрессированию. Как и многие другие виды рака легких, аденокарцинома легкого к моменту постановки диагноза часто прогрессирует. После идентификации поражения или опухоли с помощью различных методов визуализации, таких как компьютерная томография (КТ) или рентген, для подтверждения диагноза требуется биопсия.
Лечение этого рака легкого основано на конкретном подтипе и степени распространения от первичной опухоли. Хирургическая резекция, химиотерапия, лучевая терапия, таргетная терапия и иммунотерапия используются в попытке уничтожить раковые клетки на основе этих факторов.
У большинства пациентов с диагностированным раком легких обычно наблюдается местнораспространенный или метастатическое заболевание. Только около трети пациентов на момент постановки диагноза имеют болезнь стадию I. Симптомы, которые проявляет пациент, обычно отражают степень распространения рака. Рак легких, обнаруженный на ранней стадии, может вызывать симптомы, локализованные в дыхательной системе. Однако рак легких на поздних стадиях вызывает у пациентов дополнительные признаки и симптомы, вторичные по отношению к распространению рака на другие системы органов. В порядке наибольшей частоты наиболее частые признаки рака легких включают:
Клиницисты должны иметь высокий уровень подозрения на рак легких, особенно у пациентов с историей курения. Пациенты с повторяющимися или неизлечимыми легочными инфекциями (например, бронхитом и пневмонией), которые не реагируют на антибиотики, также должны быть дополнительно обследованы на предмет рака легких. У некурящих женщин и выходцев из Восточной Азии в более молодом возрасте чаще появляются симптомы основного рака легких. Важно отметить, что многие из этих признаков обычно связаны с другими причинами, не относящимися к раку. У каждого пациента должен быть получен подробный медицинский анамнез, чтобы определить актуальность дальнейшего диагностического обследования и лечения.
Аденокарцинома, как и другие формы рака легких, на момент постановки диагноза обычно прогрессирует или имеет метастазы. Пациенты могут жаловаться на признаки или симптомы за пределами дыхательных путей, которые представляют гематологическое или метаболическое осложнение злокачественного новообразования, но не обязательно в результате непроходимости или метастазов. Они называются паранеопластическими синдромами, которые часто указывают на запущенное заболевание и худший прогноз. Наиболее распространенные паранеопластические синдромы, связанные с аденокарциномой легкого, описаны ниже:
Согласно Исследование здоровья медсестер, риск заболеваемости аденокарциномой легких значительно увеличивается после длительного курения табака : у курильщиков, которые курили в прошлом 30-40 лет, вероятность развития аденокарциномы легких более чем в два раза выше, чем у никогда не куривших (родственник риск приблизительно 2,4); продолжительность более 40 лет увеличивает относительный риск до 5.
Этот рак обычно наблюдается периферически в легких, в отличие от мелкоклеточного рака легкого и плоскоклеточного рака рак легкого, оба из которых, как правило, располагаются в центре, хотя могут возникать и в виде центральных поражений. По неизвестным причинам часто возникает в связи с периферическими рубцами легких. Текущая теория заключается в том, что шрам, вероятно, возник вторично по отношению к опухоли, а не вызвал опухоль. Аденокарцинома чаще встречается у курильщиков и является наиболее распространенным типом рака легких, наблюдаемым у некурящих и женщин. Более глубокое вдыхание сигаретного дыма приводит к периферическим поражениям, которые часто наблюдаются при аденокарциномах легких. Как правило, аденокарцинома растет медленнее и образует меньшие массы, чем другие подтипы. Однако он имеет тенденцию метастазировать на ранней стадии.
 Микрофотография, показывающая ALK-положительную аденокарциному легкого. ALK иммуноокрашивание.
Микрофотография, показывающая ALK-положительную аденокарциному легкого. ALK иммуноокрашивание. Микрофотография, показывающая ROS1-положительную аденокарциному легкого. ROS1 иммуноокрашивание.
Микрофотография, показывающая ROS1-положительную аденокарциному легкого. ROS1 иммуноокрашивание.Крупномасштабные исследования, такие как Атлас генома рака (TCGA), систематически охарактеризовали рецидивирующие соматические изменения, вероятно, способствующие инициации и развитию аденокарциномы легких.
Поскольку курение является сильным мутагенным фактором, аденокарцинома легкого является одним из типов опухолей с наибольшим количеством мутаций. Общие соматические мутации при аденокарциноме легких затрагивают многие онкогены и гены-супрессоры опухоли, включая TP53 (мутировавший в 46% случаев), EGFR (27%), KRAS (32%), KEAP1, STK11 и NF1. Мутации EGFR и KRAS имеют тенденцию проявляться взаимоисключающим образом. Мутации KRAS связаны с привычками к курению, тогда как мутации EGFR чаще встречаются у женщин, людей азиатской национальности и никогда не куривших.
Амплификация числа копий в онкогенах, таких как TERT, Сообщалось о MDM2, EGFR, MET и MYC, а также о делециях генов-супрессоров опухолей, таких как CDKN2A.
. Частые изменения происходят в генах, принадлежащих пути рецепторной тирозинкиназы, наиболее ярким примером которого является EGFR. Этот путь участвует в пролиферации и выживании клеток и часто не регулируется при раке. Как следствие, были разработаны таргетные методы лечения для ингибирования компонентов мутантного пути.
Три мембранно-ассоциированных рецептора тирозинкиназы периодически участвуют в слияниях или перегруппировках в аденокарциномы : ALK, ROS1 и RET, а также более восьмидесяти других транслокаций также были зарегистрированы при аденокарциномах легких.
В перестройках ALK наиболее частым партнерским геном является EML4. Слияния EML4-ALK обычно возникают в опухолях, которые не несут мутации EGFR или KRAS, а также имеют более низкую частоту мутаций TP53. Слияние ALK и ROS открывает возможности для таргетной терапии ингибиторами тирозинкиназы.
Дыхательные пути можно разделить на два основных компонента: проводящие дыхательные пути и газообменные дыхательные пути. Газообменные дыхательные пути состоят из альвеол или небольших микроскопических воздушных мешочков, которые отвечают за обмен кислорода и углекислого газа во время нормального дыхания. Альвеолы состоят из двух типов клеток: пневмоцитов I и II типа. Пневмоциты I типа покрывают 95% альвеолярных поверхностей и не способны к регенерации. Пневмоциты II типа встречаются чаще, составляя 60% клеток альвеолярного эпителия, но составляют только 3% альвеолярной поверхности.
Существует несколько факторов, которые способствуют превращению нормального альвеолярного эпителия в диспластический, или предраковые поражения. Аденокарцинома легких развивается поэтапно, так как пневмоциты II типа претерпевают последовательные молекулярные изменения, которые нарушают нормальную регуляцию и обмен клеток. Атипичная аденоматозная гиперплазия (ААГ) считается предраковым поражением и, как полагают, в дальнейшем прогрессирует до аденокарциномы in situ и инвазивной аденокарциномы легкого. Поражения AAH: <5 mm, can be single or multiple, and have a ground glass appearance on CT imaging. As more genetic mutations and disregulation of normal cell signaling pathways accumulate, AAH can progress to adenocarcinoma in situ (AIS). AIS lesions are classified as small tumors <3 cm with abnormal type II pneumocyte cell growth that is limited to the alveolar spaces i.e. without invasion into the stroma, pleura, or vasculature. This type of growth is termed "lepidic" and is characteristic of adenocarcinoma of the lung in its earliest stages.
Диагноз рака легких можно заподозрить на основании типичных симптомов, особенно у человека с историей курения. Такие симптомы, как кашель с кровью и непреднамеренная потеря веса, могут потребовать дополнительных исследований, таких как медицинская визуализация.
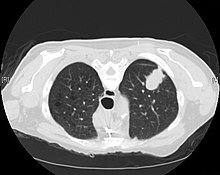 компьютерная томография - аденокарцинома левого легкого
компьютерная томография - аденокарцинома левого легкого Большинство видов рака легких можно охарактеризовать как мелкоклеточный рак легкого (SCLC) или немелкоклеточный рак легкого (NSCLC). Аденокарцинома легкого является одним из трех основных подтипов НМРЛ, которые также включают плоскоклеточную карциному и крупноклеточную карциному.
Исторически сложилось так, что наиболее точный метод описания аденокарциномы легких и несколько пересмотренных систем классификации. Совсем недавно в 2011 году была опубликована Международная мультидисциплинарная классификация аденокарциномы легких, которая представляет собой консенсус нескольких организаций в отношении более точного описания этого конкретного типа рака легких. Текущая система классификации направлена на более надежное прогнозирование прогноза и определение терапевтического лечения.
Размер опухоли, характер роста клеток и глубина клеточной инвазии в нормальную ткань легкого учитываются при определении классификации. Следующие названия представляют собой поэтапное патологическое прогрессирование естественного течения аденокарциномы; Аденокарцинома in situ (AIS), минимально инвазивная аденокарцинома (MIA) и инвазивная аденокарцинома. Инвазивная аденокарцинома легкого включает гетерогенную смесь подтипов и вариантов.
Консенсус 2011 года описывает пять подтипов инвазивных аденокарцином на основе наиболее преобладающего клеточного паттерна. Эти подтипы описаны ниже:
 Гистопатология аденокарциномы с преобладанием лепидных.
Гистопатология аденокарциномы с преобладанием лепидных. Структура клеток, идентифицирующая подтипы, связана с прогнозом от благоприятного (лепидный) до промежуточного (ацинарный и папиллярный) до плохого (микропапиллярный и солидный).
Четыре дискретных варианта инвазивных аденокарцином не относящиеся к этим пяти подтипам, также включены в текущую классификацию:
Рентген грудной клетки (рентгеновский снимок ) часто является первым визуализирующим тестом, выполняемым, когда человек испытывает кашель или боль в груди, особенно в условиях первичной медицинской помощи. Рентгенограмма грудной клетки может выявить узелок / массу в легких, которые указывают на рак, хотя чувствительность и специфичность ограничены.
КТ обеспечивает лучшую оценку легких с более высокой чувствительностью и специфичностью в отношении рака легких по сравнению с рентгенограммой грудной клетки (хотя все еще значительный процент ложноположительных результатов). Компьютерная томография (КТ), специально предназначенная для оценки рака легких, включает грудную клетку и верхнюю часть живота. Это позволяет оценить другие соответствующие анатомические структуры, такие как близлежащие лимфатические узлы, надпочечники, печень и кости, которые могут свидетельствовать о метастатическом распространении болезни. Действительно, Целевая группа профилактических служб США рекомендует ежегодно проходить скрининг с применением КТ в низких дозах у взрослых в возрасте от 55 до 80 лет, которые курят 30 упаковок в год и в настоящее время курят или бросили курить в течение последних 15 лет, с некоторыми оговорками (см. Скрининг рака легких ).
Ядерная медицинская визуализация, такая как ПЭТ / КТ и сканирование костей, также могут быть полезны для диагностики и выявления метастазов в других частях тела. ПЭТ / КТ использует метаболически активный индикатор, который позволяет клиницистам идентифицировать гиперметаболические участки тела. Повышенное поглощение индикатора происходит в злокачественных клетках и областях воспаления или инфекции. Интеграция изображений, отражающих метаболическую активность, с нормальной КТ обеспечивает более высокую чувствительность и специфичность по сравнению с PET в отдельности.
МРТ предназначена для пациентов с запущенным заболеванием, где вероятно поражение внутричерепного или головного мозга. Оно также полезно для оценки протяженность грудной стенки, диафрагма агматическое, плечевое сплетение (например, в случае опухоли верхней борозды ) или поражение позвоночника.
Если возможно, биопсия любой подозреваемой опухоли легкого выполняется для микроскопической оценки вовлеченных клеток и, в конечном итоге, требуется для подтверждения диагноза. Сначала следует попытаться выполнить биопсию в отдаленных очагах поражения, чтобы установить гистологический диагноз и одновременно подтвердить стадию метастазирования. Материал биопсии также используется для анализа того, экспрессирует ли опухоль какие-либо специфические мутации, подходящие для тэгированной терапии (например, мутация EGFR или мутация ALK). Биопсия может быть выполнена с помощью бронхоскопии, трансторакальной игольчатой биопсии и тораскопической хирургии с использованием видео (VATS).
В то время как цитология мокроты имеет ограниченную полезность, торакоцентез или аспирация плевры жидкость с иглой с ультразвуковым контролем следует выполнять при наличии плеврального выпота. Когда злокачественные клетки идентифицируются в плевральном аспирате пациентов с высоким подозрением на рак легких, устанавливается окончательный диагноз и стадия (аденокарцинома легкого IV стадии).
Аденокарцинома легкого имеет тенденцию окрашивать муцин положительный, поскольку он получен из продуцирующих слизь желез легких. Подобно другим аденокарциномам, если эта опухоль хорошо дифференцирована (низкой степени злокачественности), она будет напоминать нормальную железистую структуру. Плохо дифференцированная аденокарцинома не будет напоминать нормальные железы (высокой степени злокачественности) и будет обнаружена по положительному окрашиванию на муцин (вырабатываемый железами). Аденокарциному также можно отличить путем окрашивания на TTF-1, клеточный маркер для аденокарциномы.
Как обсуждалось ранее, категория аденокарциномы включает в себя ряд подтипов, и любая опухоль имеет тенденцию быть гетерогенной по составу. Несколько основных подтипов в настоящее время признаны Всемирной организацией здравоохранения (ВОЗ) и (IASLC) / Американским торакальным обществом (ATS) / Европейским респираторным обществом (ERS): аденокарцинома с преобладающей лепидой, аденокарцинома с преобладанием ацинарной формы, аденокарцинома с преобладанием папиллярных клеток, аденокарцинома с преобладанием микропапиллярных клеток, аденокарцинома с преобладанием солидной и солидной аденокарциномы с преобладанием муцина. В 80% этих опухолей будут распознаваться компоненты более чем одного подтипа. Хирургически удаленные опухоли следует классифицировать по всестороннему гистологическому подтипу, описывающему паттерны поражения с шагом 5%. Затем преобладающий гистологический подтип используется для классификации опухоли в целом. Преобладающий подтип является прогностическим для выживания после полной резекции.
Чтобы выявить аденокарциноматозную линию солидного варианта, можно продемонстрировать внутриклеточную продукцию муцина. В эпителии проксимальнее аденокарциномы могут присутствовать очаги плоской метаплазии и дисплазии, но они не являются предшественниками этой опухоли. Скорее, предшественник периферических аденокарцином был назван атипичной аденоматозной гиперплазией (ААГ). Микроскопически ААГ представляет собой хорошо разграниченный очаг пролиферации эпителия, содержащий клетки кубовидной или низко столбчатой формы, напоминающие клубные клетки или пневмоциты типа II. Они демонстрируют различные степени цитологической атипии, включая гиперхромазию, плеоморфизм, выступающие ядрышки. Однако атипия не такая степень, как при явных аденокарциномах. Поражения AAH являются моноклональными и имеют много общих молекулярных аберраций (например, мутации KRAS ), которые связаны с аденокарциномами.
Signet ring и светлоклеточная аденокарцинома больше не являются гистологическими подтипами, но скорее цитологические особенности, которые могут возникать в опухолевых клетках нескольких гистологических подтипов, чаще всего солидная аденокарцинома.
Лечение аденокарциномы легкого зависит от нескольких факторов, включая стадия, резектабельность, статус работоспособности, гистологические и геномные изменения, приобретенные отдельной опухолью. Как и при большинстве типов рака, подходы к лечению можно условно разделить на 5 категорий: хирургия, химиотерапия, лучевая терапия, таргетная терапия и иммунотерапия.
Аденокарциномы легких на ранних стадиях (I, II и IIIA) обычно лечат хирургическим путем для удаления опухоли с помощью пневмонэктомии или лобэктомии, если при визуализирующих исследованиях и биопсии, и если пациент считается способным перенести операцию, оказывается, что он поддается операции. Часто применяется видео-ассистированная тораскопическая хирургия (VATS), которая заключается во введении тораскопа в небольшой разрез, сделанный в груди; через этот небольшой разрез можно удалить долю с помощью эндоскопа.
 Заболеваемость аденокарциномой легкого (выделена желтым цветом) по сравнению с другими типами рака легких, причем доля некурящих по сравнению с курильщиками показана для каждого типа.
Заболеваемость аденокарциномой легкого (выделена желтым цветом) по сравнению с другими типами рака легких, причем доля некурящих по сравнению с курильщиками показана для каждого типа. Для запущенных (стадия IV) и неоперабельных опухолей легких терапией первой линии является дуплетная химиотерапия на основе платины, сочетающая цисплатин или карбоплатин с другим цитотоксическим агентом. Режимы лечения сильно зависят от состояния здоровья и реакции каждого пациента, и, когда риск побочных эффектов может значительно ухудшить качество жизни, более рекомендуется базовая поддерживающая терапия. Химиотерапия также используется в качестве адъювантной терапии после операции для уничтожения оставшихся раковых клеток у пациентов с НМРЛ IIA, IIB и IIIA стадии.
Аденокарцинома - это немелкоклеточное легкое карцинома, и она не так чувствительна к лучевой терапии по сравнению с мелкоклеточной карциномой легкого. Однако лучевая терапия может использоваться в качестве адъювантной терапии для пациентов, перенесших операцию по резекции, чтобы снизить риск рецидива рака легких. Он также может принести пользу неоперабельным опухолям, локализованным в грудной клетке, и быть частью паллиативной помощи для улучшения качества жизни пациентов, не отвечающих на операцию или химиотерапию.
Доступна таргетная терапия для аденокарциномы легких с определенными молекулярными характеристиками. Ингибиторы тирозинкиназы (TKI) были разработаны для нацеливания на мутантные компоненты рецепторного тирозинкиназного пути, такие как EGFR, ALK и ROS1, которые часто проявляют изменения в аденокарциномах легких.
TKI EGFR первого поколения, включая гефитиниб и эрлотиниб, оказались более эффективными при лечении пациентов с мутацией EGFR в отношении цитотоксической химиотерапии. Ингибиторы второго поколения, такие как афатиниб и дакомитиниб, обеспечивают более широкую область применения, поскольку они способны воздействовать не только на сам белок EGFR, но и на другие члены семейство EGFR, такое как HER2 и HER4 (также известное как ERBB2 и ERBB4), и они показали улучшенную выживаемость без прогрессирования по сравнению с гефитинибом. Поскольку наиболее частой причиной приобретенной устойчивости к TKI первого поколения является вторая мутация EGFR в кодоне 790, TKI EGFR третьего поколения, осимертиниб, также был разработан для воздействия на эту новую мутацию. Амплификация МЕТ является другим известным механизмом приобретенной устойчивости.
Ингибиторы ALK, такие как кризотиниб, показали свою эффективность против опухолей, содержащих слияния ALK. Большинство пациентов, ранее получавших кризотиниб, получили пользу от ингибиторов ALK второго поколения, включая церитиниб, алектиниб и бригатиниб. Устойчивость к ингибиторам ALK может возникать при новых приобретенных мутациях или амплификациях ALK.
Также ROS1-положительные опухоли показали высокую чувствительность к ингибиторам ALK из-за высокой гомологии между киназными доменами ROS1 и ALK.
Иммунный ответ можно предотвратить путем активации иммунных контрольных точек, которые состоят в связывании белка-лиганда (например, PD-L1 ) к рецептору (например, PD-1 ) на поверхности иммунных клеток. Как следствие, раковые клетки, экспрессирующие PD-L1, могут инактивировать Т-клетки, тем самым способствуя росту опухоли. Ингибиторы иммунных контрольных точек были разработаны для восстановления опосредованного Т-клетками противоопухолевого иммунитета путем блокирования лиганда или рецептора.
Ингибиторы иммунных контрольных точек были одобрены для лечения НМРЛ, включая анти-PD-1 ниволумаб и пембролизумаб. Препараты против PD-1 используются для пациентов с запущенным НМРЛ, опухоли которых прогрессируют после цитотоксической химиотерапии первой линии. Пембролизумаб был создан как новый стандарт лечения пациентов с прогрессирующим или метастатическим НМРЛ с высоким уровнем экспрессии PD-L1, и ответы на него еще более выражены для опухолей с высоким мутационным бременем (т.е. с повышенным числом мутаций).
Терапевтические подходы, сочетающие несколько ингибиторов иммунных контрольных точек или одного ингибитора иммунных контрольных точек и цитотоксического агента, проходят клинические испытания по состоянию на 2018 год. Также исследуется потенциальная роль анти-PD-1 средств в качестве неоадъювантной терапии при операбельных НМРЛ.
Что касается других подтипов рака легкого, заболеваемость аденокарциномой легкого тесно связана с курением.
Заболеваемость аденокарциномой легких за последние несколько десятилетий увеличивалась во многих развитых западных странах, и по состоянию на 2012 г. ее доля достигла 43,3% от всех случаев рака легких в США, что заменило плоскоклеточный рак легкого. как наиболее распространенный тип рака легких. Это можно в значительной степени объяснить снижением количества курящих, что способствует гистологии аденокарциномы. Действительно, хотя курение по-прежнему является самым сильным фактором риска, аденокарцинома легких на сегодняшний день является наиболее распространенной среди некурящих на протяжении всей жизни (<100 cigarettes in a lifetime)..