 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Иресса |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a607002 |
| Данные лицензии | |
| Беременность. категория |
|
| Пути введения. | перорально |
| код УВД | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные данные | |
| Биодоступность | 59% ( перорально) |
| Связывание с белками | 90% |
| Метаболизм | Печень (в основном CYP3A4 ) |
| период полувыведения | 6–49 часов |
| Выведение | Фекалии |
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| Панель управления CompTox (EPA <222804 DTXS | |
| ECHA InfoCard | 100.171.043 |
| Химические и физические данные | |
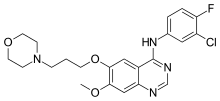
| Формула | C22H24ClFN 4O3 |
| Молярная масса | 446,91 г · моль |
| 3D-модель (JSmol ) | |
УЛЫБКИ
| |
InChI
| |
Гефитиниб (ZD1839 ) (INN,, торговое наименование Iressa ) - это наркотик для некоторых видов рака груди, легких и других видов рака. Гефитиниб представляет собой ингибитор EGFR, как и эрлотиниб, который прерывает передачу сигналов через рецептор эпидермального фактора роста (EGFR) в клетках-мишенях. Следовательно, он эффективен только при раке с мутированным и сверхактивным EGFR. Он продается AstraZeneca и Teva.
Гефитиниб - первый селективный ингибитор рецептора эпидермального фактора роста (EGFR) домен тирозинкиназы. Таким образом, гефитиниб является ингибитором EGFR. Целевой белок (EGFR) является членом семейства рецепторов (ErbB ), которое включает Her1 (EGFR), Her2 (erb-B2), Her3 (erb-B3) и Her4 (Erb-B4).. EGFR сверхэкспрессируется в клетках некоторых типов человеческих карцином - например, при раке легких и молочной железы. Это приводит к несоответствующей активации антиапоптотического сигнального каскада Ras, что в конечном итоге приводит к неконтролируемой пролиферации клеток. Исследования чувствительного к гефитинибу немелкоклеточного рака легких показали, что мутация в домене тирозинкиназы EGFR ответственна за активацию антиапоптотических путей. Эти мутации, как правило, приводят к повышенной чувствительности к ингибиторам тирозинкиназы, таким как гефитиниб и эрлотиниб. Из всех типов гистологии немелкоклеточного рака легкого аденокарцинома является типом, который чаще всего несет в себе эти мутации. Эти мутации чаще встречаются у азиатов, женщин и некурящих (у которых также чаще встречается аденокарцинома).
Гефитиниб ингибирует тирозинкиназу EGFR путем связывания с аденозинтрифосфат (АТФ) -связывающим сайтом фермента. Таким образом, функция тирозинкиназы EGFR по активации каскада передачи антиапоптотического сигнала Ras подавляется, а злокачественные клетки подавляются.
В настоящее время гефитиниб используется продается более чем в 64 странах.
Иресса была одобрена и поступила на рынок с июля 2002 г. в Японии, что сделало ее первой страной, импортирующей препарат.
FDA одобрило Гефитиниб в мае 2003 г. для лечения немелкоклеточного рака легкого (НМРЛ). Он был одобрен в качестве монотерапии для лечения пациентов с местнораспространенным или метастатическим НМРЛ после неэффективности химиотерапии на основе платины и доцетаксела. то есть в качестве терапии третьей линии.
В июне 2005 г. FDA отозвало разрешение на использование у новых пациентов из-за отсутствия доказательств того, что он продлевает жизнь.
В Европе гефитиниб показан с 2009 г. при запущенном НМРЛ во всех линиях. лечения для пациентов с мутациями EGFR. Эта маркировка была присвоена после того, как гефитиниб был продемонстрирован как препарат первой линии для значительного улучшения выживаемости без прогрессирования заболевания по сравнению с режим дублета платины у пациентов с такими мутациями. IPASS был первым из четырех исследований фазы III, подтвердивших превосходство гефитиниба в этой популяции пациентов.
В большинстве других стран, где гефитиниб в настоящее время продается, он одобрен для пациентов с распространенным НМРЛ, которые получали как минимум один предыдущий режим химиотерапии. Тем не менее, заявки на расширение его ярлыка в качестве препарата первой линии для лечения пациентов с мутациями EGFR в настоящее время находятся в процессе на основании последних научных данных. По состоянию на август 2012 г. Новая Зеландия одобрила гефитиниб в качестве препарата первой линии для пациентов с мутацией EGFR при наивном местно-распространенном или метастатическом неоперабельном НМРЛ. Он финансируется государством на первоначальный 4-месячный срок и возобновляется, если нет прогрессирования.
13 июля 2015 г. FDA одобрило гефитиниб в качестве препарата первой линии для лечения НМРЛ.
В августе 2013 года BBC сообщила, что исследователи из Эдинбурга и Мельбурна обнаружили в небольшом исследовании из 12 пациенток, эффективность метотрексата для лечения внематочной беременности улучшилась при применении гефитиниба.
IPASS (IRESSA) Паназиатское исследование) было рандомизированным, крупномасштабным, двойным слепым исследованием, в котором сравнивали гефитиниб с карбоплатином / паклитакселом в качестве лечения первой линии при распространенном НМРЛ. IPASS изучил 1217 пациентов с подтвержденной гистологией аденокарциномы, которые были или никогда не курили. Предварительно запланированный анализ подгрупп показал, что выживаемость без прогрессирования (ВБП) для гефитиниба была значительно дольше, чем при химиотерапии у пациентов с опухолями с положительной мутацией EGFR (HR 0,48, 95% ДИ 0,36–0,64, p менее 0,0001), и значительно дольше для химиотерапии, чем гефитиниб, у пациентов с опухолями с отрицательной мутацией EGFR (HR 2,85, 95% доверительный интервал 2,05–3,98, p менее 0,0001). В 2009 году это был первый случай, когда таргетная монотерапия продемонстрировала значительно более длительную выживаемость без плода, чем дуплетная химиотерапия.
Roche Diagnostics, Genzyme, QIAGEN, Argenomics SA и другие компании проводят тесты для выявления мутаций EGFR, предназначенные для того, чтобы помочь предсказать, какие пациенты с раком легких могут лучше всего реагировать на некоторые методы лечения, включая гефитиниб и эрлотиниб.
Эти тесты исследуют генетику опухолей, удаленных для биопсии, на наличие мутаций, делающих их уязвимыми для лечения.
Тест на мутацию EGFR может также помочь AstraZeneca получить разрешение регулирующих органов на использование своих препаратов в качестве начальных методов лечения. В настоящее время ингибиторы ТК разрешены к применению только после того, как другие лекарства не действуют. В случае гефитиниба препарат действует только у 10% пациентов с далеко зашедшим немелкоклеточным раком легкого, наиболее распространенным типом рака легких.
Так как гефитиниб является селективным химиотерапевтическим агентом, его профиль переносимости лучше, чем у предыдущих цитотоксических агентов. Побочные реакции на лекарства (ADR) допустимы при потенциально смертельном заболевании.
Сыпь, похожая на угри, встречается очень часто. Другие частые побочные эффекты (≥1% пациентов) включают: диарею, тошноту, рвоту, анорексию, стоматит, обезвоживание, кожные реакции, паронихия, бессимптомное повышение ферментов печени, астения, конъюнктивит, блефарит.
Редкие побочные эффекты (0,1–1% пациентов) включают: интерстициальное заболевание легких, эрозию роговицы, аберрантный рост ресниц и волос.