 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Гексахлортрифосфазен | |
| Другие названия Фосфонитрилфосфат. Гексахлорциклотрифосфазен. Трифосфонитрилхлорид. 2,2,4,4,6,6-гексахлор-2,2,4,4,6,6-. гексагидро-1,3,5,2, 4,6-триазатрифосфорин | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.012.160 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | N3Cl6P3 |
| Молярная масса | 347,66 г / моль |
| Внешний вид | бесцветные кристаллы таллы |
| Плотность | 1,98 г / мл при 25 ° C |
| Температура плавления | от 112 до 115 ° C (от 234 до 239 ° F; От 385 до 388 K) |
| Температура кипения | разлагается |
| Растворимость в воде | разлагается |
| Растворимость в хлороуглеродах | растворим |
| Структура | |
| Дипольный момент | 0 D |
| Опасности | |
| Основные опасности | легкое раздражение |
| Температура вспышки | Невоспламеняющийся |
| Если не указано иное, данные приводятся для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Гексахлорфосфазен представляет собой неорганическое соединение формулой (NPCl 2)3. Молекула имеет циклический остов, который можно описать как состоящий из чередующихся одинарных и двойных связей между атомами фосфора и азота (отсюда классифицируется как a фосфазен ). Его можно рассматривать как тример гипотетического соединения N≡PCl 2 (фосфонитрилхлорид; отсюда альтернативное, более архаичное название тример фосфонитрилхлорида для соединения). 108>
Гексахлортрифосфазен вместе с родственными (NPCl 2)4предшественники неорганических полимеров, называемые полифосфазены, а также являются наиболее распространенным исходным материалом для изучения замещенных соединений.
Химикам давно известны кольца, содержащие чисто углерод или углерод и другие элементы, например бензол, пиридин или циклогексан. Родственные циклические соединения, лишенные углерода, также были изучены; гексахлортрифосфазен является одним из таких неорганических колец. Другие хорошо известные неорганические кольцевые системы включают боразин, S4N4 и циклические силоксаны.
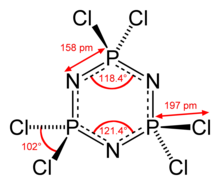
Циклофосфазены, такие как гексахлортрифосфазен, отличаются характерным типом связывания с заметной стабильностью и равной (с небольшими вариациями) длиной связи вдоль рингм, что делает традиционное изображение слева вводящим в заблуждение. Чтобы учесть это, в ранних моделях связывания использовалась делокализованная π-система, возникающая в результате перекрытия орбиталей N 2p и P 3d, напоминающая связывание в неорганических ароматических соединениях, таких как боразин (изображен в середине).
Тем не менее, современные расчеты показывают, что вклад P 3d пренебрежимо мал, что опровергает более раннюю гипотезу; вместо этого более общепринята модель с разделением зарядов. Согласно этому описанию, связь P – N рассматривается как очень поляризованная (между условными P и N, как показано справа) с достаточным ионным характером, чтобы составлять большую часть прочности связи.
Остальная (~ 15%) прочности связи может быть отнесена на счет отрицательного гиперконъюгационного взаимодействия : N неподеленных пар могут отдавать некоторую электронную плотность в π- принятие σ * молекулярных орбиталей на P.
Реакция PCl 5 и NH4Cl дает смесь веществ с эмпирической формулой (PNCl 2)n, где n обычно принимает значения n = 2 (димер), n = 3 (тример гексахлортрифосфазен) и n = 4 (тетрамер).

Эти кольца описаны в Либих в 1832 году в своем исследовании реакции PCl 5 и NH3 :
Реакции обычно проводят в растворе хлорбензола.
Очистка сублимацией дает в основном тример и тетрамер, в то время как медленная сублимация в вакууме примерно при 60 ° C дает чистый тример, свободный от тетрамера.Условия реакции, такие как температура, также могут быть отрегулированы для максимизации выхода тример за счет других возможных продуктов; тем не менее, коммерческие образцы гексахлортрифосфазена обычно содержат значительные количества октахлортетрафосфазена, даже до 40%.
Благодаря высокой электрофильности атомов P в кольце и природы хлорида как хорошей уходящей группы, гексахлорфосфазен может легко реагировать с нуклеофилами, которые замещают Cl у P по механизму, описанному как SN2 атака фосфором. Переходное состояние не особенно сложно сформировать, когда стерические факторы не мешают, поскольку его пентакоординированное тригонально-бипирамидное расположение в точке P совсем не является необычным для соединений P (V).
Наиболее распространенной заменой является замена алкоксидами как алифатических, так и ароматических спиртов, которая легко протекает, когда спирт уже депротонирован с образованием гексазамещенных трифосфазенов.

Полизамещение исходного фосфазена поднимает вопрос о региоселективности. Установлено, что доминирующими факторами, влияющими на это, являются: (а) стерические эффекты; и (b) способность неподеленной пары алкокси-кислорода к π-бэкдонату к атому Р, в котором произошло замещение, уменьшая электрофильность последнего и дезактивируя его в направлении дальнейшего замещения. В сочетании эти факторы обычно приводят к сильному предпочтению 2,4 атаке 2,2 монозамещенных промежуточных соединений (обратите внимание, что нумерация положений кольца начинается с N). Затем они продолжают образовывать 2,4,6-тризамещенные и 2,2,4,6-тетразамещенные промежуточные продукты, прежде чем почти неизбежно дойдут до гексазамещения (неполностью замещенные побочные продукты имеют тенденцию быть незначительными по концентрации, при условии, что достаточно эквивалентов алкоксида и нагревания).
Полученные гексалкоксифосфазены (особенно арилокси разновидности) ценятся за их высокую термическую и химическую стабильность, фактически находя применение в качестве огнестойких материалов и высокотемпературных смазок.
Гексахлорфосфазен является предшественником поли (дихлорфосфазена) или «неорганического каучука», открытие которого приписывается 1896 году. При нагревании до ок. 250 ° C, тример подвергается полимеризации с раскрытием кольца с образованием линейного полимера (PNCl 2)n, где n обычно находится в диапазоне около 15000 повторяющихся звеньев. Тетрамер также полимеризуется таким образом, хотя и с гораздо меньшей скоростью, чем тример; поэтому его присутствие в неочищенном исходном материале гексахлорфосфазене может заметно увеличить время, необходимое для завершения полимеризации.

Полученный неорганический хлорполимер был изучен в качестве исходного точка для широкого класса полимеров, вместе известных как полифосфазены. Последующее замещение хлоридных групп в атомах фосфора в основной цепи полидихлорфосфазенового каучука другими нуклеофильными группами, особенно алкоксидами как изложено выше, дает множество охарактеризованных производных.Некоторые из этих полифосфазенов кажутся многообещающими для потенциальных коммерческих применений, таких как высокоэффективные эластомеры или термопласты с различными желательными свойствами.
Тример также нашел применение в исследованиях, позволяя проводить реакции ароматического сочетания между пиридином и либо N, N-диалкиланилинами, либо индолом, приводя к 4,4'-замещенным производным фенилпиридина, которые, как предполагается, проходят через промежуточное соединение соли циклофосфазенпиридиния.
Соединение также можно использовать в качестве реагента пептидного связывания для синтеза олигопептидов в хлороформе, хотя для этого применения тетрамер обычно оказывается более эффективным.
Наконец, и тример, и тетрамер могут фотохимически реагировать при растворении в гексан, декалин, бензол или толуол, образующие прозрачные жидкости, идентифицированные как алкилзамещенные по P производные в форме (NPCl 2-x Rx)n = 3,4. Такие реакции протекают при длительном освещении UVC (ртутная дуга ), но циклофосфазеновые кольца не затрагиваются, что свидетельствует об их заметной химической стабильности. Действительно, твердые пленки тримера и тетрамера не претерпевают никаких химических изменений в таких условиях облучения, когда они не находятся в растворе.
| На Wikimedia Commons есть материалы, связанные с гексахлорфосфазеном. |