 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Avandia |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a699023 |
| Данные лицензии |
|
| Беременность. категория |
|
| Способы введения. | Внутрь |
| Код АТС | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные данные | |
| Биодоступность | 99% |
| Связывание с белками | 99,8 % |
| Метаболизм | Печень (Опосредовано CYP2C8 ) |
| Период полувыведения | 3–4 часа |
| Выведение | Почки (64 %) и фекалии (23%) |
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| PDB лиганд | |
| CompTox Dashboard (EPA ) | |
| ECHA InfoCard | 100.108.114 |
| Химические и физические данные | |
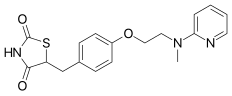
| Формула | C18H19N3O3S |
| Молярная масса | 357,43 г · моль |
| 3D-модель (JSmol ) | |
| Хиральность | Рацемическая смесь |
| Точка плавления | от 122 до 123 ° C (От 252 до 253 ° F) |
УЛЫБКА
| |
InChI
| |
| (что это?) | |
Росиглитазон (торговое название Авандия ) является противодиабетическим препаратом из класса тиазолидиндионов. Он работает как сенсибилизатор инсулина, связываясь с PPAR в жировых клетках и делая клетки более чувствительными к инсулину. Он продается фармацевтической компанией GlaxoSmithKline (GSK) как отдельный препарат или для использования в комбинации с метформином или с глимепиридом. Впервые выпущенный в 1999 году, годовой объем продаж достиг примерно 2,5 миллиардов долларов в 2006 году; однако после проведения метаанализа в 2007 году, который связал употребление препарата с повышенным риском сердечного приступа, продажи упали до 9,5 миллионов долларов в 2012 году. Срок действия патента на препарат истек в 2012 году..
Он был запатентован в 1987 г. и одобрен для медицинского использования в 1999 г. Несмотря на эффективность розиглитазона в снижении уровня сахара в крови при сахарном диабете 2 типа, его использование резко сократилось, поскольку исследования показали очевидную связь с повышенным риск сердечных приступов и смерти. Побочные эффекты, предположительно вызванные розиглитазоном, стали предметом более 13 000 исков против GSK; По состоянию на июль 2010 г. GSK согласилась урегулировать более 11 500 таких исков.
Некоторые рецензенты рекомендовали исключить розиглитазон с рынка, но группа FDA не согласилась с этим, и он остается доступным в США. С ноября 2011 г. по ноябрь 2013 г. федеральное правительство не разрешало Avandia продаваться без рецепта сертифицированного врача; кроме того, пациенты должны были быть проинформированы о рисках, связанных с его использованием, и препарат необходимо было приобретать по почте через определенные аптеки. В 2013 году FDA отменило ранее применявшиеся ограничения на розиглитазон после рассмотрения результатов исследования 2009 года, которое не продемонстрировало повышенного риска сердечного приступа.
В Европе Европейское агентство по лекарственным средствам (EMA) В сентябре 2010 г. рекомендовано приостановить прием препарата, поскольку польза от него больше не перевешивает риски. Он был снят с продажи в Великобритании, Испании и Индии в 2010 году, а также в Новой Зеландии и Южной Африке в 2011 году.
Розиглитазон был одобрен для гликемический контроль у людей с диабетом 2 типа, измеренный по гликозилированному гемоглобину A1c (HbA1c) в качестве суррогатной конечной точки, аналогично таковому для других пероральных противодиабетических препаратов. Разногласия по поводу побочных эффектов резко снизили использование розиглитазона.
Опубликованные исследования не предоставили доказательств того, что розиглитазон оказывает положительное влияние на такие исходы, как смертность, заболеваемость, побочные эффекты, затраты и качество жизни, связанное со здоровьем.
Одной из проблем безопасности, выявленных перед утверждением, была задержка жидкости. Более того, комбинация розиглитазона с инсулином приводила к более высокому уровню застойной сердечной недостаточности. В Европе были противопоказания к применению при сердечной недостаточности и комбинации с инсулином.
Мета-анализ всех исследований 2010 и 2019 годов подтвердил более высокий риск сердечной недостаточности и двойной риск при назначении розиглитазона в качестве дополнения. терапия инсулином. Два метаанализа реальных когортных исследований показали более высокий риск сердечной недостаточности по сравнению с пиоглитазоном. На каждые 100 000 пациентов, получавших розиглитазон, а не пиоглитазон, приходилось 649 дополнительных случаев сердечной недостаточности.
Относительный риск ишемических сердечных приступов, наблюдаемый в предварительных испытаниях розиглитазона, был аналогичен таковому у сопоставимых препаратов, но был повышен холестерин ЛПНП, соотношение холестерина ЛПНП / ЛПВП, триглицериды и вес.
В 2005 году по настоянию Всемирной организации здравоохранения GSK провела метаанализ всех 37 испытаний, связанных с использованием розиглитазона, и обнаружила, что коэффициент риска составляет 1,29 (от 0,99 до 1,89). В 2006 году GSK обновил анализ, который теперь включает 42 испытания и показывает коэффициент риска 1,31 (от 1,01 до 1,70). Большое обсервационное исследование, сравнивающее пациентов, получавших розиглитизон, с пациентами, получавшими другие методы лечения диабета, было проведено в то же время и обнаружило относительный риск 0,93 (95% ДИ 0,8–1,1) для пациентов, получавших розиглитазон. Информация была передана в FDA и размещена на веб-сайте компании, но не опубликована. GSK предоставила эти анализы в FDA, но ни компания, ни FDA не предупредили врачей и пациентов об опасности. Согласно FDA, Агентство не выпустило бюллетень по безопасности, потому что результаты метаанализа противоречили результатам наблюдательного исследования и результатам исследования ADOPT.
A метаанализ в мае 2007 г. сообщил о том, что Использование розиглитазона было связано с 1,4-кратным увеличением риска сердечного приступа и численно более высоким (но незначительным) увеличением риска смерти от всех сердечно-сосудистых заболеваний по сравнению с контролем. Он содержал 42 исследования, 27 из которых не были опубликованы. Другой метаанализ 4 испытаний с периодом наблюдения более 1 года показал аналогичные результаты. Метаанализ Ниссена подвергся критике в статье Джорджа Даймонда и др. В 2007 г. в Annals of Internal Medicine. Авторы пришли к выводу, что из анализа Ниссенса были исключены испытания с важными данными о сердечно-сосудистом профиле розиглитазона, были неправильно объединены испытания с сильно различающимся дизайном, а также были необоснованно исключены испытания без сердечно-сосудистых событий. Авторы пришли к выводу, что нельзя сделать однозначных выводов относительно того, увеличивает или снижает риск сердечно-сосудистых заболеваний розиглитазон. Исследователи из Cochrane Collaboration опубликовали собственный метаанализ использования розиглитазона при диабете II типа, заключив, что не было достаточных доказательств, подтверждающих какую-либо пользу для здоровья от розиглитазона. Отметив недавнюю публикацию Ниссена, они повторили свой мета-анализ, включив только испытания, включенные в исследование Ниссена, которые касались диабетиков II типа. (Исследование Nissen включало некоторые испытания на людях с другими расстройствами.) Они не обнаружили статистически значимого увеличения сердечно-сосудистых событий, но отметили, что все проанализированные ими сердечно-сосудистые конечные точки показали незначительную тенденцию к худшим результатам в группах розиглитазона.
В июле 2007 г. FDA провело совместное заседание Консультативного комитета по эндокринологическим и метаболическим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками. Ученый FDA Джой Меле представила метаанализ, в котором изучается сердечно-сосудистый риск розиглитазона в завершенных клинических испытаниях. Исследование показало, что в целом риск сердечно-сосудистых ишемических событий увеличился в 1,4 раза по сравнению с контрольной группой. Результаты были неоднородными, с четкими доказательствами повышенного риска по сравнению с плацебо, но не по сравнению с другими видами лечения диабета, и более высокий риск, связанный с комбинациями розиглитазона с инсулином или метформином. Основываясь на увеличении риска в 1,4 раза по сравнению с контрольными группами, ученый FDA Дэвид Грэм представил анализ, предполагающий, что розиглитазон вызвал 83 000 дополнительных сердечных приступов в период с 1999 по 2007 год. Консультативная группа проголосовала 20: 3 за то, что имеющиеся доказательства указывают на то, что розиглитазон увеличивает риск сердечно-сосудистых событий и 22: 1, что общее соотношение риска и пользы росиглитазона оправдывает его дальнейший маркетинг в Соединенных Штатах. FDA наложило ограничения на препарат, в том числе добавило предупреждение в рамке о сердечных приступах, но не отменило его.
В 2000 году Управление запросило исследование, направленное на устранение опасений относительно сердечно-сосудистой безопасности. Европейское агентство по лекарственным средствам (EMA). GSK согласилась провести постмаркетинговое исследование долгосрочной сердечно-сосудистой заболеваемости / смертности у пациентов, принимающих розиглитазон в сочетании с сульфонилмочевиной или метформином: исследование RECORD. Результаты, опубликованные в 2009 году, показали, что розиглитазон не уступает метформину или сульфонилмочевине в отношении частоты сердечно-сосудистых событий и смертности от сердечно-сосудистых заболеваний. Европейские регулирующие органы пришли к выводу, что отчасти из-за ограничений дизайна, результаты не доказали и не устранили опасения чрезмерного сердечно-сосудистого риска.
В феврале 2010 года заместитель директора FDA по безопасности лекарственных средств рекомендовал снять розиглитазон с рынка. В июне 2010 года они опубликовали ретроспективное исследование, в котором сравнивали розиглитазон с пиоглитазоном, другим тиазолидиндионом, продаваемым в Соединенных Штатах, и пришли к выводу, что розиглитазон связан с «повышенным риском инсульта, сердечной недостаточности и общей смертности, а также повышенным риском комбинированного препарата. ОИМ, инсульта, сердечной недостаточности или смертности от всех причин у пациентов 65 лет и старше ». Число , необходимое для нанесения вреда розиглитазоном, составляло шестьдесят. Грэм утверждал, что розиглитазон вызывает на 500 сердечных приступов больше и на 300 сердечных приступов больше, чем его основной конкурент.
Два метаанализа, выпущенные в 2010 г., один из которых включает 56 испытаний, а второй - 164, пришли к противоречивым выводам. Nissen et al. снова обнаружили повышенный риск сердечного инфаркта по сравнению с контролем, но не увеличили риск сердечно-сосудистой смерти. Mannucci et al. не обнаружили статистически значимого увеличения сердечных событий, но значительного увеличения сердечной недостаточности. Обзор классов лекарств 2011 года выявил повышенный риск сердечно-сосудистых побочных эффектов.
В метаанализе 16 обсервационных исследований, опубликованных в марте 2011 года, сравнивали розиглитазон и пиоглитазон, обнаруживая поддержку большей сердечно-сосудистой безопасности пиоглитазона. В метаанализе участвовали 810 000 пациентов, принимавших розиглитазон или пиоглитазон. Исследование предполагает 170 избыточных инфарктов миокарда, 649 избыточных случаев сердечной недостаточности и 431 избыточную смерть на каждые 100 000 пациентов, которые получали розиглитазон, а не пиоглитазон. Это было подтверждено другим метаанализом с участием 945 286 пациентов в 8 ретроспективных когортных исследованиях, большинство из которых проводилось в США.
В 2012 году Министерство юстиции США объявило, что GlaxoSmithKline согласилась признать себя виновным и выплатить штраф в размере 3 миллиардов долларов. частично из-за сокрытия результатов двух исследований безопасности Avandia для сердечно-сосудистой системы в период с 2001 по 2007 гг.
В метаанализе 4 случаев не было различий по всем причинам и смерти от сосудов. испытания против средств контроля. Два метаанализа когортных исследований выявили повышенный риск смерти от пиоглитазона.
Ретроспективное обсервационное исследование, проведенное с использованием данных Medicare, показало, что пациенты, получавшие розиглитазон, имели на 27% более высокий риск инсульта по сравнению с пациенты, получавшие пиоглитазон.
GlaxoSmithKline сообщила о большей частоте переломов предплечий, кистей и стоп у женщин, страдающих диабетом, получавших розиглитазон, по сравнению с теми, кто получал метформин или глибурид. Информация основана на данных исследования ADOPT. Такое же увеличение было обнаружено с пиоглитазоном (Actos), другим тиазолидиндионом.
. Метаанализ 10 РКИ с участием 13 715 пациентов, в том числе леченных розиглитазоном и пиоглитазоном. Пациенты показали общее повышение риска перелома на 45% при применении тиазолидона по сравнению с плацебо или активным препаратом сравнения. Это удвоило риск переломов у женщин с диабетом 2 типа без значительного увеличения риска переломов у мужчин с диабетом 2 типа.
Риск гипогликемии снижается с тиазолидиндионы по сравнению с сульфонилмочевинами ; риск аналогичен риску при применении метформина (высокая степень доказательности).
Оба тиазолидиндиона вызывают увеличение веса, аналогичное тому, которое вызывается сульфонилмочевиной. (доказательства умеренной силы).
Предполагается, что розиглитазон и пиоглитазон вызывают отек желтого пятна, который повреждает сетчатку глаза и вызывает частичную слепоту. Слепота также является возможным следствием диабета, для лечения которого предназначен розиглитазон. В одном отчете задокументировано несколько случаев и рекомендовано прекратить прием при первых признаках проблем со зрением. Ретроспективное когортное исследование показало связь между употреблением тиазолидиндионов и частотой диабетического макулярного отека (DME). Оба применения были связаны с повышением риска в 2,3 раза через 1 год и через 10 лет наблюдения, увеличиваясь до 3, если они были связаны с инсулином.
Имел место острый гепатит от умеренной до тяжелой степени. у нескольких взрослых, которые принимали препарат в рекомендованной дозе в течение двух-четырех недель. Концентрация розиглитазона в плазме может быть увеличена у людей с имеющимися проблемами печени.
И розиглитазон, и пиоглитазон противопоказаны людям с сердечной недостаточностью класса III и IV по NYHA. Их не рекомендуется использовать при сердечной недостаточности.
В Европе розиглитазон противопоказан при сердечной недостаточности или сердечной недостаточности в анамнезе на всех стадиях NYHA, для комбинированного применения с инсулином и при остром коронарном синдроме. Европейское агентство по лекарственным средствам 23 сентября 2010 г. рекомендовало прекратить выпуск препарата Avandia на европейский рынок.
 Две пероральные таблетки Avandia по 2 мг
Две пероральные таблетки Avandia по 2 мг Розиглитазон является членом класса препаратов тиазолидиндиона. Тиазолидиндионы действуют как сенсибилизаторы инсулина. Они снижают концентрацию глюкозы, жирных кислот и инсулина в крови. Они работают путем связывания с рецепторами, активируемыми пролифератором пероксисом (PPAR). PPAR представляют собой факторы транскрипции, которые находятся в ядре и активируются лигандами, такими как тиазолидиндионы. Тиазолидиндионы проникают в клетку, связываются с ядерными рецепторами и изменяют экспрессию генов. Несколько PPAR включают PPARα, PPARβ / δ и PPARγ. Тиазолидиндионы связываются с PPARγ..
PPAR экспрессируются в жировых клетках, клетках печени, мышц, сердца, внутренней стенки (эндотелия) и гладких мышц кровеносных сосудов. PPARγ экспрессируется в основном в жировой ткани, где он регулирует гены, участвующие в дифференцировке жировых клеток (адипоцитов), поглощении и хранении жирных кислот и поглощении глюкозы. Он также обнаружен в бета-клетках поджелудочной железы, эндотелии сосудов и макрофагах. Росиглитазон является селективным лигандом PPARγ и не обладает PPARα-связывающим действием. Другие препараты связываются с PPARα.
Росиглитазон, по-видимому, также оказывает противо- воспалительный эффект в дополнение к его действию на инсулинорезистентность. Ядерный фактор каппа-B (NF-κB ), сигнальная молекула, стимулирует воспалительные пути. Ингибитор NF-κB (IκB) подавляет воспалительные пути. Когда пациенты принимают розиглитазон, уровни NF-κB падают, а уровни IκB повышаются.
Розиглитазон был одобрен FDA США в 1999 году и EMA в 2000 году; Тем не менее, EMA потребовало проведения двух постмаркетинговых исследований долгосрочных побочных эффектов: одно для хронической сердечной недостаточности, а другое - для сердечно-сосудистых.
Продажи в США В 2006 году объем продаж препарата составил 2,2 миллиарда долларов. Продажи во 2 квартале 2007 года снизились на 22% по сравнению с 2006 годом. Продажи в 4 квартале 2007 года снизились до 252 миллионов долларов.
Хотя продажи снизились с 2007 года из-за проблем с безопасностью, общий объем продаж Avandia в 2009 году составил 1,2 миллиарда долларов по всему миру.
По данным аналитиков UBS, к марту 2010 года было подано 13 000 исков. Среди них были: округ Санта-Клара, Калифорния, который утверждает, что потратила 2 миллиона долларов на розиглитазон в период с 1999 по 2007 год в своей государственной больнице, и требует "тройной компенсации". В мае 2010 года GlaxoSmithKline (GSK) достигла соглашения об урегулировании некоторых исков против компании, согласившись выплатить 60 миллионов долларов для урегулирования 700 исков. В июле 2010 года GSK достигла мирового соглашения о закрытии еще 10 000 исков против нее, согласившись выплатить около 460 миллионов долларов для урегулирования этих исков.
В 2012 году Министерство юстиции США объявило, что GlaxoSmithKline согласился признать себя виновным и заплатить штраф в размере 3 миллиардов долларов, в частности, за удержание результатов двух исследований сердечно-сосудистой безопасности Avandia в период с 2001 по 2007 годы. Урегулирование связано с исками, поданными четырьмя сотрудниками GlaxoSmithKline, включая бывшего старшего менеджера по развитию маркетинга компании и региональный вице-президент, который сообщил правительству о ряде ненадлежащих действий с конца 1990-х до середины 2000-х.
GlaxoSmithKline расследовалась FDA и США. Конгресс по Avandia.
Сенатор-демократ Макс Бокус и республиканец Чарльз Грэссли подали отчет, призывающий GSK отозвать Avandia в 2008 году из-за побочных эффектов. В отчете отмечалось, что препарат вызывал 500 сердечных приступов, которых можно было избежать в месяц, и официальные лица Glaxo пытались запугать врачей, критиковавших препарат. В нем также говорится, что GSK продолжала продавать и продвигать препарат, несмотря на то, что знала о повышенном риске сердечных приступов и инсульта.
Финансовый комитет Сената в ходе группового расследования выявил электронные письма от официальных лиц компании GSK. это предполагает, что компания преуменьшает значение научных выводов о рисках безопасности, относящихся к 2000 году. Комитет также утверждал, что компания инициировала «кампанию по написанию фантомов», в ходе которой GSK стремилась к сторонним компаниям писать положительные статьи об Avandia и отправлять их в медицинские журналы. GSK защищалась, представив данные о том, что ее собственные тесты показали, что Avandia безопасна, хотя отчет персонала FDA показал, что выводы были ошибочными.
14 июля 2010 г., после двух дней обширных обсуждений, комиссия FDA провела расследование. Avandia проголосовала смешанно. Двенадцать членов комиссии проголосовали за изъятие препарата из продажи, 17 рекомендовали оставить его включенным, но с более пересмотренной предупреждающей этикеткой, а трое проголосовали за то, чтобы оставить его на рынке с нынешней предупреждающей этикеткой. Однако группа пришла к некоторым противоречиям; 20 июля 2010 года было обнаружено, что один из участников дискуссии был платным докладчиком GlaxoSmithKline, что вызвало вопросы о конфликте интересов. Этот член комиссии был одним из трех, кто проголосовал за то, чтобы Avandia оставалась на рынке без дополнительных предупреждающих надписей.
В 2011 году FDA решило пересмотреть информацию о назначениях и руководства по лекарствам для всех лекарств, содержащих росилитазон. Американская этикетка розиглитазона (Avandia, GlaxoSmithKline ) и всех препаратов, содержащих розиглитазон (Avandamet и), теперь включает дополнительную информацию о безопасности и ограничения. Пересмотренные этикетки ограничивают использование пациентами, которые уже принимают лекарство, содержащее розиглитазон, или новыми пациентами, которые не могут достичь адекватного гликемического контроля при применении других лекарств от диабета, а также тех, кто после консультации со своим лечащим врачом решил не принимать Actos (пиоглитазон ) или другие препараты, содержащие пиоглитазон, по медицинским показаниям.
В июне 2013 года Консультативный комитет FDA рассмотрел все доступные данные, включая пересмотренное исследование RECORD, не обнаружив никаких доказательств повышенного риска сердечно-сосудистых заболеваний. с Avandia и проголосовали за снятие ограничений на маркетинг Avandia в США. В ноябре 2013 года FDA США сняло эти маркетинговые ограничения на продукт. По указанию FDA разработчик Avandia, GlaxoSmithKline, профинансировал Институт клинических исследований Дьюка для повторного анализа исходных данных исследования. На панели 2010 года три участника проголосовали за то, что существующие предупреждения достаточно хороши; два были еще в 2013 году. Семь проголосовали за усиление этих предупреждений, и пять из них вернулись. Но из 10 проголосовавших за ограничение использования Avandia вернулись только четверо. А из 12, проголосовавших в 2010 году за вывод Avandia с рынка, только трое вернулись.
В 2000 году EMA запросило исследование, направленное на устранение опасений относительно сердечно-сосудистой безопасности., и производители согласились провести постмаркетинговое исследование долгосрочной сердечно-сосудистой заболеваемости / смертности у пациентов, принимающих розиглитазон в сочетании с сульфонилмочевиной или метформином: исследование RECORD. Результаты, опубликованные в 2009 году, показали не меньшую эффективность в отношении сердечно-сосудистых событий и смерти от сердечно-сосудистых заболеваний при сравнении лечения розиглитазоном с метформином или сульфонилмочевиной. Риск инфаркта миокарда не был статистически значимым. В своей оценке европейские регулирующие органы признали слабые стороны исследования, такие как неожиданно низкая частота сердечно-сосудистых событий и открытый дизайн, который может привести к смещению отчетности. Они обнаружили, что результаты неубедительны. 23 сентября 2010 г. Европейское агентство по лекарственным средствам рекомендовало приостановить продажу Avandia на европейском рынке.
Согласно исследованию, проведенному British Medical Journal в сентябре 2010 г., Комиссия Соединенного Королевства по лекарственным средствам для человека еще в июле 2010 года рекомендовал Агентству по регулированию лекарственных средств и товаров медицинского назначения (MHRA) отозвать продажу Avandia, поскольку «риски перевешивают преимущества». Кроме того, расследование показало, что в 2000 году члены Европейской комиссии, отвечающие за проверку Avandia до ее утверждения, были обеспокоены долгосрочными рисками, связанными с этим препаратом.
Росиглитазон был отозван с рынка Новой Зеландии в апреле 2011 года, поскольку Medsafe пришел к выводу, что предполагаемые сердечно-сосудистые риски этого лекарства для пациентов с диабетом 2 типа перевешивают его преимущества.
A В уведомлении, выпущенном Советом по контролю за лекарственными средствами Южной Африки 5 июля 2011 г., говорилось, что 3 июля 2011 г. он принял решение отозвать все лекарства, содержащие розиглитазон, с рынка Южной Африки из-за рисков для безопасности. Он запретил все новые рецепты Avandia.
После сообщений в 2007 году о том, что Avandia может значительно повысить риск сердечных приступов, препарат вызвал споры. В статье 2010 года в журнале Time дело Avandia используется как свидетельство неработоспособности регулирующей системы FDA, которая «может оказаться не только фатальной, но и преступной». В нем подробно рассказывается о неудачах в раскрытии информации, добавляя: «В отчетах Конгресса выяснилось, что GSK располагала ранними доказательствами сердечного риска, связанными с его препаратом, и что FDA знало об опасностях за несколько месяцев до того, как сообщило общественности». В нем говорится, что «FDA расследует, нарушила ли GSK закон, не проинформировав агентство о сердечных рисках Avandia», - сообщил заместитель комиссара FDA доктор Джошуа Шарфштейн. GSK пригрозила ученым, которые сообщали о неблагоприятных результатах исследований, и получила несколько писем с предупреждениями от FDA за вводящий в заблуждение маркетинг и отказ сообщить клинические данные. Производитель препарата GlaxoSmithKline столкнулся с серьезной негативной реакцией на компанию из-за разногласий по поводу препарата. Продажи препарата значительно упали после того, как эта история впервые появилась в 2007 году, упав с 2,5 миллиардов долларов в 2006 году до менее чем 408 миллионов долларов в 2009 году в США.
В ответ на рост риска сердечных приступов в Индии Правительство приказало GSK приостановить свое исследование под названием TIDE в 2010 году. FDA также приостановило исследование TIDE в Соединенных Штатах.
Три группы врачей: Эндокринное общество, Американская диабетическая ассоциация и Американская ассоциация клинических эндокринологов призвали пациентов продолжать прием препарата, поскольку было бы намного хуже прекратить лечение, несмотря на любой связанный с этим риск, но пациенты могли проконсультируйтесь со своим врачом и начните переход на другой препарат, если они или их врачи обнаружат беспокойство. Американская кардиологическая ассоциация заявила в заявлении в июне 2010 года: «... отчеты заслуживают серьезного рассмотрения, и пациенты с диабетом в возрасте 65 лет и старше, получающие розиглитазон, должны обсудить результаты с их лечащий врач.... ". «Для пациентов с диабетом наиболее серьезными последствиями являются болезни сердца и инсульт, и риск их возникновения значительно увеличивается при наличии диабета. Как и в большинстве ситуаций, пациенты не должны менять или прекращать прием лекарств, не посоветовавшись со своим лечащим врачом».
В результате дела Avandia FDA потребовало продемонстрировать кардиологическую безопасность новых лекарств для лечения диабета 2 типа. Этот процесс описан доктором Робертом Мисбином в статье INSULIN-History от FDA Insider, опубликованной 1 июня 2020 года на Amazon. Доктор Мисбин был первым рецензентом FDA для розиглитазона (Avandia) и предупредил о его способности повышать риск сердечно-сосудистых заболеваний.
Считалось, что розиглитазон может быть полезен пациентам с болезнью Альцгеймера, которые не экспрессируют аллель ApoE4 , но исследование фазы III, предназначенное для проверки этого, показало, что розиглитазон был неэффективен у всех пациентов, включая ApoE4 -отрицательных пациентов.
Розиглитазон также может лечить язвенный колит от легкой до умеренной, благодаря его противовоспалительным свойствам в качестве лиганда PPAR.
 Синтез розиглитазона: США Патент 5646169
Синтез розиглитазона: США Патент 5646169